木犀草素对人乳腺癌细胞胰岛素样生长因子-1的影响
刘雪飞
(白城医学高等专科学校,吉林 白城 137000)
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,是女性最常见的恶性肿瘤之一,其发病率逐年提高。研究发现,细胞因子介导的信号转导发生异常时,将导致细胞快速增殖、无限生长,最终形成肿瘤。胰岛素样生长因子(IGFs)在乳腺腺体发育和乳腺癌发生发展中起重要作用。IGF-1可通过自分泌和旁分泌的方式参与正常乳腺上皮细胞、良性和恶性乳腺肿瘤细胞的促分裂、抗凋亡效应,在乳腺病的形成过程中起重要作用〔1~4〕。木犀草素是从多种蔬菜、水果中分离出的一种天然黄酮类化合物。目前,体内外实验验证了木犀草素的抗肿瘤活性,其抗癌谱较广,毒性很低,是较为理想的抗肿瘤药物。本文旨在探讨木犀草素应用于乳腺癌临床治疗的可行性。
1 材料与方法
1.1材料和试剂 木犀草素购自中国药品生物制品检定所,纯度≥98%。MCF-7 细胞株购自中国医学科学院基础研究所细胞中心。小牛血清和RPMI1640培养基均购自GIBCO 公司,胰蛋白酶购自PAA公司。Trizol购自Invintrigen公司,反转录试剂盒、SYBR Green试剂和DNA Marker均购自Taraka公司。IGF-1引物及内参照β-actin由北京华大基因有限公司合成。IGF-1酶联免疫吸附试验(ELISA)试剂盒购自Sigma公司。
1.2引物设计 IGF-1正义序列为:5′-ATGAGTTCTGACACGGCGG-3′,反义序列为:5′-GTCGACCTAGGCACGGACGG-3′,扩增目的片段长度为210 bp。内参照物:β-actin正义:5′-GGCGGCACCACCATGTACCCT-3′,反义:5′-AGGGGCCGGACTCGTCATACT-3′,扩增目的片段长度为202 bp。
1.3方法
1.3.1总RNA的提取 取生长状态良好的对数期MCF-7细胞进行细胞传代,先弃培养液,磷酸盐缓冲液(PBS)洗2次,然后加入适量的0.25%胰蛋白酶消化,消化后弃去胰酶,补加适量培养基,制备单细胞悬液。调整细胞浓度为2×104个/ml,以每孔4 000个细胞接种于96孔板,培养24 h,待细胞贴壁后,加入终浓度分别为0、20、40、60、80、100 μmol/L的木犀草素溶液与细胞共同孵育24、48、72 h。弃去培养液,PBS洗2次,Trizol法提取细胞RNA,提取的RNA在-80℃冰箱内冻存备用。
1.3.2荧光定量PCR法检测IGF-1的表达 根据 TaqMan®PrimeScriptTMRT-PCR Kit Ⅱ说明书,以提取的 RNA 为模板,将其反转录为cDNA。全过程在冰上进行操作。反应条件:37℃ 15 min;85℃ 5 s使反转录酶失活,5 s 后降温至4℃。以不同反转录产物cDNA为模板,进行荧光定量检测。荧光定量 PCR 反应体系为20 μl,SYBR®Premix Ex TaqTM10 μl,Rox 0.4 μl,引物2.0 μl,模板1.0 μl,水6.6 μl。反应条件为95℃,30 s 95℃,5 s 55℃,33 s 40个循环;95℃ 15 s,55℃ 60 s,95℃ 15s。荧光定量PCR结果采用△△CT 法进行分析,相对定量结果按 2-△△CT进行计算。
1.3.3ELISA法检测IGF-1的分泌 取对数生长期的MCF-7细胞,以2×104个/孔接种于24孔板,培养24 h。无血清培养基饥饿培养24 h后,加入含0、10、20、40 μmol/L木犀草素的无血清培养液,继续培养6、12、24 h后,收集上清液,按照 IGF-1ELISA试剂盒操作要求,依次进行加样、孵育、洗涤,用酶标仪于450 nm波长下测定上清液的光吸收值。用Curve Exert 1.3软件绘制标准曲线,计算IGF-1含量。IGF-1的检测灵敏度为1.0 ng/ml。
1.4统计学处理 采用 SPSS16.0软件进行分析。多样本均数比较用单因素方差分析,两样本均数比较用t检验。
2 结 果
2.1木犀草素对MCF-7细胞中IGF-1 mRNA水平变化的影响 MCF-7 细胞表达IGF-1。木犀草素能够影响 MCF-7 细胞IGF-1的表达水平,且呈时间和剂量依赖关系。即随着木犀草素浓度的增加,作用时间的延长,IGF-1的相对表达量显著降低(P<0.01)。见图1。

图1 IGF-1 mRNA 在木犀草素作用不同时间后MCF-7细胞中的相对表达量
2.2木犀草素对MCF-7细胞中IGF-1含量的影响 MCF-7 细胞可向细胞培养基中分泌IGF-1。木犀草素能够影响 MCF-7 细胞分泌 IGF-1,且呈时间和剂量依赖关系。40 μmol/L木犀草素作用于细胞24 h后,与对照组相比,IGF-1含量显著降低35.6%(P<0.05)。见表1。
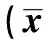
表1 木犀草素对不同培养时间MCF-7细胞中IGF-1含量的影响±s,ng/ml)
3 讨 论
目前,分子靶向药物是用于乳腺癌治疗的研究热点之一。由于化学药物治疗法和放射治疗法对于患者存在很大的危险性,各国学者正在寻找抗肿瘤效果好、安全性高、副作用小的天然的抗乳腺癌药物。黄酮类药物以其种类多、安全性强、抗肿瘤谱广泛、抗肿瘤细胞增殖作用效果明显、毒副作用小、不易产生耐药性等特点,成为国内外筛选抗肿瘤药物的重要资源之一。木犀草素是从天然药物、蔬菜果实中分离得到的一种有较强抗肿瘤活性的天然黄酮类化合物,具有广谱抗肿瘤活性。
木犀草素分布广泛于自然界中,可从金银花、菊花等多种天然药物和芹菜、甜椒等蔬菜果实中分离得到。化学名为3′,4′,5,7-四羟基黄酮,化学式为C15H10O6。近年来的研究发现,木犀草素能抑制多种肿瘤细胞的增殖作用。Chang等〔5〕发现低剂量的木犀草素可抑制5种肝癌细胞系PLC/PRF/5、Hep 3B和HA22T/VGH细胞的增殖,但需较高的浓度木犀草素才能抑制HepG2 和SK-Hep 1的增殖作用。Wu等〔6〕研究发现,木犀草素还可以剂量时间依赖的方式抑制胃癌细胞的生长,并可将细胞周期阻滞在G2/M期,上调caspase-3,6,9,Bax,p53蛋白的表达,下调bcl-2的表达,来抑制胃癌细胞的增殖作用。木犀草素还能诱导肿瘤细胞凋亡。Brusselmans等〔7〕指出,木犀草素可以抑制乳腺癌和前列腺癌细胞的脂肪酸合成酶活性,从而发挥其抗肿瘤细胞增长和诱导其凋亡的作用。还有研究显示,用木犀草素处理人肺癌A549细胞,流式细胞仪分析可显示出Sub-G1期峰值, PCR分析检测出caspase-3基因表达降低,WB检测出caspase-3蛋白表达降低,说明木犀草素可诱导A549细胞发生凋亡〔8〕。同时,木犀草素还可作为肿瘤细胞凋亡增敏剂,Du等〔9〕研究表明,木犀草素可抑制乳腺癌细胞的生长,并可增敏阿霉素对乳腺癌细胞的凋亡诱导作用。另外,木犀草素还能影响肿瘤细胞周期分布。Kim等〔10〕研究发现,木犀草素可以显著抑制血小板源性生长因子-BB(PDGF-BB)诱导的血管平滑肌细胞的增殖作用,并可将细胞周期阻滞于G1期。此外,木犀草素可封闭血管内皮细胞黏附分子的黏附,以限制肿瘤的生长和转移;还可抑制肿瘤血管内皮细胞的生长,以减少肿瘤组织血管生成,从而限制肿瘤生长〔11〕。
IGF-1 是一种重要的多功能细胞因子,与胰岛素高度同源,具有快速代谢效应和促分裂效应〔12〕。在机体内当 IGF-1与 IGF-IR 形成配体受体复合物时,引起受体聚集、自磷酸化和酪氨酸激酶的活化等一系列变化,激活PI3K/Akt和 Ras-MAPK两条信号通路〔13~15〕,产生促进细胞增殖﹑存活及抗细胞凋亡的作用。有文献报道,乳腺癌患者患病组织IGF-1呈高表达状态。研究发现,IGF-1 能诱导乳腺上皮细胞中血管生成因子的大量表达,促进肿瘤组织的血管生成,从而诱导乳腺癌的发生与转化〔16〕。同时参与肿瘤细胞周期调节等效应,在乳腺癌的发生发展中发挥着重要的作用。本研究结果显示,在乳腺癌 MCF-7细胞中添加木犀草素,能显著抑制IGF-1基因的表达,并随着木犀草素浓度的增加,IGF-1相对表达量逐渐降低。木犀草素可以抑制IGF-1基因的表达,实现对IGF-1介导的信号通路进行干扰,进而发挥其抗肿瘤的作用。在对培养的MCF-7细胞上清液中进行IGF-1含量检测时发现,在乳腺癌 MCF-7细胞中添加木犀草素,能显著抑制上清液中IGF-1的分泌,并随着木犀草素浓度的增加,IGF-1分泌量逐渐降低。这与木犀草素对IGF-1基因表达的影响相一致。这表明,木犀草素对MCF-7细胞IGF-1的影响在基因水平和蛋白水平都能实现。木犀草素通过抑制IGF-1基因表达及其分泌,实现对IGF-1介导的信号转导通路进行干扰,进而发挥其抗肿瘤的作用。
综上,乳腺癌的发生发展是一个复杂过程,抗肿瘤药物的作用靶点也多种多样,明确木犀草素对乳腺癌发生发展中关键细胞因子的影响,对分析木犀草素的详细抗肿瘤通路奠定实验基础,也将为今后的抗肿瘤安全特效药的开发提供理论依据。
4 参考文献
1Jemal A,Siegel R,Ward E,etal.Cancer statisties2009〔J〕. CA Cancer J Clin,2009;59(4):225-49.
2Stuver SO,Kuper H,Tzonou A,etal.Insulin-like growth factor 1 in hepatocellular carcinoma and metastatic liver cancer in men〔J〕. Int J Cancer,2000;87(1): 118-21.
3Misawa A,Hosoi H,Arimoto A,etal.N-Mye induction stimulated by insulin-like growth factor 1 through mitogen-activated protein kinase signaling pathway in human neuroblastoma cells〔J〕. Cancer Res,2000;60(1):64-9.
4Fukuda R,Hirota K,Fan F,etal.IGF-1 induces HIF-1-mediated VEGF expression that is dependent on MAP kinase and PI-3-kinase signaling in colon cancer cell〔J〕. J Biol Chem,2002;277(41):38205-11.
5Chang J,Hsu Y,Kuo PL,etal.Increase of Bax/ Bcl-XL ratio and arrest of cell cycle by luteolin in immortalized human hepatoma cell line〔J〕. Life Sci,2005;76(16):1883-93.
6Wu B,Zhang Q,Shen W,etal.Anti-proliferative and chemo-sensitizing effects of luteolin on human gastric cancer AGS cell line〔J〕. Mol Cell Biochem,2008;313(1-2):125-32.
7Brusselmans K,Vrolix R,Verhoeven G,etal.Induction of cancer cell apoptosis by flavonoids is associated with their ability to inhibit fatty acid synthase activity〔J〕. J Biol Chem,2005; 280(7):5636-45.
8Te CH,Chung SJ,Hsueh FL. Luteolin induce apoptosis in human lung cell line(A549)through activation of caspase 3 and P53 pheno typic changes associated with SCLC progression〔J〕. Mol Biol,2001;2(2): 316-9.
9Du GJ,Song ZH,Lin HH,etal.Luteolin as a glycolysis inhibitor offers superior efficacy and lesser toxicity of doxorubicin in breast cancer cells〔J〕. Biochem Biophys Res Commun,2008;372(3):497-502.
10Kim JH,Jin YR,Park BS,etal.Luteolin prevents PDGF-BB-induced proliferation of vascular smooth muscle cells by inhibition of PDGF beta-receptor phosphorylation〔J〕.Biochem Pharmacol,2005;69(12): 1715-21.
11Bagli E,Stefaniotou M,Morbidelli L,etal.Luteolin inhibits vascular endot helial growth factor-induced angiogenesis ,inhibition of endot helial cell survival and proliferation by targeting phosphatidylinositol 3’-kinase activity〔J〕. Cancer Res,2004;64(21):7936-46.
12LeRoith D,Werner H,Beitner-Johnson D,etal.Molecular and cellular aspects of the insulin-like growth factor I receptor〔J〕. Endocr Rev,1995;16(2):143-63.
13Chun KH,Kosmeder JW,Sun S,etal.Effects of deguelin on the phosphatidylinositol 3-kinase/AKT pathway and apoptosis in premalignant human bronchial epithelial cells 〔J〕. J Natl Cancer Inst,2003;95(4):291-302.
14Brognard J,Clark AS,Ni Y,etal.Akt/protein kinase B is constitutively active in non-small cell lung cancer cells and promotes cellular survival and resistance to chemotherapy and radiation 〔J〕. Cancer Res,2001;61(10):3986-97.
15Balsara BR,Pei J,Mitsuuchi Y,etal.Frequent activation of AKT in non-small cell lung carcinomas and preneoplastic bronchial lesions 〔J〕.Carcinogenesis,2004;25(11):2053-9.
16Oh JS,Kucab JE,Bushel PR,etal.Insulin-like growth factor-1 inscribes a gene expression profile for angiogenic factors and cancer progression in breast epithelials cells〔J〕. Neoplasoia,2002;4(3):204-17.

