谷氨酰胺对饲喂高精料奶山羊盲肠黏膜形态及炎症因子mRNA表达的影响
刘玉洁 刘军花 许婷婷 毛胜勇
(南京农业大学动物科技学院,南京 210095)
在现代集约化养殖中,为追求最大经济效益,生产者常给牛羊饲喂高精料。由于过多精料不能在瘤胃及小肠内完全消化,部分精料进入后肠,在后肠大量发酵,结果导致后肠内pH大幅下降,同时产生大量内毒素等异常代谢产物[1]。后肠中过量的内毒素及低pH可引发肠炎,使肠黏膜结构受损。肠炎可导致动物采食量下降,引发腹泻等肠道疾病,最终给畜牧生产带来较大的经济损失。因此,探索有助于在高精料条件下维持动物肠黏膜正常结构和缓解肠炎的措施,对于保障动物肠道健康及生产性能的发挥具有重要理论价值与研究意义。
谷氨酰胺(glutamine,Gln)是血液循环和组织内游离氨基酸池中含量最丰富的一种氨基酸,是肠黏膜主要的能量来源。研究显示,谷氨酰胺可改善肠炎患者全身免疫功能和营养代谢状态[2];可减少三硝基苯磺酸诱导结肠炎的小鼠肠黏膜肿瘤坏死因子α(TNF-α)的产生和释放[3]。在泌乳奶牛上的应用效果表明,添加谷氨酰胺可增强宿主的免疫应答[4-5],显示谷氨酰胺在奶牛生产中具有应用前景,但其是否具有保护反刍动物肠道健康的作用,目前尚不清楚。本试验拟利用饲喂高精料的奶山羊为模型动物,研究添加谷氨酰胺对其盲肠黏膜形态和炎症因子mRNA表达的影响,以期阐明谷氨酰胺在保护后肠健康上的效果,为实际生产提供新策略。
1 材料与方法
试验于2012年1月至2012年4月在南京农业大学动物房进行。
1.1 试验设计
选用12头健康、体重[(41.5±0.8)kg]相近的2.5岁的经产萨能奶山羊母羊,按常规手术方法安装永久性瘤胃瘘管,统一驱虫、单栏饲养。高精料基础饲粮参考NRC(2004)标准配制,其组成及营养水平见表1,精粗比为7∶3。饲喂量(干物质基础)为1.3 kg/d。每日分2次(08:00和17:30)等量饲喂,自由饮水。
采用随机区组设计将12头健康奶山羊随机分为对照组(n=6,饲喂高精料)和谷氨酰胺组(n=6,谷氨酰胺添加量为50 g/d)。试验期28 d。

表1 高精料基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the high concentrate basal diet(air-dry basis) %
1.2 试验材料
谷氨酰胺以过瘤胃谷氨酰胺形式添加,由浙江康德权科技有限公司生产。
主要仪器:pH计(HI 9125,意大利HANNA Instruments)、GC-14B气相色谱仪(日本岛津)、扫描电子显微镜(S-3000N,日本HITACHI)、透射电子显微镜(H-7650,日本日立)、微量分光光度计(NanoDrop 1000,美国 Thermo)、实时定量PCR仪(StepOnePlusTMReal-Time PCR System,美国Applied Biosystems)。
1.3 盲肠内容物和黏膜采集
在试验期结束后屠宰山羊,迅速采集盲肠内容物和黏膜样,内容物pH用pH计迅速测定。内容物与双蒸水1:1稀释后3 600 r/min下离心10 min,取离心后的上清液,经常规处理后,-20℃冻存,备测挥发性脂肪酸、乳酸和内毒素浓度。盲肠黏膜样用冰磷酸缓冲液清洗干净后,分成2等份。第1份用4%多聚甲醛固定,用于石蜡切片;第2份用2.5%戊二醛固定,用于扫描和透射电镜观察。盲肠粘膜样于液氮保存,用于总RNA抽提。
1.4 测定指标
1.4.1 盲肠发酵参数
盲肠内容物内毒素和乳酸浓度的测定分别参照张瑞阳等[6]和龙黎明等[7]的试验方法。盲肠内容物挥发性脂肪酸浓度采用气相色谱法测定,温度条件为:柱温110℃,气化室温度180℃,检测室温度180 ℃[8]。
1.4.2 盲肠黏膜形态
用4%多聚甲醛固定,洗涤、酒精梯度脱水、浸蜡、包埋、切片、贴片、脱蜡复水、苏木精-伊红染色、封固,在光镜下观察盲肠黏膜形态。
用冰磷酸缓冲液反复清洗样品,2.5%的戊二醛固定后,磷酸盐缓冲液清洗,采用乙醇脱水后,冷冻干燥仪干燥样品,用离子溅射仪镀膜,扫描电子显微镜进行观察。透射电镜试验中的样品前处理与扫描电镜预处理一致,缀以1%的锇酸固定,乙醇梯度脱水,用丙酮置换后,浸渍、包埋、聚合、后修块使样品表面积小于0.2 mm×0.2 mm,超薄切片,经铀染色与铅染色清洗后,透射电子显微镜观察盲肠黏膜形态。
1.4.3 炎症因子mRNA表达量
盲肠黏膜的总RNA的提取参照Chomczynski等[9]的方法,采用微量分光光度计测定总RNA浓度和纯度。反转录条件与引物参照文献[10-11],反转录产物于-20℃储存备用。采用实时定量PCR仪评估盲肠黏膜中TNF-α、干扰素γ(IFN-γ)、白细胞介素 1β(IL-1β)、白细胞介素 6(IL-6)和白细胞介素10(IL-10)mRNA的表达量,相对定量采用 2-△△Ct法。
1.5 数据处理与分析
数据采用SPSS 18.0中独立性t检验进行统计分析。显著性水平置于P<0.05。
2 结果
2.1 盲肠发酵参数及内毒素浓度
由表2可见,高精料条件下,盲肠内容物pH约为7.00,总挥发性脂肪酸浓度达101.70 mmol/L,内毒素浓度达5.14 lg(EU/g),添加谷氨酰胺对盲肠内容物pH以及挥发性脂肪酸、乳酸及内毒素浓度皆无显著影响(P>0.05)。

表2 谷氨酰胺对饲喂高精料奶山羊盲肠发酵参数及内毒素浓度的影响Table 2 Effects of glutamine on cecal fermentation parameters and endotoxin concentration of dairy goats fed a high concentrate diet
2.2 盲肠黏膜形态
光学显微镜观察可见,对照组的盲肠黏膜发生脱落(图1-A),而谷氨酰胺组的盲肠黏膜表面完整(图1-B);扫描电镜观察可见,对照组盲肠黏膜出现大面积的损伤(图1-C),谷氨酰胺组盲肠黏膜无病理性的变化(图1-D);透射电镜观察可见,对照组的桥粒清晰可见,但紧密连接密度降低(图1-E),谷氨酰胺组的桥粒和紧密连接结构均完整,连接结构致密(图1-F)。
2.3 盲肠黏膜炎症因子mRNA表达量
由表3可见,添加谷氨酰胺显著降低了奶山羊盲肠黏膜中 TNF-α mRNA的表达量(P<0.05),但对盲肠黏膜 IFN-γ、IL-1β、IL-6 和 IL-10的mRNA表达量无显著影响(P>0.05)。
3 讨论
盲肠是反刍动物除瘤胃外的另一主要发酵器官,除具有消化、吸收及分泌的功能外,作为消化道黏膜屏障的重要组成部分,盲肠黏膜结构对维持机体正常生理功能起着重要作用。研究表明,后肠黏膜屏障可阻止肠腔内的毒素和微生物等穿透黏膜进入循环系统[12]。在肠黏膜屏障中,肠黏膜上皮细胞及其细胞间的各种连接结构是肠道抵御外环境中有害物质或病原体入侵肠黏膜的关键,是维持肠黏膜屏障功能的结构基础[13],因此,维持肠黏膜结构的完整对于维护肠屏障功能至关重要。相关报道显示,当动物采食高精料时,后肠内环境紊乱,肠黏膜损伤,其原因可能涉及后肠低pH及高浓度内毒素等毒物因子[1]。本试验中,对照组盲肠内容物中内毒素的浓度高达1×105EU/g,同时盲肠黏膜表面受损,紧密连接超微结构受到破坏,结果说明,饲喂高精料可导致盲肠黏膜结构受损,提示该条件下肠黏膜屏障可能受损。但由于本试验未能采用尤斯室(Ussing Chamber)等仪器研究后肠黏膜的通透性的具体变化情况,因而黏膜屏障到底受到多大程度的损伤,尚不清楚。但本试验结果显示,高精料可导致奶山羊后肠发酵异常,后肠黏膜结构受到破坏,该结果也与 Gressley等[1]的报道一致。
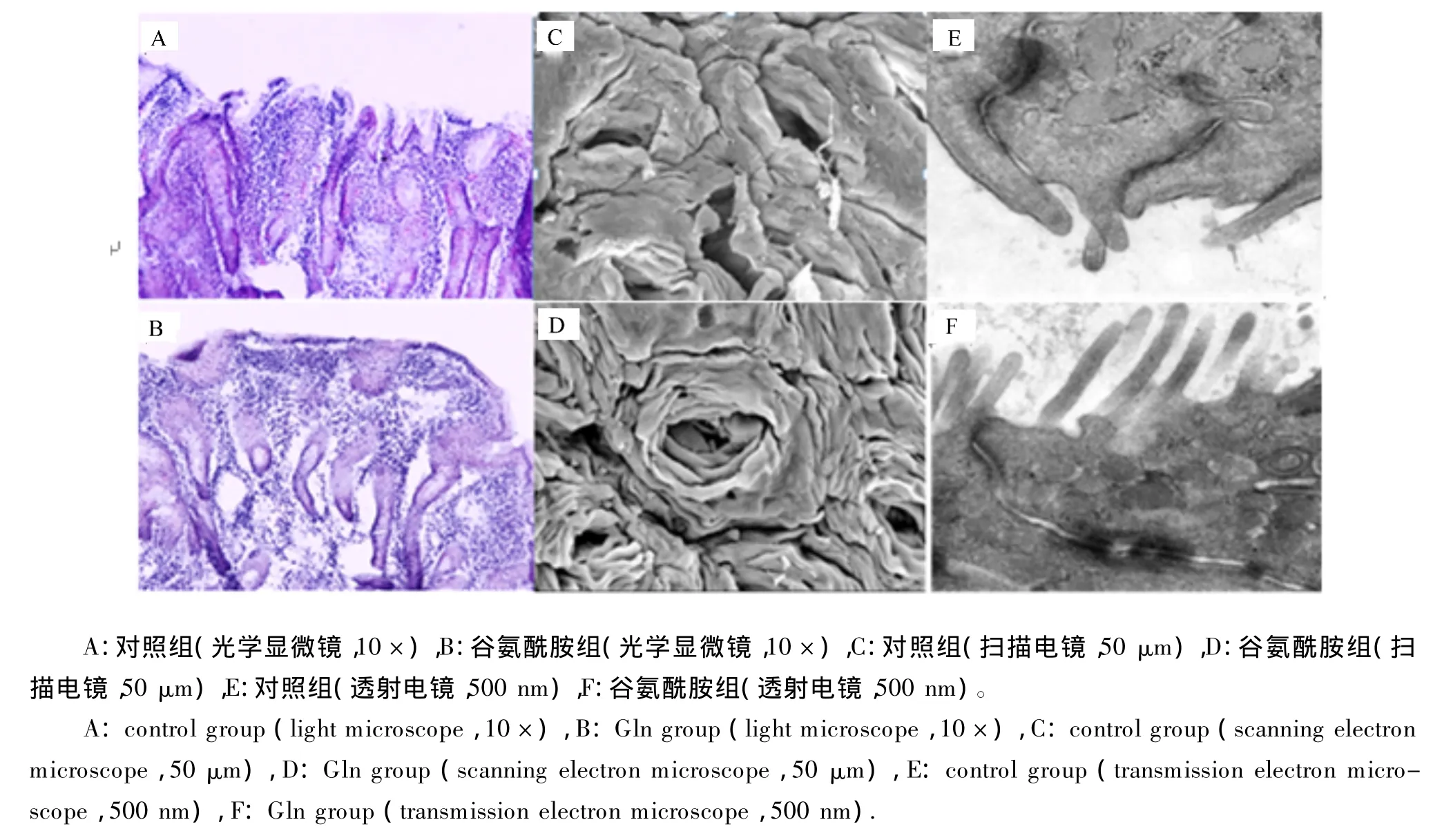
图1 谷氨酰胺对饲喂高精料奶山羊盲肠黏膜形态的影响Fig.1 Effects of glutamine on cecal mucosal morphology of dairy goats fed a high concentrate diet

表3 谷氨酰胺对饲喂高精料奶山羊盲肠黏膜炎症因子mRNA表达量的影响Table 3 Effects of glutamine on the mRNA expression levels of inflammatory cytokines of cecal mucosal of dairy goats fed a high concentrate diet
在人和单胃动物肠道营养上的研究表明,谷氨酰胺是肠黏膜细胞的重要能源物质,可促进黏膜的生长、修复及完整性的维持[14]。本试验结果表明,较对照组而言,添加外源性谷氨酰胺使紧密连接超微结构受到保护,有助于维持肠表面正常的形态,结果表明,谷氨酰胺对盲肠黏膜结构的完整性具有保护作用,该结果也与谷氨酰胺在人和单胃动物肠道营养中的研究报道基本一致,其具体机制可能涉及谷氨酰胺可维持肠黏膜紧密连接结构和促进肠细胞的生长,从而保障了后肠黏膜的完整性的机制。
本试验中,后肠黏膜表面发生脱落,紧密连接超微结构受损,提示后肠黏膜可能局部受损,引发局部炎症。同时,Emmanuel等[15]报道,低 pH 与高浓度内毒素可导致结肠黏膜通透性增加,使内毒素移位。移位的内毒素可进一步刺激机体产生大量TNF-α和IL-1β等细胞因子,加剧黏膜炎症。本试验中,较对照组而言,尽管谷氨酰胺组与对照组盲肠内容物pH与内毒素浓度大致相当,但TNF-α mRNA表达量显著降低,该结果说明,谷氨酰胺组中的较完整肠黏膜结构可能部分阻止了肠腔内毒素等毒物因子的移位,从而削弱了这些毒物引发的肠炎反应。但本试验发现,作者所检测的5个炎症因子中,添加谷氨酰胺仅降低了盲肠内 TNF-α 的 mRNA表达量,对盲肠内 IFN-γ、IL-1β、IL-6和IL-10的mRNA表达量无显著影响。该结果说明,在饲喂高精料饲粮时,添加谷氨酰胺仅能在一定程度上保护肠黏膜结构的完整,部分降低高精料引发的后肠炎症。
4 结论
高精料条件下,添加谷氨酰胺可加强盲肠黏膜紧密连接,一定程度上缓解盲肠黏膜的炎症反应,有助于维持后肠黏膜屏障的正常功能。
[1]GRESSLEY T F,HALL M B,ARMENTANO L E.Ruminant nutrition symposium:productivity,digestion,and health responses to hindgut acidosis in ruminants[J].Journal of Animal Science,2011,89(4):1120-1130.
[2]马晓菁,马兵,谢东珊,等.谷氨酰胺对严重烧伤后肠黏膜和机体免疫功能保护作用的临床观察[J].西安交通大学学报,2009,30(3):359-362.
[3]AMEHO C K,ADJEI A A,HARRISON E K,et al.Prophylactic effect of dietary glutamine supplementation on interleukin 8 and tumour necrosis factor á production in trinitrobenzene sulphonic acid induced colitis[J].Gut,1997,41(4):487-493.
[4]CAROPRESE M,ALBENZIO M,MARINO R,et al.Dietary glutamine enhances immune responses of dairy cows under high ambient temperature[J].Journal of Dairy Science,2013,96(5):3002-3011.
[5]CAROPRESE M,ALBENZIO M,MARINO R,et al.Immune response and milk production of dairy cows fed graded levels of rumen-protected glutamine[J].Research in Veterinary Science,2012,93(1):202-209.
[6]张瑞阳,王东升,朱伟云,等.奶牛静脉血内毒素浓度及其与产奶量的相关性[J].动物营养学报,2012,24(5):822-827.
[7]龙黎明,毛胜勇,苏勇,等.一株瘤胃源乳酸利用菌的分离鉴定及其体外代谢特性[J].微生物学报,2008,48(12):1571-1577.
[8]秦为琳.应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J].南京农业大学学报1982,5(4):110-116.
[9]CHOMCZYNSKI P,SACCHI N.Single-step method of RNA isolation by acid guanidinium thiocyanatephenol-chloroform extraction[J].Analytical Biochemistry,1987,162(1):156-159.
[10]LIU J H,XU T T,LIU Y J,et al.A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2013,305(3):232-241.
[11]DERVISHIA E,SERRANOB C,JOYA M,et al.The effect of feeding system in the expression of genes related with fat metabolism in semitendinous muscle in sheep[J].Meat Science,2011,89(1):91-97.
[12]李晓芳.严重烧伤后胃肠道功能障碍的机制和防治[J].世界华人消化杂志,2006,14(9):888-893.
[13]蔡文娟,章明放.上皮紧密连接与炎性肠病的研究进展[J].医学综述,2011,17(15):2274-2276.
[14]RAO R K,SAMAK G.Role of glutamine in protection of intestinal epithelial tight junctions[J].Journal of Epithelial Biology and Pharmacology,2012,5(1):47-54.
[15]EMMANUEL D G,MADSEN K L,CHURCHILL T A,et al.Acidosis and lipopolysaccharide from Escherichia coli B∶055 cause hyperpermeability of rumen and colon tissues[J].Journal of Dairy Science,2007,90(12):5552-5557.

