冻存前后脐带间充质干细胞生物学特性的比较
李洁,傅勇辉,吴琼,孙万磊,袁铿
(1、南昌大学第二附属医院 江西省分子医学重点实验室,江西 南昌 330006;2、江西省精神病医院,江西 南昌330029;3、江西省医学科学研究院,江西 南昌 330006)
间充质干细胞 (mesenchymal stem cell,MSC)是近年来一种重要的种子细胞,它不仅具有支持造血、调节免疫的功能,而且在一定条件条件下能分化成为骨、软骨、脂肪、肌肉等组织被应用于组织工程及各种疾病的治疗,具有广阔的临床前景。身体的各种组织均具有MSC的存在,现在MSC主要来源于骨髓、脐血和脐带。骨髓源性MSC存在高度病毒污染的可能,且随着年龄增长其细胞数量和扩增、分化能力出现明显下降趋势。胎儿脐血MSC含量非常低,且其分离会损失脐血造血干细胞,影响脐血冻存。故寻找一种新的MSC来源,已成为细胞组织工程研究的热点。我们设计本实验利用被人们所废弃的脐带培养出MSC,并对培养出的MSC进行生物学特性的鉴定,同时将传代后的细胞冻存复苏观察冻存复苏对其生物学特性的影响,为脐带MSC的保存从而被更广泛的应用提供实验依据。
1 材料与方法
1.1 材料 采集正常分娩胎儿脐带组织标本。方法:UC-MSC的分离培养:脐带以75%酒精浸泡10min后剪成5cm左右的小段,以PBS冲洗3遍后剥去血管及外膜,将去除血管及外膜的脐带剪成长条状并以1mg/ml胶原Ⅱ置于37℃、5%CO2、饱和湿度的培养箱中消化18~21h。取出脐带,消化液加PBS稀释降低黏度,2000r/min离心20min,弃上清液,PBS洗涤3次。所得细胞均用台盼蓝染色,细胞计数,调整细胞浓度为1×106/ml,用含体积分数为10%FBS的DMEM-LG培养基接种于一次性T75培养瓶中,置饱和湿度、5%CO2、37℃培养箱中进行培养。7d后半量换液,去除悬浮细胞,以后3~4d换液1次。待细胞80%融合后以吸管吹打贴壁胞,以1∶3传代培养,取P3代细胞用于实验,并将部分P3代的细胞冻存用于后续的实验。
1.2 UC-MSC表面CD分子的鉴定 将传至P3代的UC-MSC以及冻存复苏后的细胞以1:1的0.25%和0.04%EDTA消化后,PBS洗涤3次,分成每EP(1.5ml)管1×105细胞,分别加入小鼠抗人直标PE或 FITC单抗CD13、CD29、CD31、CD34、CD44、CD45、CD166、HLA-DR、HLA-Ⅰ等 10μl,室温避光反应30min,设立阴性同型对照。PBS洗涤3次后,进行流式细胞仪分析。
1.3 体外MSC定向诱导分化 实验分组:A.阴性对照组:正常MSC的培养液;B.实验组:加入下列不同的诱导液。
1.3.1 体外MSC向脂肪诱导分化 取P3代的UCMSC液100μl(1×106/ml)接种于事先放置有经多聚赖氨酸处理的消毒盖玻片的24孔板内制备细胞爬片,每组3孔。诱导分化体系为10%FBS、1mmol/L地塞米松、0.5mmol/L 3-异丁基-1-甲基黄嘌啉、10ug/ml胰岛素、100μmol/L消炎痛,3~4d换液 1次,3周后以0.5%油红O染色,苏木素复染后显微镜下观察。
1.3.2 体外MSC向软骨诱导分化 取P3代的UCMSC液100μl(1×106/ml)接种于事先放置有经多聚赖氨酸处理的消毒盖玻片的24孔板内制备细胞爬片,每组3孔。诱导分化体系为含10%FBS、0.1μmol/L地塞米松、50μmol/L维生素 C、10ng/mlTGF-β1诱导培养液1ml进行诱导培养,3~4d换液1次,3周后以阿新兰染色鉴定。
2 结果
2.1 脐带间充质干细胞培养及鉴定 脐带源性MSC原代21~28d融合80%,P3代5~7d细胞80%融合以成纤维样细胞为主,呈漩涡状排列生长,传至P3代细胞多呈长梭形,排列有明显方向性,细胞排列成网状、辐射状,复苏后形态也无改变(图1)。
2.2 UC-MSC表面CD分子的鉴定 复苏前后MSC均表达黏附分子和基质细胞标记CD29、CD105、CD166、CD90 ,不表达造血细胞标记 CD13、CD34、CD45,差异无统计学意义(P>0.05)(图2、图3)。
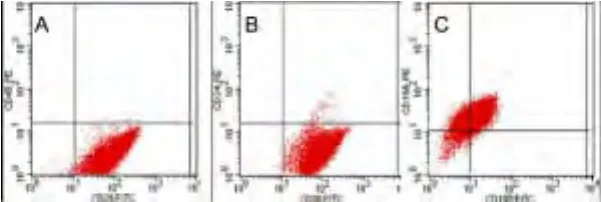
图2 间充质干细胞细胞表面分子表达流式图
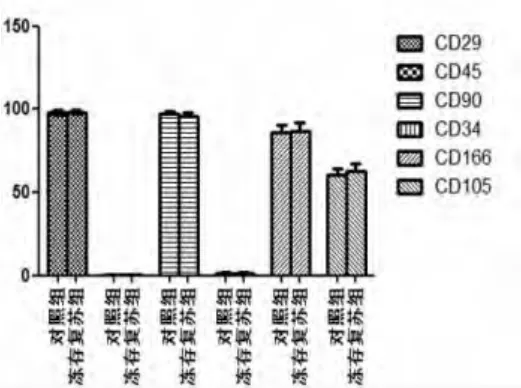
图3 正常组与冻存复苏组细胞表面标志比较图
2.3 体外MSC定向诱导分化
2.3.1 体外MSC向脂肪诱导分化 MSC诱导组可见油红O染色后为红色阳性的脂肪细胞(图4)。
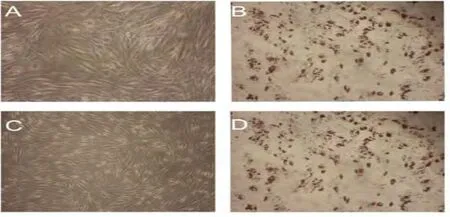
图4 体外MSC向脂肪定向诱导分化
2.3.2体外MSC向软骨诱导分化 MSC诱导组可见阿新兰染色后为蓝色色阳性的脂肪细胞(图5)。
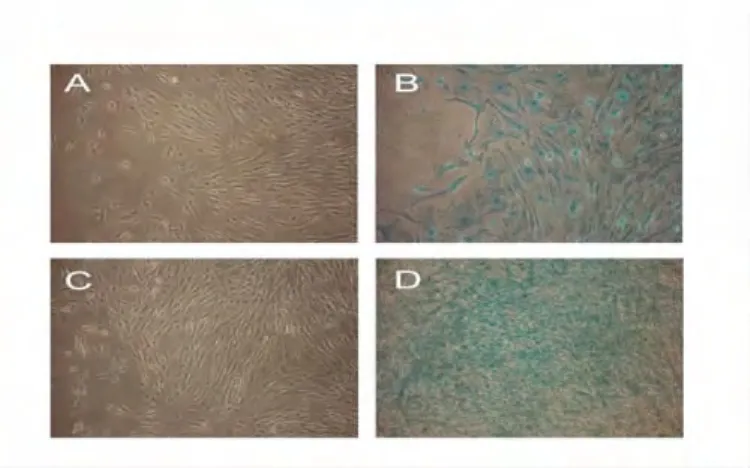
图5 体外MSC向软骨定向诱导分化
3 讨论
近来国内外已有许多研究证实从脐带的不同部位(脐带静脉内皮,内皮下层,Wharton's jelly,血管及其周围组织)均可分离得到MSC[1]。本研究采用胶原酶消化法从脐带中分离培养的细胞,形态上呈长梭形,排列有明显方向性具有典型的MSC形态特征,流式检测结果更表明其细胞表面抗原标志与以往报道的骨髓、脐血MSC相同,并且在体外证实其具有多向分化的功能,经过诱导能够分化成为脂肪、成骨及软骨等多种组织[2-6]。因此,脐带分离到的贴壁细胞也属于MSC,并证实脐带MSC具有与骨髓、脐血MSC相同的生物学特征。另外,本研究不同于以往的胰酶消化收集细胞的方式,采用胶原酶消化脐带,主要作用于细胞间的胶原组织,不容易损伤细胞膜,更有利于细胞的体外培养。同时,我们对冻存前后的脐带间充质干细胞的形态、表型及多向分化能力进行了比较,证实冻存复苏后的细胞与未冻存的细胞具有相同的生物学特征。脐带作为分娩的废弃物,具有来源广泛,采集相对简单,对供者无任何损伤,且MSC含量丰富,免疫原性低,不表达HLA-DR等优点。因此,脐带作为一种新的MSC来源,可以避免获得骨髓源性MSC来源受限、易污染、采集给患者带来痛苦的缺点,又可避免胎儿脐血MSC含量非常低,培养成功率低的缺点,可成为脐血和骨髓MSC的替代来源,广泛地用于科研和临床前试验具有广阔的应用前景。同时,我们的实验证实脐带MSC冻存后能仍保持其完整的生物学特征使其的应用更方便有利。
[1]Margossian T,Reppel L,Makdissy N,et al.Mesenchymal stem cells derived from Wharton's jelly:Comparative phenotype analysis between tissue and in vitro expansion[J].Biomed Mater Eng,2012,22(4):243-254.
[2]Zhang H,Zhang B,Tao Y,et al.Isolation and characterization of mesenchymal stem cells from whole human umbilical cord applying a single enzyme approach[J].Cell Biochem Funct,2012,30(8):643-649.
[3]Zhang L,Ye JS,Decot V,et al.Research on stem cells as candidates to be differentiated into hepatocytes[J].Biomed Mater Eng,2012,22(1):105-111.
[4]Fan CG,Zhang QJ,Zhou JR.Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord[J].Stem Cell Rev,2011,7(1):195-207.
[5]Berg L,Koch T,Heerkens T,et al.Chondrogenic potential of mesenchymal stromal cells derived from equine bone marrow and umbilical cord blood[J].Vet Comp Orthop Traumatol,2009,22(5):363-370.
[6]Cheng H,Qiu L,Ma J,et al.Replicative senescence of human bone marrow and umbilical cord derived mesenchymal stem cells and their differentiation to adipocytes and osteoblasts[J].Mol Biol Rep,2011,38(8):5161-5168.

