偏头痛相关酶和KEGG通路分析
黄 瑞,郑 珩
(中国药科大学生命科学与技术学院,南京210009)
偏头痛(migraine,MIM 157300)是一种普遍的原发性头痛,主要表现为中重度、搏动样发作性头痛,多为偏侧,一般持续4~72小时,可伴恶心、呕吐、畏光、畏声及典型的眼前闪光和视野缺损等非头痛症状,是神经内科最常见的慢性神经血管疾病。偏头痛的发病率高,健康寿命损失年YLD2000(Years Lived with Disability)数据显示偏头痛在人类致残疾病中排名19,全球疾病负担GBD2010(Global Burden of Disease)显示偏头痛在所有致死致残疾病中排名30[1],年患病率男性为 0.7% ~16.1%,女性为 3.3%~32.6%[2],男女患病率比约为 1∶3,研究表明偏头痛的性别偏好跟遗传因素和雌激素等有关。偏头痛有很多亚型,1988年国际头痛协会(IHS)第一次公布偏头痛的分类及诊断标准,后于2004年修订后将偏头痛分为6大类和17小类[3-4],为了研究方便,特别是针对偏头痛的遗传学研究,通常将偏头痛分为三大类:无先兆性偏头痛(migraine without aura,MO),先兆性偏头痛(migraine with aura,MA),家族偏瘫型偏头痛(Familial hemiplegic migraine,FHM)。
偏头痛的病因复杂多样,并受种族、年龄、性别影响,主要包括环境因素、遗传因素和心理因素,其中先兆性偏头痛通常由遗传因素决定。常见的环境因素包括精神因素(如紧张、抑郁)、身体因素(如疲劳、睡眠不足、年龄)、饮食不规律(如过饱、饥饿)、生活习惯(如吸烟、酗酒)、药物(如避孕药)、食物(如干酪、味精、巧克力)等,因此偏头痛患者应避免自身诱发因素。偏头痛基因研究是近年来偏头痛研究的重点,截止2013年,以(gene OR polymorphism OR mutation OR variat*)AND(migraine)为检索式,搜索SCI数据库得到2 409条记录,其中2000~2013年的年平均发表量为138,这些研究结合临床病例报告,探讨偏头痛的发病机制,也为新药研究提供更多有效的靶点。
1 偏头痛相关编码酶基因
通过文献查阅得到偏头痛遗传相关酶基因31个(见表1)。根据每个基因的Pubmed文献记录,将31个偏头痛候选基因分为三大类:①基因多态性研究表明与偏头痛病症相关的风险基因,包括14个:ACE、ATP1A2、C10orf2、DBH、DDC、F2、INSR、MEP1A、MMP3、NSDHL、TPH1、TPH2、TREX1、TYMS;②缺少多态性研究,但与治疗偏头痛的药物代谢有关的基因,包括 3个:CYP3A4、REN、TH;③既有多态性研究又参与药物代谢的基因,包括14个:COMT、CYP1A2、GSTM1、MAOA、MMP2、MMP9、MTHFD1、MTHFR、MTRR、NOS1、NOS2、NOS3、POLG、PTGS2。
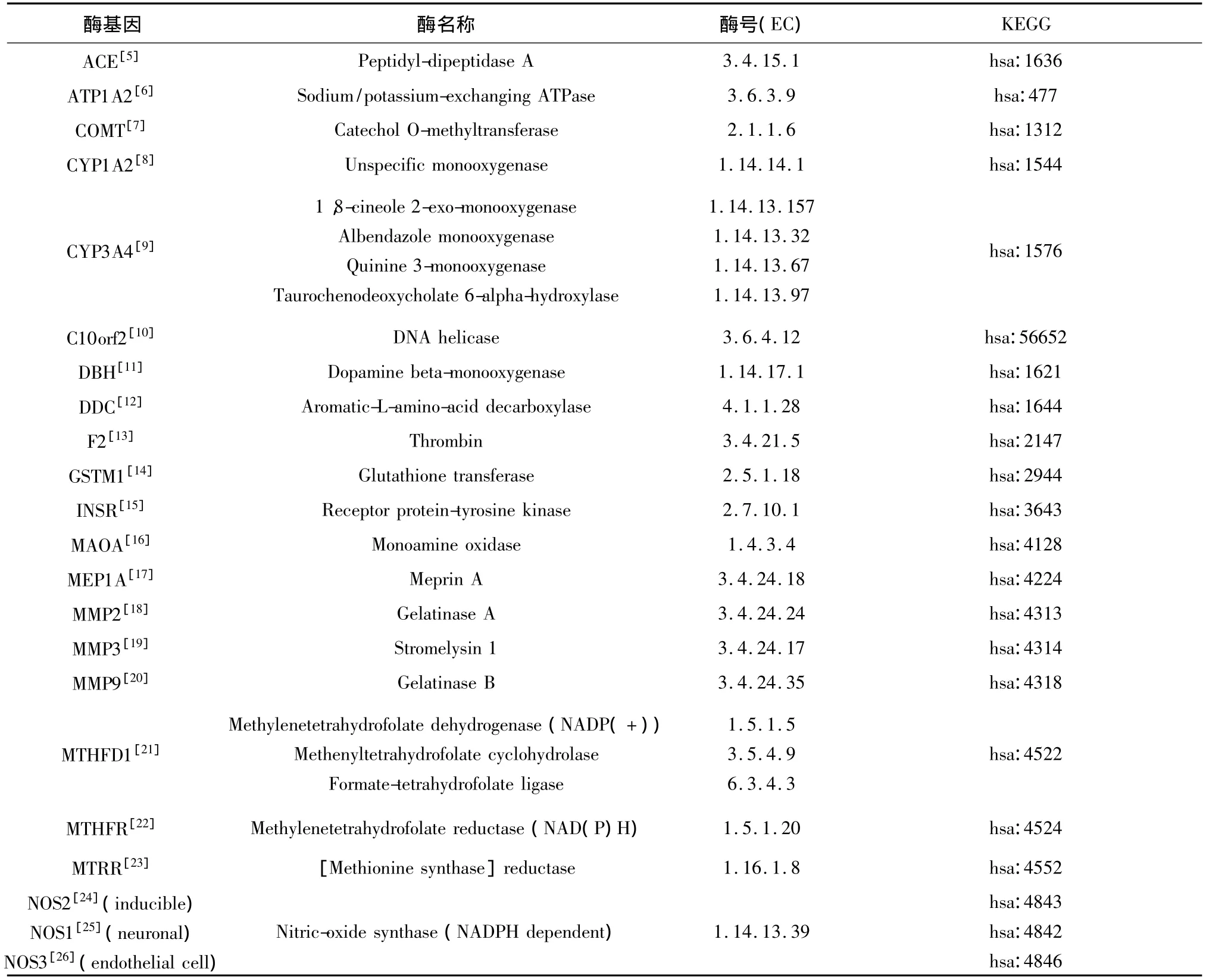
表1 偏头痛遗传相关编码酶基因列举Table 1 Lists of migraine genes encoding enzymes

续(表1)
2 KEGG通路分析
KEGG数据库是一个联系基因组信息和功能信息的知识库,其子数据库PATHWAY汇集了分子交互作用及其反应网络人工通路图。
2.1 DAVID分析工具
DAVID(the Database for Annotation,Visualization and Integrated Discovery)是一个基于网络访问的功能注释系统,网址为 http://david.abcc.ncifcrf.gov/。利用DAVID工具分析KEGG pathway可以直观观测到基因的富集通路、目标基因对应的蛋白及相互关系,若分析某一疾病相关基因 ID,则可根据 PVALUE(P<0.05)值确定重要的PATHWAY来进行重点分析,有助于了解疾病的分子学病理,并为新药的研发提供有效参考靶点。
2.2 DAVID操作过程
本文针对31个偏头痛相关编码酶基因,进行KEGG路径分析,具体过程如下:
STEP1:进 入 网 址 http://david.abcc.ncifcrf.gov/summary.jsp;
STEP2:Uploade框架中粘贴基因 ID,31个,1个/行;

图1 偏头痛相关酶KEGG pathway路径列表Fig.1 KEGG pathway lists of migraine related enzyme genes
STEP3:在“Select Identifier”下拉框中选择“ENTREZ_GENE_ID”;
STEP4:在“list type”选项中点击“Gene List”
STEP5:点击“submit list”;
STEP6:List框架中“USE”相应数据集打开分析结果,在“Pathways”下拉框中点击“KEGG_PATHWAY_Chart”打开路径列表。
3 结果及分析
利用DAVID在线分析工具对31个偏头痛相关酶基因的KEGG路径进行分析,13个基因ID未显示在通路中,结果得到18个酶基因富集在7条路径上(见图1):色氨酸代谢通路(Tryptophan metabolism)、酪氨酸代谢通路(Tyrosine metabolism)、精氨酸和脯氨酸代谢通路(Arginine and proline metabolism)、叶酸一碳单位循环代谢通路(One carbon pool by folate)、药物代谢通路(Drug metabolism)、外源物质细胞色素P450代谢通路(Metabolism of xenobiotics by cytochrome P450)、肾素血管紧张素代谢通路(Renin-angiotensin system)。
表2显示7条通路各自富集的目标基因,基因MAOA在四条通路中皆有显示,根据在通路中出现的位置可推测以单胺氧化酶为靶点的药物可以影响:血清素的生成和消除调节、多巴胺的消除以及去甲肾上腺素的生成和代谢、半胱氨酸水平调节、影响药物代谢(citalopram,即西酞普兰,CAS[59729-33-8],抗抑郁药)等多个方面发挥药理作用,提示影响单胺氧化酶活性和分布的药物可作为研究偏头痛新药的靶点,并提示在偏头痛用药过程中,如曲坦类药物治疗急性偏头痛时要考虑与单胺氧化酶抑制剂(MOAI)的药物相互作用,不过目前有研究表明MAOI对曲坦类药物代谢的药代动力学影响可忽略不计[36]。从表2中得到CYP450酶分布在3条代谢通路中,主要功能为参与外源性物质以及药物的代谢,如CYP450影响曲坦类药物的代谢:eletriptan,frovatriptan,naratriptan,zolmitriptan 等[37]。

表2 7条代谢通路及目标基因Table 2 List of seven KEGG pathways and relative genes
3.1 色氨酸代谢通路
色氨酸代谢通路富集了5个目标基因,观察得知其中最重要的路径为血清素的生成和代谢路径:tryptophan
色氨酸羟化酶(tryptophan hydroxylase,TPH)是血清素合成的限速酶,包括TPH1和TPH2两种异构体,分别由11号染色体和12号染色体编码,基因序列一致性为71%,TPH1主要表达在分泌5-羟色胺的组织中,如皮肤、肠道、松果体以及中枢神经系统;而TPH2则仅在神经细胞中表达,且TPH2在中枢神经系统中的表达量比TPH1大。虽然TPH在血清素的合成中占有很重要的位置,而且血清素水平异常又是偏头痛病理的主要特征,但是TPH与偏头痛的多态性研究不多,且目前没有以TPH为治疗靶点的偏头痛药物,可能的原因是偏头痛的血清素水平异常跟5-羟色胺受体的关联比较大,而跟血清素的合成没有直接关联。有研究显示TPH1(rs1800532)多态性影响西酞普兰(citalopram)药效[38],西酞普兰是治疗重度抑郁症的药物,在偏头痛的治疗中有少量应用。
多巴脱羧酶(dopa decarboxylase,DDC)催化5-羟色氨酸脱羧生成血清素,同时在酪氨酸代谢通路中催化左旋多巴生成多巴胺,可是关于DDC多态性与偏头痛关系的研究欠缺,只有 Corominas R[39]等通过单倍体分析得到(DDCrs2329340A-rs11974297C-rs2044859T-rs11761683G)与MA有关联。
单胺氧化酶A(monoamine oxidase A,MAOA)参与血清素的降解(5种降解路径的一条),即将5-羟色胺降解为5-羟基吲哚乙醛,多态性研究显示MAOA-u VNTR与慢性偏头痛(chronic migraine,CM)以及无先兆性偏头痛(migraine without aura,MO)有关[16],并且参与曲坦类药物代谢,包括:sumatriptan、rizatriptan、almotriptan、zolmitriptan 等[37]。
3.2 酪氨酸代谢通路
图2为酪氨酸代谢通路目标基因即星号集中部分。

图2 酪氨酸代谢通路部分(星号集中区域)Fig.2 Part of Tyrosine metabolism pathway(stars highly concentrated region)
表3为酪氨酸代谢通路中星号标记的酶及对应的目标基因,COMT和MAOA出现频率都高达6,可见这两个酶在多巴胺能神经递质的合成的降解中占有重要位置,而偏头痛患者除了头痛外常伴有多巴胺能系统症状如呕吐、眩晕等,多巴胺受体激动剂和拮抗剂在偏头痛预防和急性发作治疗中都有应用。

表3 酪氨酸代谢通路目标基因和出现频率Table 3 Target genes and corresponding frequency of Tyrosine metabolism pathway
多巴胺合成路径也是左旋多巴唯一的降解途径,起关键作用的酶是DDC,正如在色氨酸通路中提到DDC可以作用于左旋羟基色氨酸生成血清素,以及催化左旋色氨酸生成色胺。DDC由7p12.2基因编码,目前尚缺乏针对DDC多态性和偏头痛关系的研究,相应的药物是甲基多巴,一种治疗高血压的药物,可以用作偏头痛的预防。
多巴胺 β羟化酶(dopamine beta-hydroxylase,DBH)由9q34基因编码,催化多巴胺生成去甲肾上腺素。多态性研究表明 DBH19bp(-4784~-4803)插入和缺失、-1021C>T(rs1611115)多态性和偏头痛有关[40],突变导致DBH水平偏低,造成多巴胺/去甲肾上腺素比例失调,交感神经系统紊乱,从而引发偏头痛。目前针对多巴胺系统开发的偏头痛药物作用靶点主要是:多巴胺受体(DRD1/2)、肾上腺素受体(β-肾上腺素受体)等,相应药物常见有麦角胺生物碱、奥氮平等,分别用于偏头痛的预防和治疗,但尚未开发以DBH为靶点的药物,或者以调节多巴胺/肾上腺素比例为药理的药物。
3.3 精氨酸脯氨酸代谢通路
该通路富集了3种一氧化氮合酶,神经元型一氧化氮合酶(nNOS,或NOS1),分布于神经元细胞内,由12号染色体编码,分别是诱导型一氧化氮合酶(iNOS,或NOS2)、内皮型一氧化氮合酶(eNOS,或NOS3),并分别被12号、17号、7号染色体编码。如图3所示,一氧化氮合酶催化左旋精氨酸代谢为NO,NO作为一种特殊的中枢神经递质调节中枢感觉传播,同时有舒张血管的作用,并参与炎症反应。非选择性NOS抑制剂用于治疗急性偏头痛有舒张血管的副作用,所以开发以nNOS选择性抑制剂可以治疗患有高血压的偏头痛患者[41]。

图3 精氨酸脯氨酸代谢通路(一氧化氮合成和代谢部分通路)Fig.3 Arginine and proline metabolism(part of pathway of NO synthesis and metabolism)
3.4 叶酸一碳单位循环代谢通路
偏头痛相关酶基因KEGG通路分析显示有三个目标基因富集于叶酸一碳单位循环通路,目标基因和相应的酶的位置见图4。目前研究表明偏头痛的发生与患者体内半胱氨酸水平明显升高有关,而半胱氨酸的代谢与叶酸、B12有关,同时研究显示MTHFR C677T纯合子与半胱氨酸高水平有关。半胱氨酸(HCY)水平升高引发偏头痛的病理基础可能是:高HCY水平影响内皮和血管平滑肌功能,导致血管顺应性下降,从而局部释放血管活性止痛物质,如降钙素基因相关肽(CGRP)、P物质(SP)等,这些物质使受累动脉更加扩张,从而引起头痛,形成恶性循环。
MTHFD1基因编码三种酶:5,10-亚甲基四氢叶酸脱氢酶(EC 1.5.1.5;EC 1.5.1.15);5,10-亚甲基四氢叶酸环化水解酶(EC 3.5.4.9);10-甲酰四氢叶酸合成酶(EC 6.3.4.3)。以上3种酶都在叶酸一碳单位循环代谢通路中发挥作用,Pubmed关于MTDFD1多态性与偏头痛关系的研究论文只有一篇,Agustín Oterino等[35]研究结果表示 MTHFD1 R653Q多态性影响MTHFR T677的表达。偏头痛与叶酸代谢、半胱氨酸代谢有关,而通路分析又显示MTHFD1是偏头痛相关酶基因中主要影响叶酸代谢的基因,所以有关于MTHFD1多态性与偏头痛的研究有待增加。
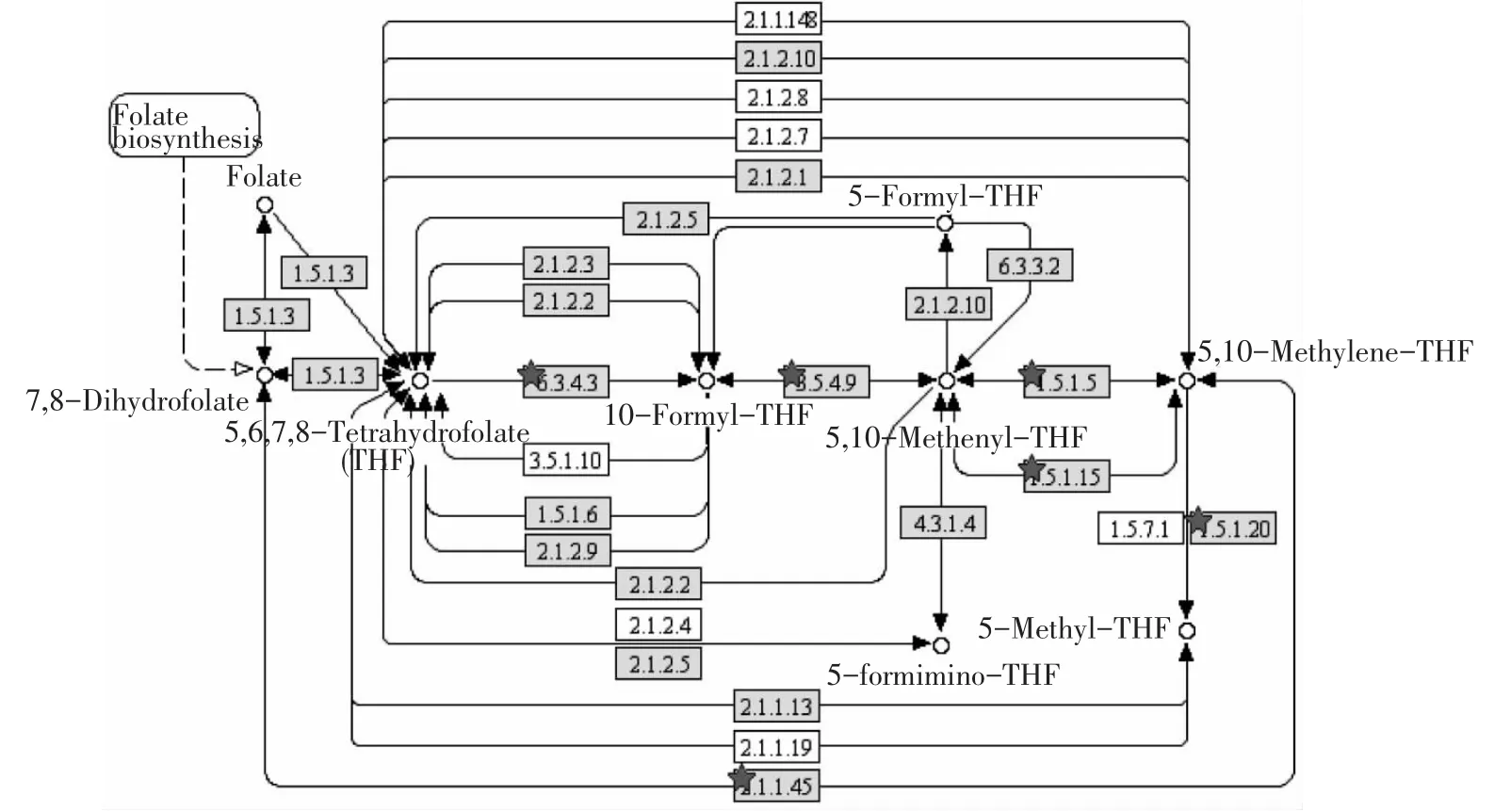
图4 叶酸一碳代谢通路Fig.4 One carbon pool by folate pathway
TYMS 基因编码胸苷酸合成酶(EC 2.1.1.45),以5,10-亚甲基四氢叶酸为辅助因子,催化脱氧尿苷酸甲基化,生成脱氧胸苷酸,参与DNA复制和修复。胸苷酸合成酶作为癌症化疗药物靶点之一,是五氟脲嘧啶、5氟2脱氧尿苷以及叶酸类似物的基本作用位点。有关TYMS多态性与偏头痛的研究极少,Agustín Oterino 等[35]研究表示该基因启动子串联重复序列多态性与MTHFR T677协同作用于提高偏头痛患发病风险。
3.5 药物代谢通路
偏头痛相关酶KEGG通路分析得到9个药物代谢与CYP450、MAOA有关,药物信息及相关应用见表4。Citalopram即西酞普兰,在治疗偏头痛中应用不大,但作为高选择性的SSRIs,其本身及相关衍生物可以为偏头痛的新药研究提供参考。偏头痛患者基因多态性不仅影响患病率和发病程度,还能通过影响药物代谢影响偏头痛的治疗效果。在偏头痛患者个体化治疗中要考虑种族突变和家族突变,并避免药物相互作用。

表4 药物代谢通路显示的药物信息Table 4 Nine drugs in Drug metabolism pathway
3.6 外源物质细胞色素P450代谢通路
谷胱甘肽转移酶1(GSTM1)是人体内生物转化最重要的Ⅱ相代谢酶之一,是细胞抗损伤、抗癌变的主要解毒系统。Kusumi M[14]多态性研究表明GSTM1纯合子缺失多态性与MO有关,但缺乏大样本和基于人群(population-based)的研究。偏头痛的发病机制与环境因素有关,常见有烟、酒、碳酸饮料等,而不同的个体表现出不同的影响程度,原因可能和代谢外源物质的相关基因的多态性有关,可见系统地研究偏头痛患者解毒系统基因突变有助于偏头痛的治疗和预防。
3.7 肾素血管紧张素代谢通路
研究表明肾素血管紧张素系统(renin-angiotensin system,RAS)与偏头痛病理相关[51],该通路包括两个目标基因:ACE、REN(见图5),其中以ACE为靶点的药物有血管紧张素酶抑制剂(angiotensin-converting enzyme inhibitors,ACEIs)和血管紧张素 II受体阻滞剂(angiotensin II receptor blockers,ARBs),普遍用于偏头痛的预防治疗。肾素是一个天门冬酰胺蛋白水解酶,催化血管紧张素原降解生成血管紧张素Ⅰ,是RAS系统一级频率限速酶。肾素由位于人1号染色体的REN基因编码,目前缺乏该基因多态性与偏头痛的关联研究。

图5 肾素血管紧张素代谢通路Fig.5 Renin-angiotensin system pathway
4 结论
本论文从原始文献中搜索得到偏头痛相关编码酶基因31个,并通过KEGG通路分析锁定7条目标通路,分析得到6个多态性研究靶点:DDC、DBH、MTHFD1、TYMS、GSTM、REN。以上6个基因编码的酶在偏头痛相关代谢通路中占有重要的位置,针对这些基因进行大样本基因多态性研究将有助于了解偏头痛的病理基础,并为偏头痛患者的治疗提供参考。该研究通过分析偏头痛相关酶的分布和基本功能,发现了若干以酶为靶点的药物研究范围,如以西酞普兰为药物研究前提,开发更多针对偏头痛治疗的SSRIs。此外,单胺氧化酶和细胞色素P450对偏头痛药物和外源性诱发头痛因素都有代谢调节作用。
31个目标基因中有13个基因没有被富集到通路中,这些基因是:ATP1A2、C10orf2、F2、INSR、MEP1A、MMP3、NSDHL、TREX1、MMP2、MMP9、MTRR、POLG、PTGS2。原因是 DAVID分析工具分析结果很难涵盖所有目标基因。虽然如此,对偏头痛相关酶基因进行通路分析结果依然有参考价值,对其他遗传疾病也可作类似分析。
References)
[1] LIM S S,VOS T,FLAXMAN A D,et al.Disabilityadjusted life years(DALYs)for 291 diseases and injuries in 21 regions,1990-2010:A systematic analysis for the global burden of disease study 2010[J].The Lancet,2012,380:2197-2223.
[2] 吕华燕,周冀英.偏头痛的遗传流行病学研究[J].重庆医学,2009,38(4):484-486.LÜ Huayan,ZHOU Jiying.The genetic epidemiology research of migraine[J].Chongqing Medicine,2009,38(4):484-486.
[3] 于生元.偏头痛的诊治进展-最新偏头痛分类及诊断标准[J].医师进修杂志,2005,28(4):1-3.YU Shengyuan.The latest classification and diagnostic criteria of migraine[J].J Postgrad Med,2005,28(4):1-3.
[4] SHARMA N,MISHRA D.International classification of headache disorders,3rdedition:what the pediatrician needs to know[J].Indian Pediatr,2014,51(2):123-124.
[5] SCHÜRKS M,RIST P M,KURTH T.MTHFR 677C>T and ACE D/I polymorphisms in migraine:a systematic review and meta-analysis[J].Headache,2010,50(4):588-599.
[6] GRITZ S M,RADCLIFFE R A.Genetic effects of ATP1A2 in familial hemiplegic migraine type II and animal models[J].Hum Genomics,2013,7:1-8.
[7] CEVOLI S,MOCHI M,SCAPOLI C,et al.A genetic association study of dopamine metabolism-related genes and chronic headache with drug abuse[J].European Journal of Neurology,2006,13(9):1009-1013.
[8] GENTILE G,BORRO M,LALA N,et al.Genetic polymorphisms related to efficacy and overuse of triptans in chronic migraine[J].J Headache Pain,2010,11(5):431-435.
[9] STERNIERI E,COCCIA C P,PINETTI D,et al.Pharmacokinetics and interactions of headache medications,part II:prophylactic treatments[J].Expert Opin Drug Metab Toxicol,2006,2(6):981-1007.
[10] BIANCHIN M M,LONDERO R G,LIMA J E,et al.Migraine and epilepsy:a focus on overlapping clinical,pathophysiological,molecular, and therapeutic aspects[J].Curr Pain Headache Rep,2010,14(4):276-283.
[11] FERNANDEZ F,LEA R A,COLSON N J,et al.Association between a 19 bp deletion polymorphism at the dopamine betahydroxylase(DBH)locus and migraine with aura[J].J Neurol Sci,2006,251(1-2):118-123.
[12] COROMINAS R,SOBRIDO M J,RIBASÉS M,et al.Association study of the serotoninergic system in migraine in the Spanish population[J].Am J Med Genet B Neuropsychiatr Genet,2010,153B(1):177-184.
[13] FERRARA M,CAPOZZI L,BERTOCCO F,et al.Thrombophilic gene mutations in children with migraine[J].Hematology,2012,17(2):115-117.
[14] KUSUMI M,ISHIZAKI K,KOWA H,et al.Glutathione S-transferase polymorphisms:susceptibility to migraine without aura[J].Eur Neurol,2003,49(4):218-222.
[15] NETZER C,FREUDENBERG J,HEINZE A,et al.Replication study of the insulin receptor gene in migraine with aura[J],Genomics,2008,91(6):503-507.
[16] ISHII M,SHIMIZU S,SAKAIRI Y,et al.MAOA,MTHFR,and TNF-βgenes polymorphisms and personality traits in the pathogenesis of migraine[J].Mol Cell Biochem,2012,363(1-2):357-366.
[17] NORBERG A,FORSGREN L,HOLMBERG D,et al.Exclusion of the juvenile myoclonic epilepsy gene EFHC1 as the cause of migraine on chromosome 6,but association to two rare polymorphisms in MEP1A and RHAG[J].Neurosci Lett,2006,396(2):137-142.
[18]GONÇALVES F M,MARTINS-OLIVEIRA A,LACCHINI R,et al.Matrix metalloproteinase(MMP)-2 gene polymorphisms affect circulating MMP-2 levels in patients with migraine with aura[J].Gene,2013,512(1):35-40.
[19] KARA I,OZKOK E,AYDIN M,et al.Combined effects ofACE and MMP-3 polymorphisms on migraine development[J].Cephalalgia,2007,27(3):235-243.
[20]MARTINS O A,GONÇALVES F M,SPECIALI J G,et al.Specificmatrixmetalloproteinase9 (MMP-9)haplotype affect the circulating MMP-9 levels in women with migraine[J].J Neuroimmunol,2012,252(1-2):89-94.
[21] OTERINO A,VALLE N,PASCUAL J,et al.Thymidylate synthase promoter tandem repeat and MTHFD1 R653Q polymorphisms modulate the risk for migraine conferred by the MTHFR T677 allele[J].Brain Res Mol Brain Res,2005,139(1):163-168.
[22] AN Xingkai,LU Congxia,Ma Qilin,et al.Association of MTHFR C677T polymorphism with susceptibilityto migraine in the Chinese population[J].Neurosci Lett,2013,549:78-81.
[23] MENON S,LEA R A,ROY B,et al.Genotypes of the MTHFR C677T and MTRR A66G genes act independently to reduce migraine disability in response to vitamin supplementation[J].Pharmacogenet Genomics,2012,22(10):741-749.
[24] JIA S,NI J, CHEN S, et al. Association of the pentanucleotide repeat polymorphism in NOS2 promoter region with susceptibilitytomigrainein a Chinese population[J].DNA Cell Biol,2011,30(2):117-122.
[25] BHATT D K,GUPTA S,JANSEN-OLESEN I,et al.NXN-188,a selective nNOS inhibitor and a 5-HT1B/1D receptor agonist,inhibits CGRP release in preclinical migraine models[J].Cephalalgia,2013,33(2):87-100.
[26]GONÇALVES F M,MARTINS-OLIVEIRA A,SPECIALI J G,et al.Endothelial nitric oxide synthase haplotypes associated with aura in patients with migraine[J].DNA Cell Biol,2011,30(6):363-369.
[27]MAHER B H,KERR M,COX H C,et al.Confirmation that Xq27 and Xq28 are susceptibility loci for migraine in independent pedigrees and a case-control cohort[J].Neurogenetics,2012,13(1):97-101.
[28] BIANCHIN M M,LONDERO R G,LIMA J E,et al.Migraine and epilepsy:a focus on overlapping clinical,pathophysiological,molecular, and therapeutic aspects[J].Curr Pain Headache Rep,2010,14(4):276-283.
[29] DASDEMIR S,CETINKAYA Y,GENCER M,et al.Cox-2 gene variants in migraine[J].Gene,2013,518(2):292-295.
[30] SCHÜRKS M,ZEE R Y,BURING J E,et al.Polymorphisms in the renin-angiotensin system and migraine in women[J].Headache,2009,49(2):292-299.
[31] KAGAN R,KAINZ V,BURSTEIN R,et al.Hypothalamic and basal ganglia projections to the posterior thalamus:Possible role in modulation of migraine headache and photophobia[J].Neuroscience,2013,248C:359-368.
[32] ESTEVEZ M,ESTEVEZ A O,COWIE R H,et al.The voltage-gated calcium channel UNC-2 is involved in stress-mediated regulation of tryptophan hydroxylase[J].J Neurochem,2004,88(1):102-113.
[33] JUNG A,HUGEA, KUHLENBÄUMER G, etal.Genetic TPH2 variants and the susceptibility for migraine:association of a TPH2 haplotype with migraine without aura[J].J Neural Transm,2010,117(11):1253-1260.
[34] STAM A H,VAN DEN MAAGDENBERG A M,HAAN J,et al.Genetics of migraine:an update with special attention to genetic comorbidity [J].Curr Opin Neurol,2008,21(3):288-293.
[35] OTERINO A,VALLE N,PASCUAL J,et al.Thymidylate synthase promoter tandem repeat and MTHFD1 R653Q polymorphisms modulate the risk for migraine conferred by the MTHFR T677 allele[J].Brain Res Mol Brain Res,2005,139(1):163-168.
[36] OBERHARDT F,FOX A W.Oral sumatriptan and almotriptan-delimiting the MAOI effect[J].Headache,2012,52(5):765-772.
[37] GENTILE G,BORRO M,LALA N,et al.Genetic polymorphisms related to efficacy and overuse of triptans in chronic migraine[J].J Headache Pain,2010,11(5):431-435.
[38] HAM B J,LEE B C,PAIK J W,et al.Association between the tryptophan hydroxylase-1 gene A218C polymorphism and citalopram antidepressant response in a Korean population[J].Prog Neuropsychopharmacol Biol Psychiatry,2007,31(1):104-107.
[39] COROMINAS R,SOBRIDO M J,RIBASÉS M,et al.Association study of the serotoninergic system in migraine in the Spanish population[J].Am J Med Genet B Neuropsychiatr Genet,2010,153B(1):177-184.
[40] GHOSH J,PRADHAN S,MITTAL B.Identification of a novel ANKK1 and other dopaminergic(DRD2 and DBH)gene variants in migraine susceptibility[J].Neuromolecular Med,2013,15(1):61-73.
[41] BARBANTI P,AURILIA C,EGEO G,et al.Future trends in drugs for migraine prophylaxis[J].Neurol Sci,2012,33(Suppl 1):S137-S140 .
[42] MAGGIONI F,PALMIERIA, TROPEA M, etal.Influence of physiologic hormonal modification and of hormonal treatment in a patient with a history of migraine with aura[J].J Headache Pain,2008,9(2):129-131.
[43] ORR S L,DOS SANTOS M P,JURENCAK R,et al.Central nervous system venulitis presenting as migraine[J].Headache,2014,54(3):541-544.
[44] SPACCAPELO L,LESCHIUTTA S,AUREA C,et al.Topiramate-associated acute glaucoma in a migraine patient receiving concomitant citalopram therapy:a case-report[J].Cases J,2009,2(1):87.
[45] WORTHINGTON I,PRINGSHEIM T,GAWEL M J,et al.Canadian headache society guideline:Acute drug therapy for migraine headache [J].Can J Neurol Sci,2013,40(5 Suppl 3):S1-S80.
[46] TRAFTON J A,RAMANI A.Methadone:A new old drug with promises and pitfalls.[J]Curr Pain Headache Rep,2009,13(1):24-30.
[47]GILMORE B,MICHAEL M.Treatment of acute migraine headache[J].Fam Physician,2011,83(3):271-280.
[48] BIALER M.Chemical properties of antiepileptic drugs(AEDs)[J].Adv Drug Deliv Rev,2012,64(10):887-895.
[49]STRUPP M,DIETERICH M,BRANDT T.The treatment and natural course of peripheral and central vertigo[J].Dtsch Arztebl Int,2013,110(29-30):505-515.
[50] LINDE M,MULLENERS W M,CHRONICLE E P,et al.Valproate(valproic acid or sodium valproate or a combination of the two)for the prophylaxis of episodic migraine in adults[CD].Cochrane Database Syst Rev,2013,6:CD010611.
[51] NANDHA R,SINGH H.Renin angiotensin system:A novel target for migraine prophylaxis[J].Indian J Pharmacol,2012,44(2):157-160.

