大鼠肌肉挫伤组织中SLC1A1mRNA表达与损伤时间的关系
杜秋香,宋丽娟,张凌宇,李三强,王亚芳,孙俊红,王英元*
(1山西医科大学法医学院,太原 030001;2山西省太原市公安局杏花岭分局;*通讯作者,E-mail:wyy580218@163.com)
转运蛋白是定位在细胞质膜和细胞器膜上的、能转运糖、氨基酸、无机盐离子和药物等重要成分进出细胞的跨膜蛋白的总称。细胞中主要的转运蛋白有离子通道(ion channel)、ABC转运蛋白、水通道(aquaporin)、钠/钾离子泵、溶质转运蛋白(solute carrier,SLC)等[1]。溶质转运蛋白(SLC)是细胞内最大的一类转运蛋白,也是细胞膜上仅次于G蛋白偶联受体(G-protein coupled receptor,GPCR)超家族的第二大类细胞膜蛋白。He等[2]认为SLC超家族分为55个家族,包含至少362个成员。SLC1A1是溶质转运蛋白第一家族的第一位成员,也叫做兴奋性氨基酸转运体3(excitatory amino acid transporter 3,EAAT3)或者 EAAC1(excitatory amino acid carrier 1)[3]。在前期的研究中通过对肌肉损伤后4 h和8 h与正常对照组肌肉的mRNA差异表达研究发现,SLC1A1 mRNA在损伤后存在表达差异。因此,本实验通过建立不同损伤时间大鼠骨骼肌损伤动物模型,采用real-time PCR方法以Rpl13 mRNA作为内参基因[4],测定损伤后肌肉组织中 SLC1A1 mRNA相对表达量变化,研究其与损伤时间的关系。
1 材料与方法
1.1 实验动物及分组
78只健康成年SD大鼠(体重250-300 g),随机分为正常对照组和肌肉损伤 4,8,12,16,20,24,28,32,36,40,44,48 h 组,每组6 只。
1.2 肌肉损伤模型制备
3%戊巴比妥钠腹腔注射(0.13 ml/100 g体重)麻醉:①将损伤组大鼠置于自制固定装置,使250 g重力锤从150 cm高度自由落下,造成大鼠右后肢股四头肌处肌肉挫伤后,按分组分别于挫伤后4 h,8 h,12 h,16 h,20 h,24 h,28 h,32 h,36 h,40 h,44 h,48 h将大鼠颈椎脱臼处死,并快速于挫伤处取50 mg肌肉组织置于液氮中保存备用;②对照组大鼠直接颈椎脱臼处死,取与损伤组大鼠相同部位肌肉组织保存备用。
1.3 RNA提取与反转录
总RNA提取严格按Promega公司SV Total RNA Isolation System(SV总RNA纯化系统)试剂盒操作说明书进行,并用Agilent公司2100生物分析仪对总RNA进行完整性检测及浓度测定。反转录反应使用 TAKARA公司 Prime Script RT-PCR Kit,10μl反转录体系内总RNA含量为0.4μg,反应液配制和反应条件按试剂盒要求操作。完成后-20℃保存。
1.4 实时定量PCR扩增反应体系及程序
PCR扩增在Stratagene公司Mx3000P实时荧光定量PCR仪上进行,PCR反应液购买于TAKARA公司的Premix Ex Taq(Probe qPCR)。对照组和不同损伤时间组cDNA样本各取2.0μl加入25.0μl的反应体系。反应条件:95℃预变性10 s,1个循环;第二阶段:95℃,5 s,60 ℃,20 s,终点采集荧光信号,共40个循环。对内参基因Rpl13 mRNA和目的基因SLC1A1 mRNA进行同时扩增,并以Rpl13 mRNA的表达量进行各组间SLC1A1 mRNA表达量的均一化处理,由Stratagene MxPro QPCR软件自动输出相对差异表达量。
SLC1A1和Rpl13的cDNA序列子Genebank下载后采用AlleleID 6.0软件进行引物设计,并经NCBI上BLAST比对后用于real-time PCR检测。引物信息见表1,所有引物均由Invitrogen公司合成。
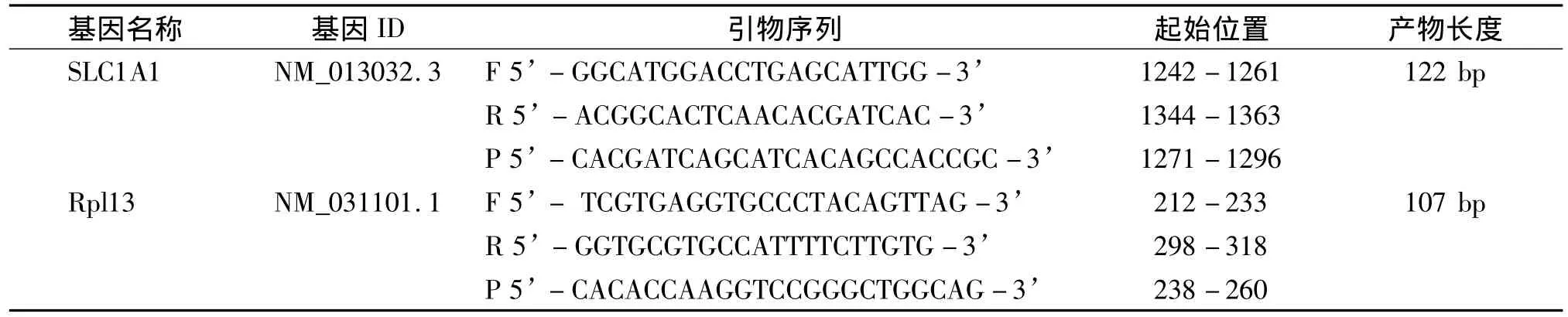
表1 实时荧光定量PCR引物和探针Table 1 Sequences of PCR primer and probe
1.5 标准曲线
为测定SLC1A1 mRNA与内参基因Rpl13 mRNA的扩增效率,cDNA溶液按10倍梯度稀释,再将相当于0.01,0.1,1.0,10,100 ng 总 RNA 量的 cDNA作为模板,进行实时荧光定量PCR扩增,由Stratagene MxPro QPCR软件自动分析并输出标准曲线。
1.6 数据统计与分析
实时定量PCR结果由荧光定量分析仪自动采集给出目的基因和内参基因的Ct值,基因表达量采用实验组/对照组=2-ΔΔCt进行计算,其中 ΔΔCt=ΔCt实验-ΔCt对照。由于每组中目的基因和内参基因加入的量是一致的,所以可以对每个样本ΔCt值(=Ct目的-Ct内参)采用 SPSS10.0 统计软件进行组间比较后再进行2-ΔΔCt计算表达量。
2 结果
2.1 总RNA完整性检测及定量
采用Agilent2100生物分析仪进行的总RNA检测,其横坐标表示保留时间,纵坐标表示荧光强度。本实验提取的总RNA,其完整性指数(RNA integrity number,RIN)=8.6(图1,见第341 页),在28S 峰值后再没有其他杂带峰出现,说明没有基因组DNA的污染,其中总 RNA 浓度为 58 ng/μl,18S∶28S=1.1。
2.2 相对定量的标准曲线
将相当于0.01-100 ng总RNA量的cDNA作为模板,进行实时定量PCR扩增,制作标准曲线(图2)。从图2可知,SLC1A1和Rlp13的标准曲线和两者的扩增效率基本一致。
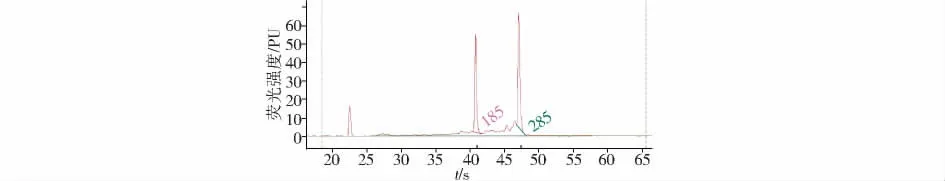
图1 Agilent 2100生物分析仪检测总RNA的完整性及浓度Figure 1 Total RNA integrality and density by Agilent 2100 bioanalyzer

图2 SLC1A1与Rlp13的标准曲线Figure 2 The standard curve of SLC1A1 and Rlp13
2.3 SLC1A1 mRNA在大鼠肌肉组织挫伤后不同时间点相对表达
肌肉组织挫伤后SLC1A1 mRNA表达量变化幅度非常大,损伤后4 h即有所升高,8 h达到峰值,最高为正常对照组的19倍,随着损伤后时间延长,其表达量逐渐回落,但是在24 h以内依然是对照组的11倍以上(见图3)。24h以后,SLC1A1 mRNA表达急剧降低,直至48h降低为接近正常对照组水平。这一结果与筛选差异表达基因的结果相一致。
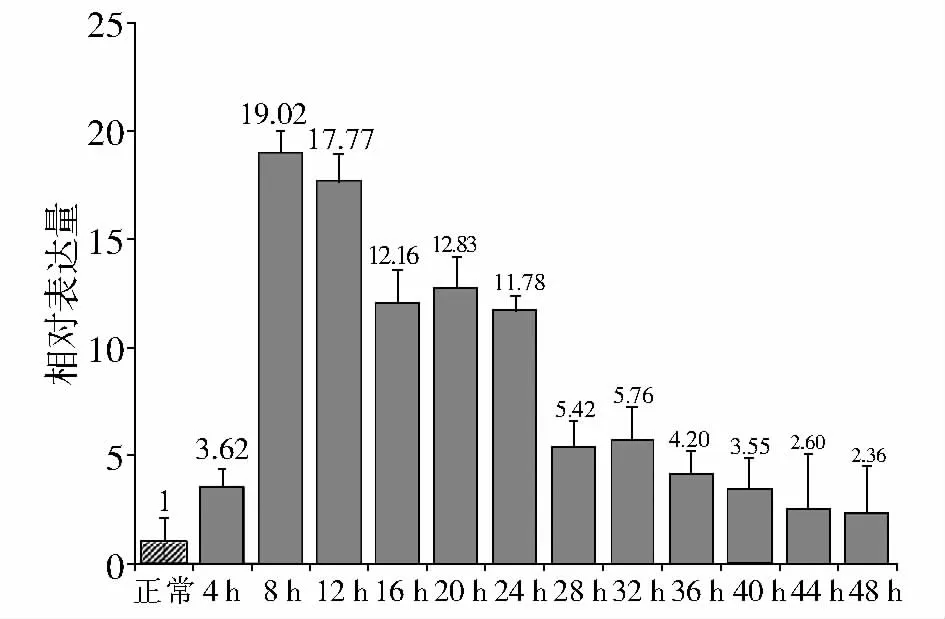
图3 肌肉损伤后不同时间点SLC1A1 mRNA相对表达量Figure 3 The relative expression of SLC1A1 mRNA in contused skeletal muscle of rat at different time
3 讨论
目前国内外对于损伤时间的研究主要集中在脑损伤和皮肤切创伤。通过对胶质纤维酸性蛋白(GFAP)、S100、iNOS等蛋白及 slit2 mRNA的研究[5],发现这些因子在脑损伤后随时间呈现一定的变化规律。通过对皮肤损伤局部组织中p38MAPK、JNK、calpain、caspases、NOS、纤维连接蛋白、IL-1α、IL-1β、IL-6、肿瘤坏死因子(TNF-α)细胞间黏附分子1(ICAM-1)、ICAM-2、、核转录因子(NF-κB)、P 选择素、Beclin1、LC3 等诸多细胞因子[6-8]进行研究,发现这些细胞因子在皮肤切创后有不同程度的表达,而且随着损伤时间的延长,呈现一定的时间相关性,为法医病理学推断损伤时间提供了一些客观的依据。但对于在损伤类型中占绝大多数,且经常伴随其他损伤方式存在的肌肉挫伤仅有少量的报道。本实验通过建立大鼠肌肉挫伤模型,应用实时定量PCR的方法研究SLC1A1 mRNA在肌肉挫伤后的表达规律。
氨基酸是机体内重要的小分子极性物质,不能自由通过细胞膜,需要细胞膜上相应转运蛋白的协助才能完成转运。根据转运载体的底物特异性和动力学特性,目前已经确定的氨基酸转运系统有15种以上。其中酸性氨基酸转运载体的X-AG系统的转运蛋白主要有 5种,分别为 EAAT1、EAAT2、EAAT3、EAAT4、EAAT5[9]。这类转运系统虽然主要在脑部组织中存在,但是SLC1A1(EAAC1,EAAT3)与其他兴奋性氨基酸载体不同,它不是神经特异性,SLC1A1在多种组织中都有发现,比如胃、肝脏、肾、胰腺[10],而且在体内各器官分布也较均一。SLC1A1首先是一种高亲和力的谷氨酸转运载体,在保持细胞外谷氨酸浓度,防止兴奋过度和兴奋性中毒方面起关键作用[11],而且SLC1A1可以通过神经系统广泛表达并作用于非神经组织中,本实验结果证实:在正常大鼠骨骼肌中有一定数量的SLC1A1 mRNA表达,挫伤后4 h SLC1A1 mRNA的表达开始上升,8 h达高峰,直至24 h内一直处于表达的高位,之后逐渐回落至48 h接近正常对照组,这可能是由于骨骼肌损伤后,作为机体重要能量来源的必需氨基酸—谷氨酸及其他氨基酸在损伤局部的大量释放,刺激SLC1A1的表达升高至损伤愈合的最初24 h内。类似的结果在老年痴呆症患者的脑组织[12]与急性脑缺血损伤大鼠神经元[13]等其他神经系统疾病中均有出现,但是肌肉组织中的表达尚未见报道,本次实验不仅对推断肌肉挫伤时间提供了一个可能的指标,同样为肌肉组织中SLC1A1(EAAC1,EAAT3)的表达提供了实验依据。
此外,以上研究结果提示,实时定量PCR具有高度的灵敏性、准确的定量性以及良好的重复性,通过该法检查SLC1A1 mRNA的变化情况,并结合其他形态学的变化,对于损伤时间的推断有一定的帮助作用。
[1]Fredriksson R,Nordstrom KJ,Stephansson O,etal.The solute carrier(SLC)complement of the human genome:phylogenetic classification reveals four major families[J].FEBS Lett,2008,582(27):3811-3816.
[2]He L,Vasiliou K,Nebert DW.Analysis and update of the human solute carrier(SLC)gene superfamily[J].Hum Genomics,2009,3(2):195-206.
[3]Horiuchi Y,Iida S,Koga M,etal.Association of SNPs linked to increased expression of SLC1A1 with schizophrenia[J].Am J Med Genet B Neuropsychiatr Genet,2012,159B(1):30-37.
[4]Sun JH,Nan LH,Gao CR,etal.Validation of reference genes for estimating wound age in contused rat skeletal muscle by quantitative real-time PCR[J].Int J Legal Med,2012,126(1):113-120.
[5]何芳,张玲莉,刘子龙,等.脑挫伤大鼠胶质细胞GFAP、S100的表达及其损伤时间的推断[J].法医学杂志,2007,23(3):181-184.
[6]Zhao R,Guan DW,Zhang W,etal.Increased expressions and activations of apoptosis-related factors in cell signaling during incised skin wound healing in mice:a preliminary study for forensic wound age estimation[J].Leg Med(Tokyo),2009,11(1):S155-160.
[7]Takamiya M,Kumagai R,Nakayashiki N,etal.A study on mRNA expressions of fibronectin in dermal and cerebral wound healing for wound age estimation[J].Leg Med(Tokyo),2006,8(4):214-219.
[8]Sato Y,Ohshima T.The expression of mRNA of proinflammatory cytokines during skin wound healing in mice:a preliminary study for forensic wound age estimation(II)[J].Int J Legal Med,2000,113(3):140-145.
[9]Nakagawa T,Kaneko S.SLC1 glutamate transporters and diseases:psychiatric diseases and pathological pain[J].Curr Mol Pharmacol,2013,6(2):66-73.
[10]Bailey CG,Ryan RM,Thoeng AD,etal.Loss-of-function mutations in the glutamate transporter SLC1A1 cause human dicarboxylic aminoaciduria[J].JClin Invest,2011,121(1):446-453.
[11]Wu H,Jin Y,Buddhala C,etal.Role of glutamate decarboxylase(GAD)isoform,GAD65,in GABA synthesis and transport into synaptic vesicles-evidence from GAD65-knockout mice studies[J].Brain Res,2007,18(1154):80-83.
[12]Duerson K,Woltjer RL,Mookherjee P,etal.Detergent-insoluble EAAC1/EAAT3 aberrantly accumulates in hippocampal neurons of Alzheimer's disease patients[J].Brain Pathol,2009,19(2):267-278.
[13]梁辉,陈虎,蔡定芳.急性脑缺血损伤大鼠海马神经元谷氨酸转运体的表达[J].中国病理生理杂志,2005,21(6):1061-1065.

