局部血管内低剂量促红细胞生成素和联合tPA注射对大鼠脑缺血的影响
王荣亮 赵海苹 武晓宁 高金环 吉训明 罗玉敏
(首都医科大学宣武医院脑血管病研究室,北京市老年病医疗研究中心,北京100053)
重组组织纤溶酶原激活剂(tissue plasminogen activator,tPA)用于急性缺血性卒中的治疗已经持续很多年,但其治疗时间窗较短,有脑出血等严重合并症,使其在临床使用上受到严格的限制[1-2]。因此,延长tPA的治疗时间窗和减少其引发脑出血的不良反应,扩展tPA在临床的应用范围是目前研究的重点。
基础研究及临床研究[3-5]表明,重组人类促红细胞生成素(recombinant human erythropoietin,rhEPO)对缺血性卒中患者有较好的治疗效果。然而,rhEPO很难通过血脑脊液屏障(blood brain barrier,BBB),需要大剂量、多次注射才能达到治疗效果,但这种方式可因其促红细胞生成的活性而产生多种不良反应。本课题组之前的研究[6]表明,在rhEPO中增加一个艾滋病病毒(human immunodeficiency virus,HIV)来源的蛋白转导结构域TAT,在不影响其生物活性的前提下,可以显著地增加rhEPO跨越BBB的能力,为减少rhEPO的治疗剂量提供了新的思路,但通过这种方法构建的融合蛋白(EPO-TAT)在临床应用中的安全性还有待进一步研究。此外,本研究还发现大鼠脑缺血-再灌注后,通过大脑中动脉局部血管内注射低剂量EPO,可以起到良好的神经保护作用[7],对于卒中患者是一种潜在的治疗策略。
研究[8-10]证实,高剂量注射 EPO(2 500~5 000 IU/kg)联合tPA同时注射,在大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)后表现出很严重的不良反应,例如血脑脊液屏障通透性增加、脑出血及死亡。本研究认为这些不良反应与注射EPO的起始时间、剂量和注射方式有关。因此,本文主要研究通过大脑中动脉局部血管内低剂量EPO联合tPA注射,是否可以减少tPA单独使用的不良反应及其可能的机制。
1 材料和方法
1.1 动物分组及实验材料
成年雄性Sprague-Dawley大鼠,体质量280~320 g,购自北京维通利华实验动物公司〔实验动物许可证号:SCXK(京)2008-0001〕。实验所使用的所有动物均经过首都医科大学宣武医院实验动物委员会批准。恒温条件下饲养,实验前一晚禁食但不禁水。所有化学试剂购买于美国Sigma公司。rhEPO购于沈阳阳光药业股份有限公司(沈阳,中国)。实验前采用数字表法随机分为5组,每组10只:(1)假手术组;(2)[tPA+NS]2 h组;(3)[tPA+NS]4 h组;(4)[tPA+EPO]2 h组;(5)[tPA+EPO]4 h组。NS代表0.9%(质量分数)氯化钠注射液,2 h和4 h代表脑缺血时间。
1.2 大鼠脑缺血模型的制作
大鼠脑缺血模型采用血管内线栓模型[11],大鼠称体质量后用4%恩氟烷诱导麻醉,应用小动物呼吸机及麻醉机,1% ~2%(体积分数)恩氟烷混合70%(体积分数)N2O和30%(体积分数)O2维持麻醉,术中监测肛温、血糖、血气及血压,将各项指标维持在正常范围。选择右侧大脑中动脉,所应用的线栓(北京沙东生物技术有限公司)头部直径为0.38 mm,将其插入颈内动脉,至距颈内动脉和颈外动脉分叉处约1.8~1.9 cm,感觉有明显阻力后停止。假手术组分离血管,但不插栓。在大鼠脑缺血2 h或4 h后,抽出线栓,大鼠脑血流再灌注。用激光多普勒(Laser Doppler flowmetry,LDF)监测整个手术过程中大鼠脑血流变化情况,以验证线栓阻断成功。再灌注即刻,通过尾静脉注射的方式在30 min内给予tPA(10 mg/mL)和0.9%(质量分数)氯化钠注射液([tPA+NS]2 h、[tPA+NS]4 h),或通过大脑中动脉注射的方式按照800 IU/kg的剂量在4 min内给予EPO([tPA+EPO]2 h、[tPA+EPO]4 h)。在手术过程中,通过温控垫将大鼠肛温维持在(37.0±0.5)℃。实验进行过程中记录大鼠的死亡数量。
1.3 脑梗死体积
大鼠脑缺血-再灌注24 h后,取脑组织并切片,用蒸馏水配制的1.5%(质量分数)2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色,计算脑梗死体积及水肿体积。对缺血侧脑切片的出血点进行计数,每组累积计算40个脑切片。
1.4 神经功能评分
在大鼠脑缺血-再灌注24 h后行神经功能评价,采用 Ludmila Belayev 12 分评分法[12]:(1)姿势反射试验,即提尾悬空试验:无明显神经功能缺失为0分,梗死对侧肢体屈曲为1分,侧推试验阳性为2分。(2)肢体放置试验:① 视觉亚实验,实验者将动物握于手中,使其前爪悬空,让动物位于桌子前方,自桌面上方10 cm处向桌面缓慢斜线靠近,大鼠正常反应为前肢即抓向桌面,损伤大鼠则表现为肢体反应延迟。0分:动物肢体放置反应正常;1分:反应延迟但不超过2 s;2分:反应延迟且超过2 s。侧方刺激,让动物位于桌子侧方,实验检测方法及评分标准同前方刺激。②触觉亚实验,将动物双眼遮住,并使其前爪悬空,用其前爪背侧轻触桌面,刺激深度仅达皮肤和毛发,动物反应及评分同视觉亚试验,触觉刺激同样分前方和侧方刺激。③ 本体觉亚实验,操作及评分同触觉亚实验,仅刺激深度不同,本体觉亚实验给予前爪较大压力,刺激深达肌肉及关节。该亚实验只有前方刺激。动物前肢放置试验总分范围为0~10分,功能损伤越重,得分越高。
1.5 血常规检测
在大鼠脑缺血4 h再灌注24 h后,从腹主动脉取血液样本。在首都医科大学宣武医院临床实验室进行血常规的检测。包括白细胞、中性粒细胞、淋巴细胞、单核细胞、红细胞和血小板计数,检测血红蛋白浓度。
1.6 免疫印迹法检测
大鼠脑缺血-再灌注24 h后,用过量水合氯醛麻醉处死,取梗死侧皮质脑组织称质量,加入5倍体积的裂解液,裂解液成分包含20 mmol/L Tis-HCl(pH 7.5),150 mmol/L NaCl,1 mmol/L Na2EDTA,1 mmol/L EGTA,1%NP-40,2.5 mmol/L 焦磷酸钠,1 mmol/L β-甘油磷酸酯,1 mmol/L Na3VO4和 1 μg/mL 亮抑蛋白酶肽。将组织超声破碎后,蛋白定量,随后进行常规的免疫印迹检测。电泳、电转后,5%脱脂牛奶室温封闭2 h;按照1∶1 000的比例加入p-AKT(Ser473)、p-ERK(Thr202/Tyr204)(Cell Signaling Technology,美国)一抗,4℃孵育过夜;按照1∶5 000的比例加入HRP标记的二抗(Abgent公司,美国),室温孵育1 h后,利用化学发光仪进行检测。结果用Quantity one 4.4.0软件分析蛋白条带的相对灰度。
1.7 免疫荧光染色
大鼠脑缺血-再灌注24 h后,腹腔注射水合氯醛(300 mg/kg)麻醉,4%(质量分数)多聚甲醛磷酸盐溶液经右心室快速灌注,断头取脑,置于4%多聚甲醛中后固定48 h,石蜡包埋、进行脑冠状切片,每片厚约5 μm。用0.3%(体积分数)H2O2/甲醇溶液消除内源性过氧化物酶活性,EDTA抗原微波热修复,用3%(质量分数)小牛血清磷酸盐溶液封闭2 h;按照1∶50的比例加p-AKT(Ser473)、p-ERK(Thr202/Tyr204)抗体,4℃孵育过夜;加入TRITC标记的山羊抗兔IgG荧光二抗,室温孵育30 min;DAPI封片,荧光显微镜下观察并记录。
1.8 统计学方法
采用SPSS 17.0软件进行统计分析,所有资料采用均数±标准差(±s)表示,两组之间的比较采用Student’s t-test;多组之间的分析比较采用 one-way ANOVA 及post-hoc Scheffe’s test方法,以P <0.05为差异有统计学意义。
2 结果
2.1 EPO联合tPA使用可以减小大鼠脑梗死体积,改善神经功能评分
大鼠脑缺血再灌注24 h后,TTC染色计算脑梗死体积百分比(图 1A)。结果显示,与[tPA+NS]4 h组相比,[tPA+EPO]4 h组梗死百分比显著减少(P<0.05,图1B);[tPA+EPO]2 h组与[tPA+NS]2 h组相比,差异无统计学意义。另外,[tPA+EPO]4 h组大鼠神经功能损伤明显低于[tPA+NS]4 h组(P<0.05,图1C)。[tPA+EPO]2 h组与[tPA+NS]2 h组之间差异无统计学意义(图1C)。

图1 脑梗死体积及神经功能的结果Fig.1 Results of cerebral infarction volume and neurological function
A:representative results of TTC staining;B:cerebral infarction volumes were analyzed and calculated;C:representative results of neurological function.*P<0.05 vs tPA+NS group,n=6;tPA:tissue plasminogen activator;EPO:erythropoietin;NS:normal saline;TTC:2,3,5-triphenyltetrazolium chloride.
2.2 EPO联合tPA使用可以减少病死率、脑水肿和脑出血
在本研究中,[tPA+EPO]2 h组和[tPA+EPO]4 h组的病死率分别是10%和20%,明显低于[tPA+NS]2 h组(30%,P<0.05)和[tPA+NS]4 h组(60%,P <0.05)。通过TTC染色计算脑水肿显示(图1A):[tPA+EPO]2 h组和[tPA+EPO]4 h组的脑水肿百分比分别低于[tPA+NS]2 h组和[tPA+NS]4 h组(P<0.05,图2B)。同样,通过对每组40个脑切片出血点的观察和计数表明,[tPA+EPO]2 h组和[tPA+EPO]4 h组的出血点数量分别低于[tPA+NS]2 h组和[tPA+NS]4 h组(P<0.05,图2C)。这些结果显示,通过大脑中动脉低剂量注射EPO联合tPA使用后,降低了 大鼠的病死率、血脑脊液屏障通透性和脑出血。
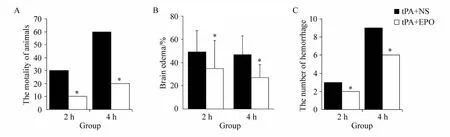
图2 病死率、脑水肿和脑出血的结果Fig.2 Results of mortality,brain edema and hemorrhage
2.3 EPO联合tPA注射不影响红细胞及血红蛋白变化

图3 血常规检测结果Fig.3 Results of routine blood tests
本研究通过降低EPO的使用剂量避免对红细胞及血红蛋白的影响等不良反应的发生。应用脑缺血4 h,再灌注24 h后的大鼠进行血常规检测来验证。[tPA+EPO]4 h组和[tPA+NS]4 h组大鼠的白细胞、中性粒细胞、淋巴细胞、单核细胞(图3A)、红细胞(图3B)的总数、血红蛋白浓度(图3C)和血小板数量(图3D)差异无统计学意义,证实了用低剂量EPO联合tPA治疗,不会产生明显的不良反应。
2.4 EPO联合tPA使用可以增加大鼠脑皮质中p-AKT的表达

图4 p-AKT的蛋白免疫印迹及免疫荧光结果Fig.4 Results of western blotting and immunofluorescence for p-Akt
本研究通过Western blotting和免疫荧光的方法检测了大鼠脑皮质p-AKT的浓度。如图4A所示,相对于Sham 组,[tPA+EPO]2 h组和[tPA+NS]2 h组大鼠脑皮质中的p-AKT浓度显著增加,但两组之间差异无统计学意义。然而,[tPA+EPO]4 h组p-AKT浓度明显高于[tPA+NS]4 h组(P<0.05),提示大鼠脑缺血4 h后,通过EPO处理激活了AKT通路。免疫荧光显示,与sham组和[tPA+NS]4 h组(图4B)相比,[tPA+EPO]4 h组大鼠脑皮质中p-AKT阳性的神经元明显增加,这一结果与Western blotting的结果相符合。
2.5 EPO联合tPA使用可以增加大鼠脑皮质中p-ERK的表达
Western blotting结果表明,与 sham组相比较,[tPA+NS]2 h组、[tPA+EPO]2 h组和[tPA+NS]4 h组的p-ERK浓度无明显变化;与sham组和[tPA+NS]4 h组相比较,[tPA+EPO]4 h组大鼠脑皮质中p-ERK的浓度显著增加(P<0.05,图5A)。与Western blotting结果一致,相对于[tPA+NS]4 h组,[tPA+EPO]4 h组大鼠脑皮质中p-ERK阳性的神经元明显增加(图5B)。

图5 p-ERK的蛋白免疫印迹及免疫荧光结果Fig.5 Results of western blotting and immunofluorescence for p-ERK
3 讨论
在缺血性卒中治疗中,虽然很多基础研究[3-5]和临床研究[8,13]已经证明EPO具有治疗脑缺血的潜力,但是当大剂量EPO联合tPA使用时会引发有害的不良反应,如红细胞增多、增加血栓形成,这些可以使脑缺血损伤更加恶化[8-10,14]。2008年,德国哥廷根大学开展了多中心EPO卒中临床Ⅲ期试验[8],用EPO(单次静脉注射40 000 IU)治疗急性脑缺血患者后,很多患者出现脑出血和死亡,其中63%的患者接受过tPA溶栓治疗。研究[8]表明,EPO不适用于治疗tPA溶栓后的脑卒中患者。但是,该临床试验中存在几个问题:① 约50%患者进行tPA溶栓时超过了规定的时间窗;②EPO注射的剂量过大(单次静脉注射40 000 IU)。这些很有可能是EPO联合tPA使用后导致患者的脑出血和高病死率的关键问题,也是很多基础研究与临床试验结果不相符的原因。Jia等[9]通过建立大鼠MCAO模型,发现在大鼠脑缺血6 h后,当rhEPO(5 000 IU/kg)联合tPA(10 mg/kg)使用时没有减少脑梗死体积,而且rhEPO会加剧tPA诱发的脑出血。值得注意的是,与对照组相比,在脑缺血后2 h给予rhEPO联合tPA治疗可以显著减少脑梗死体积,并且没有显著的增加脑出血转化。这与本试验中的脑缺血4 h结果相符。在线栓制作的大鼠脑缺血模型中,tPA的治疗时间窗不超过脑缺血后的4 h,延迟给予tPA治疗会增加脑出血性转化[15-16]。因此,Jia等[9]研究中的大鼠脑缺血6 h后给药产生的不良反应,可能与tPA超过治疗时间窗有关,与该研究结果不同的是,本研究显示,在大鼠脑缺血后2 h给予治疗并未减少脑梗死体积,有待进一步的研究。但证实了脑缺血4 h后,同时使用EPO及tPA是可行的,没有增加出血性转化或其他不良反应。以上这些研究结果提示,明确EPO和tPA之间的作用关系、确定给药时间、方式和剂量在治疗缺血性卒中过程中非常必要。
在本研究中,为了避免高剂量注射EPO产生的促红细胞生成的不良反应,同时又能有效的达到治疗作用。本研究采用了低剂量EPO(800 IU/kg)联合tPA通过大脑中动脉注射的给药方式。结果显示,相对于单独使用tPA(tPA+NS组),在大鼠脑缺血4h后,通过大脑中动脉联合注射tPA及EPO,可以显著减少脑缺血后梗死体积、神经功能缺失、病死率、脑水肿和脑出血点,提示EPO发挥神经保护作用的同时并未加剧tPA诱发的脑出血。此外,tPA+NS组和tPA+EPO组大鼠的白细胞、中性粒细胞、淋巴细胞、单核细胞、红细胞的总数、血红蛋白浓度和血小板数量无明显变化,提示该剂量的EPO(800 IU/kg)联合tPA是治疗脑缺血-再灌注损伤中一个安全、有效的策略。
研究[17-18]表明,ERK通路是脑缺血后重要的生存通路。在肾损伤[19]和心肌症[20]中,EPO 主要通过激活AKT通路起到保护性作用,当AKT通路被抑制后,ERK通路被激活,参与保护作用[21]。另一方面,也有些研究[22-24]认为,EPO治疗脑缺血性损伤时,两条通路同时被激活。关于EPO起效的信号通路的矛盾可能是因为组织和器官的差异性[25-27]。本研究证实,相对于[tPA+NS]4 h组,[tPA+EPO]4 h组大鼠 p-ERK和p-AKT的水平显著增加,表明两条通路均参与了EPO的治疗过程。
综上所述,在大鼠脑缺血-再灌注后,通过大脑中动脉低剂量注射EPO后可以起到神经保护的效果,并未引发tPA的不良反应,这可能为今后脑缺血性中风治疗提供了新策略。本研究目前认为,大脑中动脉低剂量注射EPO可能是通过激活AKT和ERK通路发挥神经保护作用,其具体的机制还需要进一步明确。
[1] Marler J R,Goldstein L B.Medicine.Stroke——tPA and the clinic[J].Science,2003,301(5640):1677.
[2] Wardlaw J M,Sandercock P A,Berge E.Thrombolytic therapy with recombinant tissue plasminogen activator for acute ischemic stroke:where do we go from here?A cumulative meta-analysis[J].Stroke,2003,34(6):1437-1442.
[3] Gao Y,Mengana Y,Cruz Y R,et al.Different expression patterns of Ngb and EPOR in the cerebral cortex and hippocampus revealed distinctive therapeutic effects of intranasal delivery of Neuro-EPO for ischemic insults to the gerbil brain[J].J Histochem Cytochem,2011,59(2):214-227.
[4] Gunnarson E,Song Y,Kowalewski J M,et al.Erythropoietin modulation of astrocyte water permeability as a component of neuroprotection[J].Proc Natl Acad Sci U S A,2009,106(5):1602-1607.
[5] Iwai M,Cao G,Yin W,et al.Erythropoietin promotes neuronal replacement through revascularization and neurogenesis after neonatal hypoxia/ischemia in rats[J].Stroke,2007,38(10):2795-2803.
[6] Zhang F,Xing J,Liou A K,et al.Enhanced delivery of erythropoietin across the blood-brain barrier for neuroprotec-tion against ischemic neuronal injury[J].Transl Stroke Res,2010,1(2):113-121.
[7] Dang S,Liu X,Fu P,et al.Neuroprotection by local intraarterial infusion of erythropoietin after focal cerebral ischemia in rats[J].Neurol Res,2011,33(5):520-528.
[8] Ehrenreich H,Weissenborn K,Prange H,et al.Recombinant human erythropoietin in the treatment of acute ischemic stroke[J].Stroke,2009,40(12):e647-656.
[9] Jia L,Chopp M,Zhang L,et al.Erythropoietin in combination of tissue plasminogen activator exacerbates brain hemorrhage when treatment is initiated 6 hours after stroke[J].Stroke,2010,41(9):2071-2076.
[10]Zechariah A,ElAli A,Hermann D M.Combination of tissue-plasminogen activator with erythropoietin induces blood-brain barrier permeability,extracellular matrix disaggregation,and DNA fragmentation after focal cerebral ischemia in mice[J].Stroke,2010,41(5):1008-1012.
[11] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[12] Belayev L,Alonso O F,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model[J].Stroke,1996,27(9):1616-1622.
[13]Ehrenreich H,Hasselblatt M,Dembowski C,et al.Erythropoietin therapy for acute stroke is both safe and beneficial[J].Mol Med,2002,8(8):495-505.
[14] Stohlawetz P J,Dzirlo L,Hergovich N,et al.Effects of erythropoietin on platelet reactivity and thrombopoiesis in humans[J].Blood,2000,95(9):2983-2989.
[15]Murata Y,Rosell A,Scannevin R H,et al.Extension of the thrombolytic time window with minocycline in experimental stroke[J].Stroke,2008,39:3372-3377.
[16]Zhang L,Zhang Z G,Zhang R L,et al.Postischemic(6-hour)treatment with recombinant human tissue plasminogen activator and proteasome inhibitor ps-519 reduces infarction in a rat model of embolic focal cerebral ischemia[J].Stroke,2001,32(12):2926-2931.
[17] Kilic U,Kilic E,Soliz J,et al.Erythropoietin protects from axotomy-induced degeneration of retinal ganglion cells by activating ERK-1/-2[J].FASEB J,2005,19(2):249-251.
[18]Park M H,Lee S M,Lee J W,et al.ERK-mediated production of neurotrophic factors by astrocytes promotes neuronal stem cell differentiation by erythropoietin[J].Biochem Biophys Res Commun,2006,339(4):1021-1028.
[19] Eliopoulos N,Zhao J,Forner K,et al.Erythropoietin gene-enhanced marrow mesenchymal stromal cells decrease cisplatin-induced kidney injury and improve survival of allogeneic mice[J].Mol Ther,2011,19(11):2072-2083.
[20]Kim K H,Oudit G Y,Backx P H.Erythropoietin protects against doxorubicin-induced cardiomyopathy via a phosphatidylinositol 3-kinase-dependent pathway[J].J Pharmacol Exp Ther,2008,324(1):160-169.
[21] Miki T,Miura T,Tanno M,et al.Impairment of cardioprotective PI3K-Akt signaling by post-infarct ventricular remodeling is compensated by an ERK-mediated pathway[J].Basic Res Cardiol,2007,102(2):163-170.
[22] Kilic E,Kilic U,Soliz J,et al.Brain-derived erythropoietin protects from focal cerebral ischemia by dual activation of ERK-1/-2 and Akt pathways[J].FASEB J,2005,19(14):2026-2028.
[23]Sargin D,Friedrichs H,El-Kordi A,et al.Erythropoietin as neuroprotective and neuroregenerative treatment strategy:comprehensive overview of 12 years of preclinical and clinical research[J].Best Pract Res Clin Anaesthesiol,2010,24(4):573-594.
[24] Noguchi C T,Asavaritikrai P,Teng R,et al.Role of erythropoietin in the brain[J].Crit Rev Oncol Hematol,2007,64(2):159-171.
[25]王荣亮,刘小蒙,张营,等.大鼠局灶性脑缺血后神经功能评分与脑梗死体积相关性分析[J].首都医科大学学报,2013,34(1):69-74.
[26]刘小蒙,王荣亮,罗玉敏.大鼠脑缺血神经功能缺损行为学评价的研究进展[J].中国脑血管病杂志,2012,9(4):208-212.
[27]刘小蒙,罗玉敏,陈俊.缺血性脑血管病神经保护药转化医学的现状[J].中国脑血管病杂志,2012,9(10):550-555.

