盖他病毒E2蛋白的表达纯化以及抗原性鉴定
陆莹梅,魏建超,夏 鹏,吴亚玲,黎倩倩,武专昌,齐鹏飞,石 坤,李玉明,邱亚峰,李蓓蓓,刘珂,邵东华,周望平,马志永
(1.湖南农业大学动物医学院,长沙 410128;2.中国农业科学院上海兽医研究所,上海200241;3.湖南省畜牧兽医研究所,长沙 410000)
·研究论文·
盖他病毒E2蛋白的表达纯化以及抗原性鉴定
陆莹梅1,2,3,魏建超2,夏 鹏2,吴亚玲2,黎倩倩2,武专昌2,齐鹏飞2,石 坤2,李玉明2,邱亚峰2,李蓓蓓2,刘珂2,邵东华2,周望平1,3,马志永2
(1.湖南农业大学动物医学院,长沙 410128;2.中国农业科学院上海兽医研究所,上海200241;3.湖南省畜牧兽医研究所,长沙 410000)
参考GenBank(EU015066)盖他病毒(Getah virus,GETV)SH05-6中结构蛋白E2的全基因序列并对其进行密码子优化。将优化后的基因片段克隆至原核表达载体 pColdⅠ中,构建重组表达载体pCold-E2。重组质粒转化E.coli BL21 ( DE3)感受态细胞,经IPTG低温诱导后,SDS- PAGE和Western blot进行分析。结果显示,在相对分子质量46 kDa处出现目的条带,与预期相符,且占大肠杆菌表达蛋白总量的80%。结果证明E2基因在大肠杆菌中获得了高效表达,并且能与抗血清发生特异性反应。本研究为GETV快速检测方法的建立和GETV流行病学调查奠定了基础。
盖他病毒;原核表达;E2基因
盖他病毒(Getah virus,GETV)是一种虫媒病毒,属于披膜病毒科(Togaviridae)、甲病毒属(Alphavirus)成员,目前为止已分离到的病毒株型约为30余种[1]。MM2021是分离到的第1株盖他病毒,于1955年在马来西亚吉隆的雪被库蚊体内分离得到[2]。GETV广泛分布于世界各地,主要是在沿太平洋的亚洲国家和澳大利亚北部地区流行[3,4]。血清学调查显示GETV抗体普遍存于脊椎动物的血液中,但GETV并不在自然宿主中引起急性传染病,只有通过蚊虫叮咬才能传播疾病[5-7]。GETV的致病机理十分复杂,它在猪群中能引起母猪繁殖性障碍和初生仔猪的死亡,并且从健康猪、死胎和病死仔猪的体内都能分离到该病毒[8]。GETV在乳鼠体内能引起急性脑炎综合征(acute encephalitis syndrome,AES),出现生长迟缓、气喘、腹式呼吸和关节炎等症状。近年来,我国广东省、云南省、河北省、甘肃省和海南省等均有GETV引发疾病的报道[9-11],说明GETV在我国已逐步流行,所以对猪场实施定期检疫和GETV的快速诊断就显得十分重要[12]。
GETV属于塞姆利基森林病毒(Semliki forest virus,SFV)复合型囊膜病毒[3],其遗传物质为单链线形正股RNA,3′末端拥有polyA尾,这是其具有感染性的原因之一,5′端为O型的帽子结构[9,13,14]。GETV由4种非结构蛋白(nsP1~nsP4)和结构蛋白(E1、E2、E3、6K、Cap蛋白)构成。其中由E基因编码的结构蛋白是GETV最关键的蛋白,它不仅构成了病毒粒子的表面突起,而且在吸附靶细胞和致病及诱发机体的抗感染免疫中发挥着重要的作用[15]。本研究根据GenBank(EU015066)盖他病毒株(SH05-6)合成E2全基因序列,经过酶切验证和测序鉴定,成功构建了重组表达载体pColdⅠ-E2,并在大肠杆菌E.coli BL21(DE3)中获得了高效表达。将E2蛋白进行纯化和透析后,制备抗E2蛋白多克隆抗体,Western blot鉴定结果表明该抗体能够与E2蛋白发生特异性免疫反应。
1 材料与方法
1.1 菌株、质粒E.coli BL21(DE3)菌株及表达载体pColdⅠ由本实验室保存;pUC57-E2由金唯智有限公司合成并提供。
1.2 试剂质粒提取试剂盒和胶回收试剂盒购自美国Axygen公司;蛋白预染Marker和ECL发光试剂盒购自美国Thermo scientific公司;镍离子亲和柱购自美国BIO-RAD生命医学产品有限公司;限制性内切酶EcoRⅠ和XbaⅠ购自大连宝生物有限公司;鼠源His单抗购自艾比玛特生物医药(上海)有限公司;HRP标记羊抗兔IgG和佐剂购自美国Sigma-Aldrich公司。
1.3 E2基因的合成参考GenBank(EU015066)GETV(SH05-6)的结构蛋白E2的全基因序列,长度为1278 bp。将序列进行密码子优化,分别在上、下游插入两个酶切位点EcoRⅠ和XbaⅠ(小写字母为酶切位点)。序列由金唯智有限公司合成。将序列克隆至载体pUC57上,构建了重组载体pUC57-E2。


1.4 重组质粒pColdⅠ-E2的构建将pUC57-E2和pColdⅠ载体转化至E.coli DH5a感受态细胞中,37℃振荡过夜,提取质粒,使用EcoRⅠ和XbaⅠ限制性内切酶分别对载体进行酶切,得到酶切产物E2和pColdⅠ。将E2和pColdⅠ用T4 DNA连接酶于16℃连接过夜,转化感受态细胞,并涂布于Amp+的LB培养皿中,37℃恒温培养过夜。d2随机挑选单克隆菌落,37℃振荡培养至菌体浑浊,经酶切验证的阳性菌液送至上海桑尼生物科技有限公司进行测序,测序结果与合成片段序列一致,重组质粒构建成功,并命名为重组质粒pColdⅠ-E2。
1.5 重组质粒pColdⅠ-E2的诱导表达将重组质粒pColdⅠ-E2转化表达菌E.coli BL21(DE 3)中,37℃振荡培养至OD600值达到0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG,18℃振荡过夜。收集菌体加入PBS进行超声裂解,高速离心后分别收集上清和沉淀,加入5×SDS buffer煮沸10 min后进行SDSPAGE电泳,对SDS-PAGE蛋白胶染色,观察蛋白表达情况,同时设置空载体和未诱导表达组作为对照。
1.6 重组蛋白E2的纯化和透析挑取阳性单菌落,接种到4 mL含100μg/mL Amp的LB培养基中,37℃、200 r/min的摇床培养过夜。d2取出菌液,按1∶100接种于100 mL含100μg/mL Amp的LB培养液中,37℃、200 r/min培养,至OD600达到0.6~0.8时停止,加入终浓度为0.5 mmol/L IPTG,低温诱导过夜,d2离心收集菌体。表达后的菌体进行超声破碎,差速离心后收集包涵体蛋白。采用自动液相层析系统对蛋白进行纯化,纯化后的蛋白进行透析处理,以去除蛋白溶液中的有害物质,目的蛋白于-80℃保存。
1.7 重组蛋白E2的Western blot鉴定将E2蛋白进行SDS-PAGE电泳后,低温、恒流240mA 2 h的条件下将蛋白条带转移至PVDF膜上,取出膜浸没在脱脂乳中封闭1 h。封闭过后分别使用1∶5000稀释的鼠源His单抗和1∶2000稀释的本实验制备的多克隆抗体作为一抗,4℃摇床孵育过夜。d2取出膜经TBST充分洗涤3次,每次10 min,再加入1∶10 000稀释的HRP标记羊抗兔IgG,室温孵育1.5 h;TBST反复洗涤5次,每次10 min,最后用ECL发光试剂盒对膜进行显色。
1.8 多克隆抗体的制备对兔子进行免疫以获得抗E2蛋白多克隆抗体血清。将重组蛋白pColdⅠ-E2与弗氏佐剂按1∶1进行乳化,乳化完全后按0.5 mg/只经皮下多点注射兔子,每隔2周加强1次免疫,免疫剂量为每只0.6 mg/只,待效价达到1∶50 000时停止免疫。共免疫5次。
2 结果
2.1 重组质粒pColdⅠ-E2的构建将E2全基因组序列连接到pUC57载体上,构建了重组质粒pUC57-E2,受体菌株为E.coli DH5α。重组质粒pUC57-E2经EcoRⅠ和XbaⅠ双酶切后在1278 bp处出现目的条带,与预期相符(图1)。将胶回收产物E2基因片段与载体pColdⅠ进行连接,连接产物进行酶切验证。电泳结果显示,在1278 bp和4407 bp出现目的条带,与预期相符(图2)。挑选酶切验证阳性菌液送至上海桑尼生物科技有限公司进行测序,测序结果与合成片段序列一致,表明重组载体 pColdⅠ-E2构建成功。

图1 pUC57-E2酶切产物鉴定结果Fig.1 Identifi cation of pUC57-E2 by restriction enzymes digestion
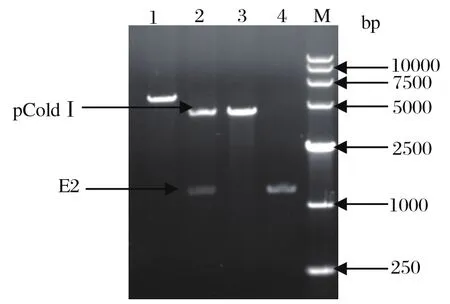
1: 重组质粒pColdⅠ-E2单酶切; 2: 重组质粒pColdⅠ-E2双酶切; 3: pColdⅠ; 4: E2片段阳性对照; M: DNA分子质量标准(DL15 000)1: Recombinant plasmid pColdⅠ-E2 digested with EcoRⅠ; 2: Recombinant plasmid pColdⅠ-E2 digested with EcoRⅠand XbaⅠ; 3: pColdⅠ; 4: Positive control of gene segment E2; M: DNA Marker(DL15 000)
2.2 重组质粒pColdⅠ-E2的诱导表达菌体经过超声破碎,高速离心后收集上清和沉淀,沉淀经差速离心后得到包涵体蛋白,同时设置空载体pColdⅠ和未诱导pColdⅠ-E2作为对照进行SDS-PAGE(图3)。结果显示在包涵体泳道上出现了相对分子质量约为46 kDa的目的条带,而在上清、空载体pColdⅠ和未诱导pColdⅠ-E2泳道中均未出现目的条带。结果表明重组质粒pColdⅠ-E2在E.coli BL21 ( DE 3 )中以包涵体形式得到成功表达。

图3 pColdⅠ-E2的诱导表达和鉴定Fig.3 SDS-PAGE analysis of IPTG induced expression of pColdⅠ-E2
2.3 重组蛋白E2的纯化大量表达的目的蛋白E2经镍柱纯化,结果显示纯化后的蛋白条带单一且浓度高(图4),收集纯化后的目的蛋白进行透析,与佐剂混合乳化可作为免疫抗原使用。
2.4 重组蛋白E2的Western blot鉴定将已诱导的pColdⅠ-E2和空载体pColdⅠ经SDS-PAGE电泳后,转至PVDF膜上,使用商品化的鼠源His单抗1∶5000稀释作为一抗,HRP标记羊抗兔IgG1∶10 000稀释作为二抗进行Western blot分析。结果显示重组质粒pColdⅠ-E2在46 kDa处出现目条带,且条带单一,阴性对照pColdⅠ未出现目的条带(图5)。取5次免疫后的血清1∶2000稀释作为一抗,HRP标记的羊抗兔IgG1∶10 000稀释作为二抗,进行Western blot分析。结果显示,E2蛋白多克隆抗体能与pColdⅠ-E2发生特异性结合在46 kDa处出现目的条带,而与空载体pColdⅠ并没有特异性结合出现条带(图6)。结果证明,重组蛋白E2具有良好的免疫原性且能与多克隆抗体血清发生特异性反应。

图4 重组蛋白E2纯化结果Fig.4 SDS-PAGE result of the purifi ed pColdⅠ-E2 protein

图5 重组蛋白E2的Western blot鉴定Fig.5 Identifi cation of pColdⅠ-E2 protein using anti-His Tag mouse McAb by Western blot
3 讨论
GETV属于虫媒病毒,刺扰伊蚊(Aedes vexans)被认为是最主要的传播媒介,其次是三带喙库蚊(Culex tritaeniorhy)[16]。GETV主要分布于我国南方城市,以云南省和海南省为主,流行时间为每年的7~9月,属于蚊虫高发时期。GETV可引起人类和脊椎动物感染,属于人畜共患病[17],马和猪是其主要宿主。1966年和1969年,澳大利亚学者对人和动物的血清抗体进行检查,证明了盖他病毒对人和动物都存在感染性[18],直到现在仍然没特效的治疗方法。用GETV灭活疫苗免疫赛马,被证明获得了较好的保护效果,说明GETV疫苗可以预防病毒对动物的感染[19]。

图6 E2蛋白多克隆抗体的Western blot鉴定Fig.6 Identifi cation of E2 protein using rabbit polyclonal antibody by Western blot
我国已报道的GETV检测方法主要是通过采集蚊虫对病毒进行分离[12],但是这种方法却存在许多弊端。首先蚊虫采集受到地域和季节的限制,其次病毒分离需要先感染细胞或动物,然后再提取病原进行检测分离,传代周期较长,无法快速得到结果。所以建立更准确、快速、便捷的实验室诊断方法显得尤为重要[15]。本研究采用直接合成E2基因全序列,避免了病原分离耗时过长,又减少了细胞培养易被污染和病毒丢失的可能性。同时,大肠杆菌在低温诱导时能自身产生CapA启动子,它能促进RNA聚合酶更好识别载体pColdⅠ启动蛋白快速表达,而大肠杆菌自身的蛋白表达则会在低温中受到抑制[20]。表达载体pColdⅠ自身所带有的6×His是重组蛋白的识别标签[21],它能与目的蛋白融合表达,再通过镍柱和自动液相层析仪对蛋白进行纯化,可获得纯度较高的蛋白。纯化后的蛋白放入透析袋中进行透析以去除尿素、咪唑等有害物质,这样能避免切胶免疫对动物的毒性。利用纯化蛋白制备的多克隆抗体能够很好的与E2蛋白发生特异性反应。本研究结果为GETV相关检测方法的建立和病原学研究提供了科学依据。
[1] Lzumida A, Takuma H, Inagaki S, et al.Experimental infection of Getah virus in swine[J].Nihon Juigaku Zasshi, 1988, 50 (3)∶ 679-684.
[2] Bryant J E, crabtree M B, Nam VS, et al.Isolation of arboviruses from mosquitoes collected in northem Vietnam[J].Am J Trop Med Hyg, 2005, 73(2)∶ 470- 473.
[3] Powers A M, Brault A C , Shirako Y, et al.Evolutionary relationships and systematics of the alpha viruses[J].J Virol, 2001, 75∶ 10118-10131.
[4] Chang C Y, Huang C C, Huang T S, et al.Isolation and characterization of a Sagiyama virus from domestic pigs[J].J Vet Diagn Invest, 2006, 18(2)∶ 156-161.
[5] 梁勇, 张连山, 刘永为, 等.在我国北方涉县首次检测到盖塔病毒[J].中国卫生检验杂志, 2010, 9, 20(9)∶ 2121-2120.
[6] 陈伯权, 刘琴芝, 周国芳, 等.我国一些地区人血清的虫媒病毒抗体调查[J].中华流行病学杂志, 1983, 4(5)∶ 263-274.
[7] 张海林, 梁国栋.中国虫媒病毒和虫媒病毒病[J].中国媒介生物学及控制杂志, 2012, 10, 23(5)∶ 377-380.
[8] Kumanomido T,Wada R, Kanemaru T, et al.Clinical and virological observation on swine experimentally infected with Getah virus[J].Vet Microbiol, 1988, 16(3)∶ 295-301.
[9] 杨火, 饶颐年, 陈日光, 等.海南岛1株甲组虫媒病毒的分离、鉴定和血清抗体调查[J].中华微生物学和免疫学杂志, 1984, 4(2)∶ 107-111.
[10] 翟友刚, 王焕琴, 许海魁, 等.甘肃省天水及陇南部分地区虫媒病毒调查[J].中国人兽共患病学报, 2008, 24(2)∶95-99.
[11] Li X D, Qiu F X,Yang H, et al.Isolation of Getah virus from mosquitos collected on Hainan Island,China,and results of aserosurvey[J].Southeast Asian J Trop Med Public Health, 1992, 23(4)∶ 730-734.
[12] 张小敏, 何楚, 周斌, 等.猪盖他病诊断方法研究进展[J].上海畜牧兽医通讯, 2013, (2)∶ 25-27.
[13] Zhao C S, Jian L H, Yu X L, et al.Isolation of Ross river virus and its antibody prevalence in Hainan Province[J].Chinese, 1997, 17(3)∶ 241-243.
[14] Brown C M, Timoney P J.Getah virus infection of Indian horses[J].Trop Anim Health Prod,1998, 30(2)∶ 241-252.
[15] 李向茸, 冯若飞, 刘俊林, 等.盖他病毒重组E2蛋白间接ELISA检测方法的建立[J].中国兽医科学, 2012, 42(10)∶1037-1042.
[16] Stoeva S I, Lee J S, Smith J E, et al.Multiplexed detection of protein cancer markers with biobarcoded nanoparticle probes[J].J Am Chem Soc, 2006,128(26)∶ 8378-8379.
[17] Kanamitsu M, Taniguehi K, Urasawa S, et al.Geographic distribution of arbovirus antibodies in indigenous human populations in the Indo-Australian archipelago [J].Am J Trop Med Hyg, 1979, 28 (2)∶ 351-363.
[18] 侯云德.分子病毒学[M].2版.北京∶ 学苑出版社, 1990, 430-435.
[19] Kono Y, Senlsui H, Ito Y, et al.An epidemic of Getah virus infection among racehorses∶ properties of the virus[J].Res Vet Sci, 1980, 29(1)∶162-167.
[20] 姜焱, 何丹妮, 张小敏, 等.猪盖他病毒衣壳蛋白的原核表达、纯化和多克隆抗体的制备[J].病毒学报, 2013, 29(4)∶ 371-375.
[21] Ora A, Oksancn E, Kajandcr T, et al.Crystallization and preliminary crystallographic analysis of mouse peroxiredoxin Ⅱwith significant pseudosymmetry[J].Acta Crystallogr Sect F Struct Biol Cryst Commun, 2010, 66(Pt3)∶ 357-360.
EXPRESSION AND CHARACTERIZATION OF RECOMBINANT E2 PROTEIN OF GETAH VIRUS
LU Ying-mei1,2,3, WEI Jian-chao2, XIA Peng2, WU Ya-ling2, LI Qian-qian2, WU Zhuan-chang2, QI Peng-fei2, SHI Kun2, LI Yu-ming2, QIU Ya-feng2, LI Bei-bei2, LIU Ke2, SHAO Dong-hua2, ZHOU Wang-Ping1,3, MA Zhi-yong2
(1.College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China, 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3.Hunan Institute of Animal and Veterinary Science, Changsha 410000, China)
The E2 gene of Getah virus strain SH05-6 was optimized and synthesized according to the complete genome sequence published in GenBank (EU015066).The synthesized E2 gene was cloned into the expression vector pCold I for generation of a recombinant plasmid pColdⅠ-E2.The plasmid pColdⅠ-E2 was then transformed into E.coli BL21 (DE3) competent cells following induction with IPTG.The expression of the target E2 protein was detected in SDS–PAGE and Western blot.The results showed that the recombinant E2 was a 46 kDa protein corresponding to the molecular mass of the expected E2 and accounted for approximately 80% of total protein expressed in E.coli.The recombinant E2 protein reacted with antiserum against Getah virus.The availability of the recombinant E2 protein has laid a foundation for development of rapid detection and epidemiological investigation methods for Getah virus.
Getah virus; prokaryotic expression; E2 gene
S852.659.6
A
1674-6422(2015)02-0015-06
2015-01-12
上海市科技兴农重点攻关项目(沪农科攻字(2013)第5-6号);公益性行业(农业)科研专项(201303045);国家自然科学青年基金(31302116)
陆莹梅,女,硕士研究生,预防兽医学专业
马志永, E-mail∶ zhiyongma@shvri.ac.cn;周望平, E-mail∶ wpklagh@126.com
