小反刍兽疫病毒RT-LAMP检测方法的研究
杨 卓,于汉勋,李 巍
(1.大连市动物疫病预防控制中心,辽宁 大连 116037;2.大连市畜牧总站,辽宁 大连 116037)
小反刍兽疫病毒RT-LAMP检测方法的研究
杨 卓1,2,于汉勋1,2,李 巍1,2
(1.大连市动物疫病预防控制中心,辽宁 大连 116037;2.大连市畜牧总站,辽宁 大连 116037)
本试验利用浊度仪,采用实时浊度法进行小反刍兽疫病毒RT-LAMP方法检测。试验表明在65℃,50 m in内即可完成对小反刍兽疫病毒的检测。通过敏感性试验证明了该试验方法只能检测目的病毒,而与同属病毒无交叉反应,灵敏性试验表明其灵敏度与Real-time RT-PCR方法相当,临床样本试验表明其准确性与RT-PCR检测试剂盒相当。
实时浊度法;小反刍兽疫病毒;检测
小反刍兽疫(peste des petisruminants,PPR)是由小反刍兽疫病毒(peste des petisruminants virus,PPRV)引起的一种严重的烈性、接触性传染病。本病发病率可达100%,属于OIE法定需报告的动物疫病,我国将其列入一类动物疫病。从遗传进化系上,PPRV可分为4个谱系,谱系4分布最广[1]。我国于2007年7~9月,在西藏首次爆发小反刍兽疫疫情[2]。目前,我国PPRV有两种,分别为西藏株和新疆株。通过遗传进化分析结果显示,新疆株亦属于谱系4[3]。目前该病的主要检测方法有通过血清学检测抗体和病原的ELISA方法,以及检测病毒核酸的普通PCR和RT-PCR方法。
环介导等温核酸扩增(Loop-mediated isothermal ampl if ication,LAMP)是由Notomi等发明的一种新型核酸扩增技术,该技术具有快速、高效、高特异性和反应条件简单等优点,已经被应用于多种疾病病原的检测,如尼罗河病毒[4]、日本脑炎病毒[5]、裂谷热病毒[6]、口蹄疫病毒[7]等。本文利用RT-LAMP技术和浊度仪,在65℃、扩增1 h的条件下,对小反刍兽疫病毒核酸检测方法进行了研究。
1 材料和方法
1.1 材料 小反刍兽疫疫苗株(N75-1)、西藏分离株、新疆分离株和临床样本来自中国动物卫生与流行病学中心(简称“流研中心”),小反刍兽疫疫苗株提取物来自新疆天康疫苗,犬瘟热病毒来自辽宁省出入境检验检疫局。
1.2 试剂 小反刍兽疫RT-PCR检测试剂盒,核酸提取试剂盒,核糖核酸扩增试剂盒,LAMP反应管。
1.3 仪器设备 浊度仪La-320C(日本荣研化学株式会社);PCR反应仪(AB公司7500);分光光度计(NanoDrop ND-1000)。
1.4 核酸提取 所用病毒RNA核酸均按照核酸提取试剂盒说明进行提取,分光光度计测定浓度,使用之前放-80℃保存。
1.5 反应条件和方法 本试验按照核糖核酸扩增试剂盒说明书进行操作。反应体系为25μL,其中FIP、BIP均为40 pmol;LF为20 pmol;F3、B3均为5 pmol;2×反应缓冲液12.5μL;酶溶液1.0μL;去离子水4.5μL;RNA样本2μL。最佳引物筛选反应在65℃,90 min完成;特异性、敏感性和样本检测在65℃。
1.6 判定方法 RT-LAMP法和Real-time RT-PCR检测小反刍兽疫病毒的判定方法如表1。
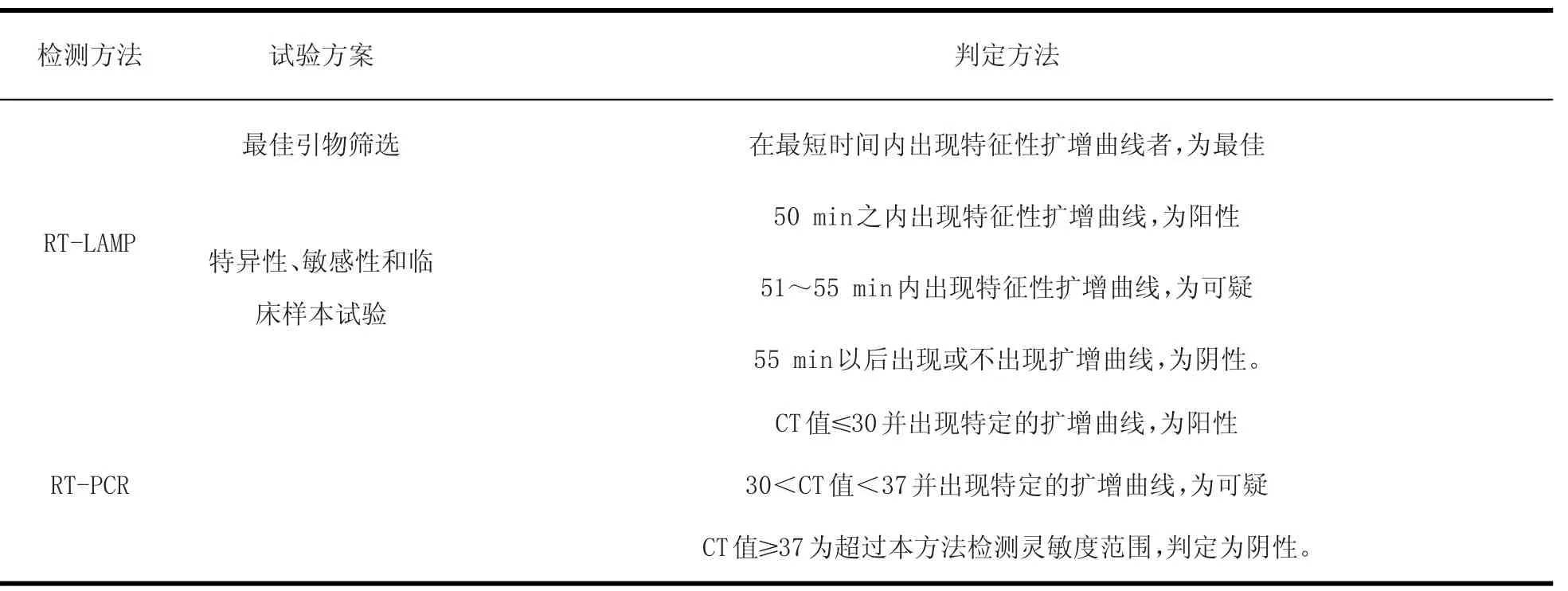
表1 RT-LAMP法和Rea l-time RT-PCR法判定标准Table1 Assessm ent standard for RT-LAMP and Real-time RT-PCR
1.7 RT-LAMP引物设计及最佳引物筛选 通过对小反刍兽疫病毒N基因序列进行生物信息学分析,确定以GenBank中小反刍兽疫病毒序列号KM091959.1为模版参考序列。根据LAMP引物设计软件(网址:http://primerexplorer.jp/e/)进行LAMP引物设计,得到6组引物。通过最佳引物筛选试验,得出小反刍兽疫病毒RT-LAMP反应的最佳引物。
1.8 特异性试验 将不同时间和不同地点分离出的小反刍兽疫病毒RNA样本与同属的犬瘟热病毒RNA,按照如上体系进行反应,分析其特异性。
1.9 敏感性试验 分别用新疆天康小反刍兽疫病毒疫苗、西藏株病毒样本、疫苗株(N75-1)样本进行核酸提取,测定浓度后进行Real-time RT-PCR法和RT-LAMP法敏感性比较,分析两种反应对各类试验样本的敏感性。
1.10 临床样本试验 以新疆天康小反刍兽疫病毒疫苗和流研中心保存的新疆株、西藏株、疫苗株(N75-1)等各类型小反刍兽疫病毒样本为检测对象,分析其在临床检测中的应用。
2 结果
2.1 最佳引物筛选结果 以新疆天康小反刍兽疫病毒疫苗提取RNA,进行小反刍兽疫RT-LAMP反应的最佳引物筛选反应模版。结果详见图1。
从结果看,6号引物在24 min时最先发生反应,并出现特征性扩增曲线,可判定6号引物为小反刍兽疫RT-LAMP反应最佳引物。引物序列见表2。2.2 特异性试验结果 以不同地区和不同时间分离的小反刍兽疫病毒样本和犬瘟热病毒样本进行比较,结果如图2所示。说明,本研究设计的小反刍兽疫RT-LAMP检测引物对各类小反刍兽疫病毒样本均发生特异反应,但不与其他同属病毒发生反应。从而证明了针对该引物建立的小反刍兽疫RT-LAMP反应具有良好的特异性。
2.3 敏感性试验结果 试验前,测定天康疫苗提取核酸(简称为T)浓度为2.3 ng/μL,疫苗株(N75-1)提取核酸(简称为Y)浓度为220 ng/μL,西藏株提取核酸(简称为X)浓度为89.2 ng/μL。分别将天康疫苗提取核酸进行4个梯度的倍比稀释;将疫苗株(N75-1)提取核酸进行6个梯度的倍比稀释;将西藏株提取核酸进行6个梯度的倍比稀释。同时用小反刍兽疫病毒检测试剂盒进行Real-time RT-PCR方法和本研究设计的RT-LAMP检测方法进行比对。RTLAMP方法试验结果如图3~5;RT-PCR方法实验结果如图6~8。
由试验结果可知,小反刍兽疫RT-PCR检测试剂盒对天康疫苗的灵敏度为2.3×10-5ng/μL,对疫苗株(N75-1)的灵敏度为0.2201 ng/μL,对西藏株的灵敏度为0.0892 ng/μL。而本研究建立的RT-LAMP检测方法对天康疫苗的灵敏度为2.3×10-5ng/μL,对疫苗株(N75-1)的灵敏度为0.2201 ng/μL,对西藏株的灵敏度为0.0892 ng/μL。RT-PCR与RT-LAMP两者检测敏感性一致。
2.4 临床样本试验 对10个临床样本使用RTLAMP方法和Real-time RT-PCR方法进行检测。其中Real-time RT-PCR方法用小反刍兽疫检测试剂盒,试验结果如表3。从试验结果看,本研究建立的RT-LAMP检测方法的准确性与RT-PCR结果一致。

图1 小反刍兽疫RT-LAMP最佳引物筛选试验结果Fig.1 Resu lts of the screen assay for the best primers o f RT-LAMP注:CH1~CH6为6组备选引物(分别称为1~6号引物),CH7为阴性,CH8为空白。

表2 小反刍兽疫RT-LAMP引物序列Tab le2 RT-LAMP primer sequences for PPRV

图2 特异性试验结果Fig.2 Specific test results注:CH1为流研中心疫苗株,CH2为新疆天康疫苗,CH3为新疆株样本,CH4为西藏株样本,CH5为犬瘟热病毒样本,CH6-CH8为空白

图3 RT-LAMP法天康疫苗和疫苗株(N75-1)敏感性试验结果Fig.3 Result o f sensitivity assay of Tiankang vaccines and vaccine strains(N75-1)注:CH1~CH5依次为T原浓度和4个梯度稀释;CH6~CH8依次为Y原浓度和2个梯度稀释
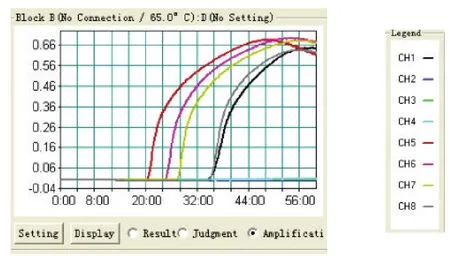
图4 RT-LAMP法疫苗株(N75-1)和西藏株敏感性试验结果Fig.4 Resu lt of sensitivity assay o f Tiankang vaccines and vaccine strains(N75-1)注:CH1-CH5依次为T原浓度和4个梯 vaccine st rains(N75-1) and Xizang st rains
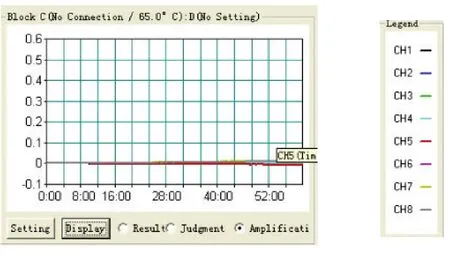
图5 RT-LAMP法西藏株敏感性试验结果Fig.5 Resu lt of sensitivity assay o f Xizang strains注:CH1~CH4依次为X的4个梯度稀释;CH5~CH8为空白。

图6 RT-PCR法天康疫苗敏感性试验结果Fig.6 Result o f sensitivity assay o f Tiankang vaccin es注:1~5依次为天康疫苗原浓度和4个梯度稀释。
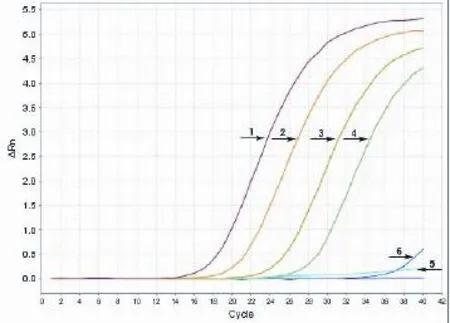
图7 RT-PCR法疫苗株(N75-1)敏感性试验结果Fig.7 Resu lt of sensitivity assay o f vaccine strains(N75-1)注:1~6依次为疫苗株(N75-1)原浓度和5个梯度稀释。
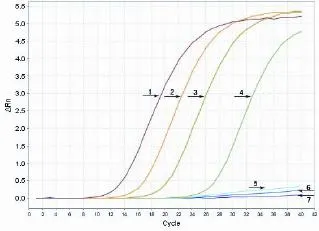
图8 RT-PCR法西藏株敏感性试验结果Fig.8 Result o f sensitivity assay of Xizang strains注:1~7依次为西藏株原浓度和6个梯度稀释。

表3 小反刍兽疫临床样本检测结果Table3 Results o f clinica l samp les test o f PPRV
3 讨论
由于LAMP具有检测方法简单、检测用时短、不需要复杂仪器设备等优点,已被应用到了多种病原微生物的检测。对于LAMP产物的检测方法,目前有四种:一是传统的琼脂糖凝胶电泳检测,二是眼观白色沉淀检测法,三是荧光指示剂法,四是浊度仪检测法。前三种方法为目前比较普遍的试验结果检测法,但是不足在于无法判定反应中是否出现污染、二聚体扩增等假阳性情况,从而得不到准确、高效的反应体系。
本试验中,利用了浊度仪,采用实时浊度法可以实时监测反应过程中所产生的白色焦磷酸镁沉淀,从而实现对LAMP整个反应过程的实时监控。通过对曲线形态的分析,能够客观准确的排除假阳性结果;通过沉淀产生的起始时间判断反应的进行程度;通过浊度值的高低和反应开始时间的快慢来确定最佳反应体系。
本试验根据实时浊度法进行小反刍兽疫病毒RT-LAMP检测,特异性试验结果表明该反应体系能够检测出不同种类的小反刍兽疫病毒,而不与同属的其他种类病毒发生反应。灵敏性试验表明,其灵敏性与Real-time RT-PCR灵敏性相当;临床样本试验表明,在实际应用中,其对阳性样本的检出率与RT-PCR检测试剂盒一致。针对各类样本检测,本试验方法均能在40 min以内出现扩增,并在50 min以内进行结果判定,大大缩短了检测时间,提高了检测效率。以上结果表明,本试验体系能够简便、快速、准确地进行小反刍兽疫病毒检测,在临床应用中,只需要普通的恒温金属浴或水浴锅设定具体的反应温度即可进行小反刍兽疫病毒的检测和鉴别,因此具有较高的应用价值。
[1]Dhar P,B P Sreeniwasa,T Barret t,et al.Recent epidemiology of peste des petits ruminants virus(PPRV)[J]. Vet Microbiol, 2002, 88:153-159.
[2]Wang Z,J Bao,X Wu,et al.Peste des petits ruminants wirus in Tibet,China[J].Emerg Infect Dis,2009,15:299-301.
[3]王清华,刘春菊,吴晓东,等.新疆小反刍兽疫疫情诊断[J].中国动物检疫,2014,31:72-75.
[4]Ryl l M,Christensen H, Bisgarrd M,et al. Studies on the prevalence of Riemerel la anatipesti fer in the upper respiratory t ract of cl inical ly heal thy duckl ings and characterization of untypale st rains[J].Journal of Veterinary Medicine,2001,48:537-546.
[5]Tsai H J,Liu Y,Tseng C S,et al.Genetic variation of the ompA and 16SrRNA genes of Riemerel la anatipesti fer[J].Avian Pathology,2005,34(1):55-64.
[6]Hinz K H,Ryl l M,Kohler B,et al.Phenotypic characteristics of Riemerel la anatipesti fer and simi lar micro-organisms f rom various hosts[J].Avian Pathology,1998,27:33-42.
[7]秦智峰,曾少灵,阮周曦,等.口蹄疫病毒RT-LAMP检测方法的建立[J].中国预防兽医学报,2008,5:375-378.
DevelopmentResearch of RT-LAMP for Detection of Peste des Petisrum inants Virus
Yang Zhuo1,2,Yu Hanxun1,2,Li Wei1,2
(1.Dal ian Animal Disease Prevention and Cont rol Center,Liaoning Dal ian 116037;2.Dal ian Animal Husbandry Station,Liaoning Dal ian 116037)
real-time turbidity method which was based on reverse-t ranscription loop-mediated ampl if ication(RT-LAMP)was developed for the detection of peste des petisruminants virus(PPRV)Using turbiditymeter.The resul ts indicated that the detection of PPRV test could be f inished in 50 min at 65℃.The sensitivity of Real-time RT-PCR test resul t indicated that there was no cross-reaction with other related viruses,the accuracy of Real-time RT-PCR test resul t was as wel l as RTPCR detection kit of PPRV.
Real time turbidity method;Peste des petisruminants virus;Detection
S852.659.5
1672-9692(2015)07-0008-07
2015-05-23
杨卓(1983-),女,大学本科,兽医师,研究方向:动物疫病诊断及防控。
于汉勋(1965-),男,大学本科,研究员级高级兽医师,研究方向:动物疫病诊断及防控。

