在碱金属/液氨作用下两类还原反应的机理探讨
戴亚中 裴坚
(北京大学化学与分子工程学院 北京100871)
除金属铍以外的碱金属和碱土金属均可溶解在液氨中并形成一种蓝色溶液。碱土金属和碱金属溶解于液氨中均会生成氨合金属正离子(M(N)和氨合电子(e(N)。这种处在亚稳状态的溶液具有很强的还原性(e(NH3的标准电极电势为-2.86V)。但是,这种溶液会逐渐分解,产生金属氨基化物和氢气。在低温条件下,分解反应的速率比较缓慢;但在有过渡金属盐催化时,分解反应会加速进行。这种具有强还原性的碱金属/液氨溶液在有机合成中得到广泛的运用,主要包括两类还原反应:炔烃被还原成烯烃的反应和Birch还原反应,一般认为它们在反应过程中都生成了自由基负离子中间体。我们将在本文中对它们的机理进行进一步探讨。
1 碱金属/液氨下炔烃的还原反应
炔烃用碱金属和液氨还原生成烯烃的反应,是有机化学中合成E型烯烃衍生物的经典方法之一。例如在图1中,2-丁炔可以通过此还原反应生成E型2-丁烯[1]:

图1 2-丁炔用钠和液氨还原生成E型2-丁烯
反应的过程如图2所示:首先是炔烃分子(1)中的碳碳三键从液氨中得到一个氨合溶剂化电子生成烯基负离子自由基(2)。烯基负离子自由基(2)是一种很强的碱,能够从液氨中夺取一个质子生成E型烯基自由基(3),该烯基自由基继续从碱金属处得到一个电子生成烯基碳负离子(4)后,4再从液氨中夺取一个质子生成最终产物E型烯烃(5)[1]。
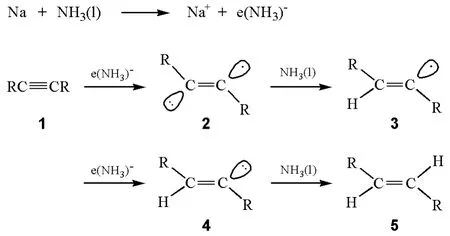
图2 炔烃用钠和液氨还原的机理
产物烯烃的立体构型是在化合物1转化为3的过程中建立的。在反应过程中,首先生成了烯基自由基负离子,然后2得到质子后生成烯基自由基(3),接着生成空阻较小的反式烯基负离子(4),因此反应产物的构型为E型。通过ESR(电子自旋共振谱)实验的测量发现烯自由基的E/Z构型的翻转能垒很低,约为12kJ/mol[2],因此烯基自由基可以进行快速的顺式和反式之间的平衡,但是烯基负离子的顺式和反式的转换要慢得多。因此,更为稳定的反式烯基负离子就比顺式的烯基负离子更容易生成,它在形成平衡前就被质子化生成E型烯烃。该反应条件中溶剂为液氨,是一种强极性的溶剂,对反应中间体(2和3)有强的溶剂化作用,可以进一步稳定反应中间体,使这些中间体的构型不容易改变。
此外,由于烷基自由基负离子较乙烯基自由基负离子稳定性差,因此,得到的烯烃难于在此条件下继续被还原成烷烃。末端炔烃不适用于此条件下的还原,因为末端炔烃的质子有着强的酸性,在此条件下优先发生酸碱中和反应,生成炔烃负离子,由于负电荷之间的互相排斥作用,炔烃负离子不易继续从溶液中得到电子而被还原。
综上所述,炔烃在碱金属和液氨还原条件下的反应机理主要是从中间体(2)开始,其新形成的双键构型主要为反式,最终决定了产物为E型烯烃。烯烃在此条件下不会继续被还原至烷烃。
2 Birch还原反应
Birch还原反应是有机化学中一个重要的人名反应,一般认为是指芳香族化合物在液氨和醇的混合液中被碱金属(钠、锂或钾)通过1,4-还原至非共轭的1,4-环己二烯的反应(图3)。杂环化合物(如吡啶、吡咯或呋喃类衍生物)也可以被还原。使用的醇通常是乙醇或叔丁醇。醇此时作为质子供体,为反应提供氢的来源。还原产物1,4-环己二烯中的孤立碳碳双键在这个条件下不会继续被还原至饱和烷烃。此外,Birch还原反应也有一些缺陷:富电子体系的杂环芳烃需要至少有一个吸电子取代基存在才能被还原。例如呋喃、噻吩不能被还原,只有其环上有吸电子取代基存在的条件下时才能被还原。

图3 Birch还原
在《基础有机化学》(第3版)中,对Birch反应做出了如下说明:“给电子基团一般导致还原速率减慢;吸电子基团使得还原速率加快,而且所得产物取代基团位于被还原的碳原子上”[1],下面对它的还原位置的选择性和反应的决速步进行探讨和理清。
研究表明,与炔烃被还原时一样,由于碱金属溶解于液氨,所得的溶液含有强还原性的溶剂化电子。底物中的苯环可以接受电子,形成的自由基负离子接着从溶剂中得到质子,不可逆地形成环己二烯自由基,环己二烯自由基再接受一个电子生成环己二烯负离子,最后环己二烯负离子的质子化过程发生在中心碳原子上,形成非共轭双烯——1,4-环己二烯。Birch A J等人通过计算发现己二烯负离子中间体HOMO的最大轨道系数在中间碳原子上,氢离子优先与位于中间的碳原子结合,生成1,4-环己双烯。因此Birch还原往往得到热力学不稳定的非共轭1,4-加成产物。而不是热力学稳定的1,3-加成产物[3]。此外,依据芳香族底物上取代基的位置,电子加成的位置也会有所不同。因此,Birch还原可能的机理有邻位进攻(ORTHO)、间位进攻(META)以及对位进攻(PARA)3种[4](图4)。
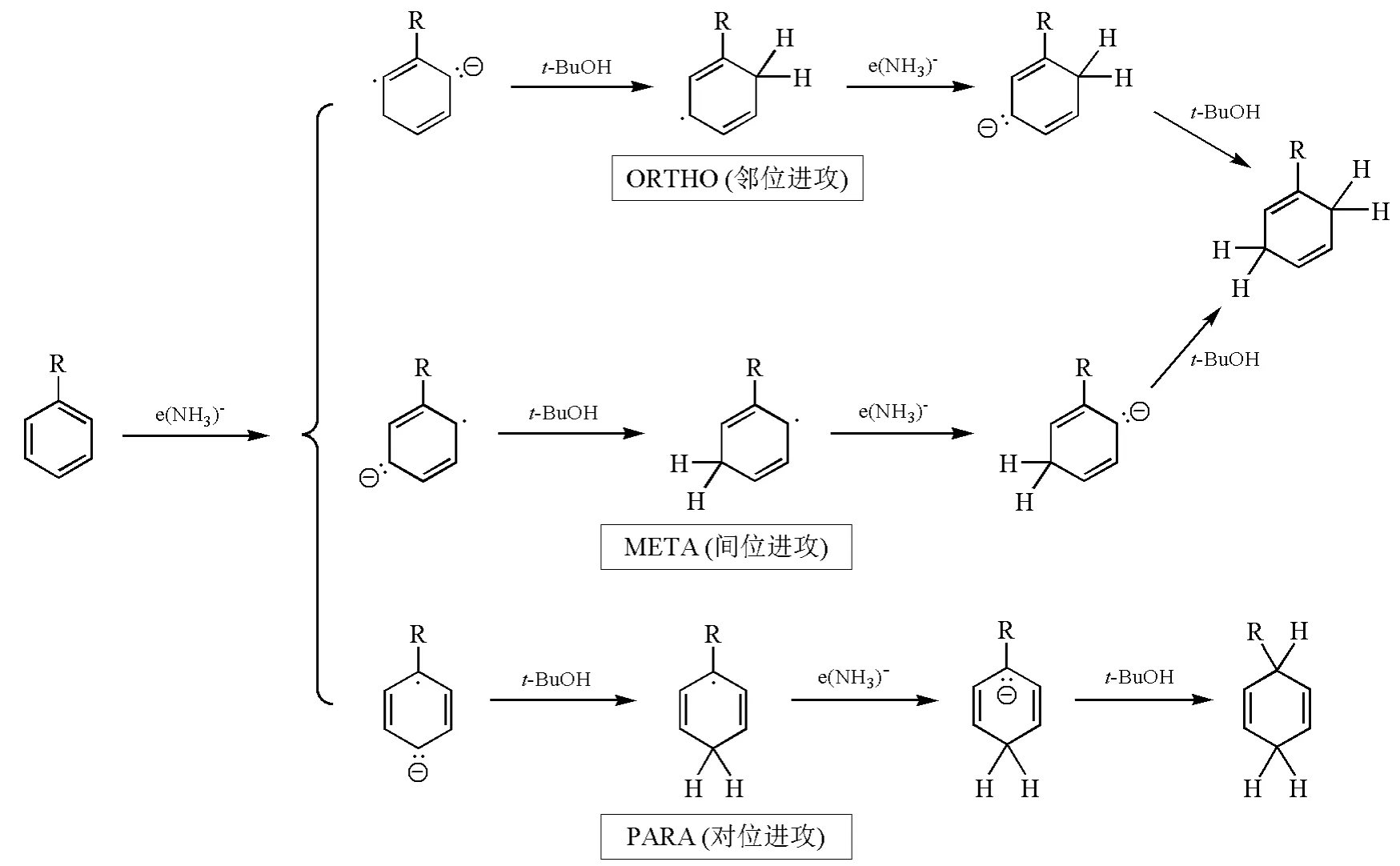
图4 Birch还原的可能途径示意图
总的来说,芳香化合物中的苯环通过Birch还原生成1,4-环己二烯的反应选择性主要取决于苯环上取代基的性质。当取代基为吸电子基时,往往采取PARA途径,此时反应在能量上更为有利,中间体能通过共振方式稳定碳负离子;当取代基是供电子基时,采取ORTHO或者META途径对于反应的进行更为有利。如图5所示,Zimmerman H E课题组以甲基苯和甲氧基苯为例,通过计算,比较了反应中间体自由基的能量,发现尽管ORTHO和META两种反应方式的最终产物相同,但是计算结果表明ORTHO途径的自由基中间体更为稳定[5]。Zimmerman H E课题组在还原甲氧基苯时,利用氘标记的特丁醇提供质子,通过测定反应产物氢原子同位素的位置及比例,以实验证明了甲氧基苯等富电子体系还原时以ORTHO方式为主[5]。
从Birch还原反应结果上看,相当于电子和R+(R可以是氢以外的物种)对苯环进行了1,4-加成(图6)。吸电子基团有利于电子对苯环的加成,因此能够加速反应的进行;给电子取代基则相反。当苯环上同时有给电子基团和吸电子基团的时候,Birch还原的选择性主要取决于吸电子基团[5]。
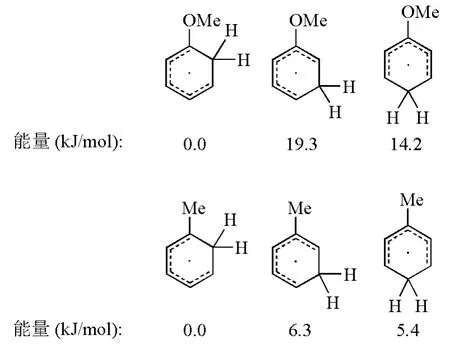
图5 自由基中间体的能量比较计算基组为B3LYP/6-3G*
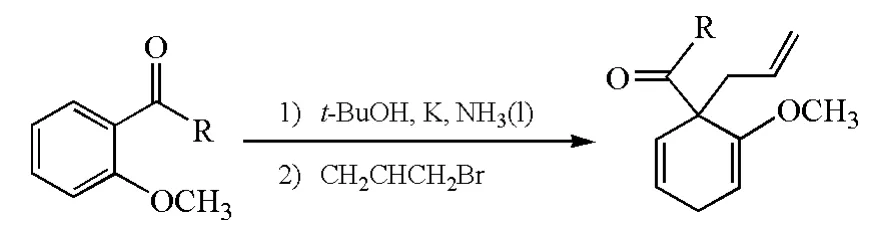
图6 多取代苯进行Birch还原时的反应选择性
Krapcho小组进行了测定Birch还原反应的反应速率常数的一系列实验,发现Birch还原反应在化学动力学上为三级反应,反应速度正比于芳香底物的浓度、溶剂化电子的浓度以及作为氢源的醇的浓度。通过动力学拟合,Krapcho等人认为图3中第二步,即环己二烯负离子与醇生成环己二烯自由基的反应为Birch还原反应的决速步。芳香体系上的吸电子取代基会有利于环己二烯负离子的生成,因此能提高Birch还原的反应速率。对于富电子的吡咯、噻吩等芳香化合物以及给电子基团取代的苯衍生物,如果芳环上没有吸电子取代基的话,环己二烯负离子不易生成,此时Birch还原反应速度很慢[6]。
考虑到Birch还原会生成一个负离子中间体,可以被一个合适的亲电试剂捕获,科学家在Birch还原的基础上,发展了Birch烷基化反应:在卤代烃的存在下,在Birch还原过程中得到的碳负离子可作为亲核试剂,经亲核取代反应生成新的碳碳键(图7)。

图7 Birch烷基化反应
Birch还原从反应过程中可以理解为芳环的1,4-还原,其产物为非共轭的1,4-环己二烯,孤立碳碳双键不会被还原成饱和烷烃。这是因为乙烯的最低未占有轨道(LUMO)能级为-1.5eV,e(NH3)x-的标准电极电势为-2.86 V,生成的乙烷负离子能量很高,不稳定,因此非共轭的双键不会被液氨中的溶剂化电子还原[7-8]。如果非芳香性的有机化合物LUMO能级足够低的话,它也可以在Birch还原的条件下被还原。Wooster C B与Godfrey K L等人发现对于共轭烯烃、α,β-不饱和羰基化合物、双取代炔烃、共轭炔烃和苯乙烯等体系,由于有共轭体系能稳定负电荷,它们也能够在液氨中被碱金属还原(图8)[9],这些反应已在有机合成中得到广泛的运用和推广[10]。
在图8中的α,β-不饱和羰基化合物的烷基化反应过程中,羟基与氨分子会形成氢键,导致氨上质子定向从羟基方位附近被夺取;在后续的烷基化过程中,烯醇负离子从位阻小的方位进攻卤代烷,反应有很高的立体选择性(图9)。

图8 Birch还原实例
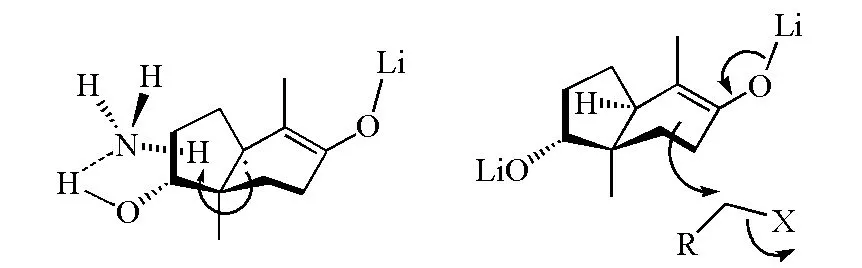
图9 Birch还原实例(图8(a))的反应构象
3 总结
碱金属还原反应在有机化学中应用广泛,本文结合该反应在《基础有机化学》[1]上的部分涉及内容(炔烃还原和Birch还原),调研文献,对它的反应机理进行了讨论,总结了这些反应生成特定产物的原因。
[1]邢其毅,裴伟伟,徐瑞秋,等.基础有机化学.第3版.北京:高等教育出版社,2009
[2]Fessenden R W,Schuler R H.J Chem Phys,1963,39(9):2147
[3]Birch A J,Hinde A L,Radom L.J Am Chem Soc,1980,102:6430
[4]Birch A J.J Am Chem Soc,1944,430
[5]Zimmerman H E.Acc Chem Res,2012,45:164
[6]Krapcho A P,Bothner-By A.J Am Chem Soc,1959,81:3658
[7]Lagowski J J.现代无机化学(上册).孟祥胜,许丙安译.北京:高等教育出版社,1984
[8]李彦如.承德民族师专学报,2004,24(2):42
[9]Wooster C B,Godfrey K L.J Am Chem Soc,1937,59(3):596
[10]Kaplan H Z,Rendina V L,Kingsbury J S.J Org Chem,2013,78:4620

