成人重症哮喘发病机制及治疗的进展
成人重症哮喘发病机制及治疗的进展
冯维宋旸李满祥
作者单位: 710061 西安,西安交通大学第一附属医院呼吸内科
【关键词】重症哮喘;发病机制;治疗
支气管哮喘是一种世界范围内常见的慢性呼吸道疾病[1-2]。目前全球约有3亿患者,每年约有25万人死亡[3-4]。随着全球哮喘防治创议(GINA)的推广,大部分轻至中度哮喘患者经过科学、规范的治疗,可以达到哮喘症状控制的目标。然而部分确诊为哮喘的患者,尽管经过长期规范化治疗,甚至使用大剂量糖皮质激素,症状仍难以控制,同时还要承受使用激素带来的不良反应,这部分患者被称为重症哮喘。这类患者比例约占10%~20%,具有很高的住院率及病死率,发生急性恶性事件风险大,医疗费用高,严重影响患者的生活质量,因而造成巨大的社会负担。因此,探究该部分患者的遗传特性、病理生理及临床特点,对这类患者的长期治疗和管理有很重要的临床实践意义[5]。
一、重症哮喘的概念
目前,国内外对于重症哮喘尚无统一定义。2013年美国胸科学会/欧洲呼吸学会(ERS/ATS)对重症哮喘的定义是:确诊为哮喘,在过去1年内需要按照指南建议,采用GINA推荐4~5级哮喘药物治疗方案,同时控制并存状态(或疾病),去除诱发因素后,仍不能良好控制的哮喘,见表1,2;或得到控制的哮喘,在使用大剂量吸入糖皮质激素或全身激素(或联合生物制剂)后减量时发生恶化。在此共识中,4~5级药物治疗方案指:成人吸入氟替卡松量>500 μg/d(或其等价剂量),并吸入长效β2受体激动剂等两种或两种以上缓解药物,或全身激素治疗≥50%的时间[6]。

表1 常用ICS高剂量表[6]
注:DPI:干粉吸入剂;CFC:氯氟烃;MDI:定量喷雾器;HFA:氢氟烷基化合物

表2 哮喘控制不佳评估标准表[6]
注:上述4项标准,有1项满足即可
2010年中华医学会呼吸病学分会哮喘学组规定了重症哮喘的诊断标准,满足以下3条标准,可诊断为重症哮喘:①按照我国哮喘防治指南中哮喘的诊断标准,确诊为哮喘;②排除患者治疗依从性不良,诱发加重或使哮喘变得难以控制的因素;③按照我国哮喘防治指南,采用第4级治疗方案,即使用2种以上控制性药物规范治疗,同时管理超过6个月,仍不能达到理想控制目标[8]。
二、重症哮喘的危险因素
哮喘的病因与患者的遗传过敏体质及外界环境触发因素相关。某些危险因素甚至能诱发加重哮喘,使症状变得难以控制。因此,充分认识这些危险因素,能有效避免哮喘急性发作,防止病情进一步恶化,对该病的长期控制具有重要意义。
1. 宿主危险因素
(1)遗传因素:哮喘是一种具有遗传倾向的疾病,受多基因调控,目前发现多个染色体区域与哮喘相关,包括1p36,2q14,4q13,5q31,6p24,7p14,11q13,12q24,13q14,14q24,16q23-21,20p。重症哮喘也存在遗传易感性,目前多认为与受体基因突变及多态性有关。在重症哮喘患者中,β2肾上腺素能受体基因上16位的精氨酸被甘氨酸替换概率较高[9-10];研究还表明,转化生长因子(transforming gronth factor-β, TGF-β)和单核细胞趋化蛋白-1基因突变,可促进气道纤维化,加重气道重塑发生发展;ADAM33基因产物过表达或修复机制异常,也可导致气道重塑的形成及哮喘的发生发展。值得注意的是,先天遗传因素和后天环境因素在哮喘的发病中均起着重要作用。
(2)共存疾病或状态:研究发现在重症哮喘患者中常伴发某些共存的疾病或状态,这些均能加重哮喘症状及急性发作的次数,如胃食管反流、肥胖、慢性鼻炎/鼻窦炎、阻塞性睡眠呼吸暂停低通气综合征及精神心理因素等[11]。
(a)胃食管反流病:因酸性胃内容物误吸入气道直接或通过食管间接刺激,兴奋气道内迷走神经感受器,反射性地引起气道平滑肌收缩,加重哮喘症状。因此,对合并胃食管反流患者,单纯使用抗喘药物治疗效果不佳时,治疗本病可改善肺功能情况[11-12]。
(b)慢性鼻炎/鼻窦炎:在重症哮喘患者中十分常见,其严重程度与哮喘气道炎症和肺功能降低程度呈正相关。当发生慢性鼻炎或鼻窦炎时,可通过以下机制加重哮喘发作:鼻黏膜上皮细胞受到病原体刺激, 通过鼻-肺反射途径,引起气道平滑肌收缩;鼻腔内的微生物顺行进入支气管, 可加重气道炎症。因此,对伴有鼻炎或鼻窦炎的哮喘患者, 在给予哮喘药物治疗的同时采取适当的手段治疗鼻炎或鼻窦炎,能较好控制哮喘症状[13-14]。
(c)阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome, OSAHS):研究表明,肥胖是OSAHS的危险因素之一,而在肥胖儿童中哮喘的发生率较高,说明OSAHS也是哮喘的危险因素之一。合并OSAHS的哮喘患者,有更高的气道反应性,其可能原因有以下方面:OSAHS患者常在睡眠时发生呼吸暂停,通过刺激喉、声门处神经受体,引起支气管反射性收缩,导致夜间症状加重;OSAHS患者常存在上呼吸道狭窄,气道阻力及迷走神经张力增高,可诱发哮喘急性发作[8]。
(d)肥胖:研究表明, 肥胖是儿童及成人哮喘的重要危险因素之一。在合并哮喘的儿童中,肥胖可能导致对吸入性糖皮质激素敏感性降低[15]。在一项对102例成人重症哮喘患者进行体质量指数(body mass index, BMI)与哮喘控制程度评价中,随着BMI增加,ACQ评分增加,FEV1、FVC、FEV1/FVC降低,使用口服糖皮质激素联合长效β激动剂(long acting β agonist, LABA)时间更长,合并Ⅱ型糖尿病或OSAS的病例数更多,说明肥胖是重症哮喘发生的重要危险因素[16]。其可能的机制是:肥胖状态下,白色脂肪含量增加,脂肪组织中大量巨噬细胞浸润,释放白介素-1β(interleukin-1β, IL-1β)IL-1β通过活化并增殖Th-17细胞介导炎症反应,加重气道高反应性[16]。
(e)精神心理因素:调查发现患者的情绪波动常与哮喘的发作有密切的联系[17]。当长期处于抑郁或焦虑状态时,哮喘发作次数明显比情绪平稳时高。此外,哮喘本身也会引起患者消极或过激的情绪反应。不良的心理因素是导致哮喘发病及影响疗效的重要因素。因此重症哮喘患者更应该注重保持积极的心态,保持情绪平稳[17]。
(3)依从性差:哮喘是一种需要长期规律药物控制的慢性疾病,提高患者的依从性能保证预期的治疗效果。林江涛等[17]发现治疗依从性差是我国重症哮喘最重要和最常见的危险因素之一。患者依从性差,长期慢性炎症不能控制,在外界诱因刺激下哮喘症状进一步加重。所以,当医生发现患者疗效与预期情况不符合时,应首先想到患者的依从性不良问题。而如何评估患者依从性并及时处理, 对患者的治疗疗效有很重要的意义[8,17]。
2. 外界环境因素
(1)呼吸道感染:呼吸道感染是重症哮喘急性加重的重要危险因素之一。急性上呼吸道感染可使哮喘症状明显加重,肺功能急剧恶化。真菌感染与重症哮喘的急性发作及严重程度相关。通过支气管肺活检发现,依赖口服糖皮质激素、急性事件频繁发生的重度哮喘患者气道内以嗜酸粒细胞和肥大细胞浸润为主。肥大细胞活化、脱颗粒,释放炎性介质(IL-4和白三烯B4),在促进炎症反应发生发展中扮演重要角色。这提示重症哮喘可能与潜在病毒感染有关[17]。研究表明,在成人哮喘急性发作中,大约60%的急性发作与上呼吸道感染有关,其中HRV-C、呼吸道合胞病毒、流感病毒感染可导致重症哮喘急性发作致死性事件发生[18]。
(2)吸烟:吸烟是多种慢性病的病因之一,同时吸烟也是哮喘发病的危险因素之一。无论是主动吸烟还是被动吸烟,均可加速肺功能恶化,加重哮喘病情,降低哮喘药物治疗的有效性[3]。吸烟的损害主要表现为:①增加气道高反应性;吸烟的哮喘患者可同时具有哮喘症状和早期慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的某些特点,如气道中性粒细胞浸润为主的炎症、肺过度充气、肺弥散功能降低和更多的肺气肿样影像学表现。Willemse等[19]发现,在戒烟后1年,气道高反应性仍然存在;②激素反应性下降;Kobayaski等[20]研究结果显示,被动吸烟组儿童气道巨噬细胞中HDAC2呈过表达,Ak1磷酸化水平与HDAC2活性负相关,推测烟草烟雾通过氧化应激作用活化PI3K/Akt信号通路,抑制HDAC2的转录表达,阻断激素抗炎作用中抗炎因子基因转录过程,从而降低激素敏感性;③加重气道重塑;郭志宏等[21]研究结果显示,吸烟组气道壁厚度、Ⅲ型胶原和TGF-β1 mRNA表达水平均有增高。并且随着TGF-β1 mRNA表达水平增高,Ⅲ型胶原水平也增高;王锐英等[22]研究结果显示,吸烟组气道壁厚度明显增加,肺组织中MMP-9和TIMP-1过度表达,比例失调。推测烟草烟雾可通过以下二方面加重哮喘的气道重塑:一方面,可能通过TGF-β1 mRNA的过度表达,增加了气道上皮下Ⅲ型胶原表达;另一方面,通过影响MMP-9/TIMP-1表达比例失衡,导致气道壁细胞外基质沉积增多。
三、发病机制
哮喘的发病机制尚不完全清楚。免疫-炎症反应是形成哮喘的病理基础。在轻中度哮喘患者中,经典的发病模式是以CD4+Th2细胞为主,诱导B细胞合成的特异性IgE抗体介导的免疫炎症反应(图1)。气道长期慢性炎症和高反应性,引起一系列咳嗽、气短、喘息等哮喘发作症状。而重症哮喘不同于轻-中度哮喘,它具有独特的炎症过程。在重症哮喘患者的气道内有更多的嗜中性粒细胞浸润、组织损伤及气道重塑。

图1支气管哮喘气道炎症反应[26,35]
1.气道炎症:重症哮喘的气道炎症具有异质性,存在不同的气道炎症表型[23]。Gibson等[24]通过诱导痰检查分析,成人哮喘气道炎性细胞表型可分为:①嗜酸粒细胞增多型:约50%的哮喘患者,尤其是在轻、中度哮喘患者中,持续气道嗜酸性粒细胞增多,表现为气道内以嗜酸性粒细胞浸润为主的变态反应性炎症。嗜酸性粒细胞增多被认为与CD4+Th2细胞释放IL-5有关,IL-5募集嗜酸性粒细胞到气道并活化,促进其生成。嗜酸性粒细胞释放半胱氨酸-1、白三烯、活性氧(reactive oxygen species, ROS),导致支气管收缩、黏液分泌增加。在此类型中伴有Th2细胞相关细胞因子表达增加,如IL-4、IL-13,诱导B细胞合成分泌IgE,发生一系列IgE介导的免疫-炎症反应[23]。然而在成人迟发性嗜酸性粒细胞增多的重症哮喘患者中,使用激素治疗后效果不佳,提示对激素反应不敏感,但使用抗IL-5单克隆抗体(mepolizumab)后有效,可能与嗜酸粒细胞凋亡功能缺陷,以及大量前炎性介质干扰激素抗炎作用有关[25];②中性粒细胞增多型:表现为气道内以中性粒细胞浸润为主,在重症哮喘患者中多见。AL-Ramli 等[26]发现重度哮喘患者气道内IL-17 表达水平增加, 而Zhao等[27]也发现在重度哮喘患者外周血中Thl7细胞水平增加,由此可见Th17细胞及其相关细胞因子IL-17参与了重症哮喘慢性炎症的病理过程。Th17细胞活化后产生IL-17,联合粒细胞刺激因子,诱导骨髓CD34+粒细胞,刺激中性粒细胞活化增生,募集至气道;同时,通过作用于气道上皮细胞,释放IL-8,抑制中性粒细胞凋亡、促进分化,使中性粒细胞数量增多。活化的中性粒细胞还可以产生多种细胞因子,如MMP-9、氧自由基、白三烯B4等产物,参与气道及肺组织的损伤过程。体外实验发现,IL-17能促进GR-β表达增加,竞争性抑制正常GR-α的抗炎作用,这或许可以解释此类型哮喘患者对激素不敏感的原因;③少炎症细胞型:表现为痰液内上述细胞均不增多,而以气道平滑肌的异常增生肥大为主要特征,其发生机制尚不清楚,可能与气道重塑导致的气道狭窄有关。值得肯定的是,无论患者气道内以何种类型细胞浸润为主,重症哮喘患者都存在着持续严重的、未被控制的气道炎症,这是导致哮喘难治的重要原因之一。
2.气道结构改变:传统上哮喘定义中包括可逆性气道受限,在实际中常发现哮喘患者气道并不完全可逆。通过胸部高分辨CT检查发现重症哮喘患者的气道壁厚度、气道壁面积与气道总截面积之比明显高于健康对照者,说明重症哮喘患者气道结构发生了不可逆的改变。气道长期慢性炎症反复发作,伴随各种炎症因子的释放,气道炎性“损伤-修复-再损伤-再修复”循环导致气道组织结构发生不可逆改变,进而形成重塑。气道重塑涉及多个方面,目前研究较多的特征性病理改变主要包括:上皮细胞的损伤与脱落,基底膜增厚,呼吸道平滑肌细胞增生和肥大,杯状细胞化生,黏液分泌增加,血管生成等。长期慢性炎症,导致气道上皮损伤,启动修复机制,释放活性生长因子,如表皮生长因子、血小板衍生生长因子、胰岛素样生长因子、成纤维生长因子等。这些生长因子可活化上皮下成纤维细胞,同时促进成纤维细胞增殖,胶原纤维大量增生,进而引起基底膜的增厚。TGF-β被认为是重症气道重塑发展过程中的关键细胞因子之一,参与上皮下纤维化及平滑肌细胞肥大的病理过程。研究发现重症哮喘患者呼吸道中上皮下细胞增生,能分泌大量的TGF-β,提示TGF-β参与了哮喘患者的气道重塑及肺功能损害。多种炎性细胞及结构细胞也能分泌TGF-β,如嗜酸性粒细胞、中性粒细胞、肺泡巨噬细胞及活化的上皮细胞。TGF-β不仅能活化纤维组织母细胞,促进胶原纤维增生,引起上皮下基底膜的增厚,还能与多种促炎性因子共同作用,促进上皮细胞间质转化,导致上皮下纤维化。有学者认为,能区分轻、重症哮喘最有价值的病理特征是在大气道标本中平滑肌细胞的数量和每个平滑肌细胞体积的改变。气道平滑肌细胞增生肥大,导致气道不可逆阻塞,FEV1不可逆下降,支气管扩张药物治疗的有效性也下降。
3. 激素反应性低:在吸入激素治疗效果不佳时,常需要使用口服激素治疗,但在重症哮喘治疗中,大剂量激素治疗并不能降低患者嗜酸性粒细胞数量,提高FEV1,提示这部分人群对激素反应性降低,而不是完全的激素抵抗。原发性激素反应性低为遗传因素所致,可能与激素受体基因或调控激素受体功能基因突变有关,从而导致某些细胞因子产生过多,如IL-4。过多产生的IL-4可通过降低低GR与配体的结合力而保持对激素的抵抗。此类型还伴有原发性糖皮质激素抵抗综合征的临床表现;继发性激素反应性低则是重症哮喘的机制之一。糖皮质激素(glucocorticoids, GCS)发挥抗炎作用的机制是(见图2):在分子水平上,GCS与其受体(GR)结合,受体构象改变,释放hsp90,形成GCS-GR复合体,与细胞核内靶基因启动子序列的GRE单元结合,促进抗炎细胞因子基因的转录,发挥抗炎作用。另一方面,GCS-GR复合体形成后,促进组蛋白去乙酰化酶2(histone deacetylase 2, HDAC2)对GR的脱乙酰作用,使之与NF-κB、AP-1结合,使这些炎症转录因子失去活性,抑制前炎性细胞因子的基因转录,通过减少炎性细胞因子而发挥抗炎作用。但在重症哮喘中,GCS与GR结合后核转运能力降低,与DNA亲和力降低。其可能的机制有:①GR-α活性降低。糖皮质激素受体有2种亚型:正常的GR-α和变异片段GR-β。当某些激酶活性改变,如 p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38MAPK)α、γ,c-Jun N-末端激酶1(JNK-1),导致正常的GR-α磷酸化,结构改变,形成的复合物核转运能力下降,与DNA亲和力降低;②GR-β受体过量表达,竞争性抑制正常的α受体活性。促炎因子如P38MAPK可增加激素β受体的表达;③HDAC2表达下降。HDAC2被认为参与GCS抑制介导炎症的细胞因子的基因转录过程。当HDAC2表达下降时,此过程受抑制,促炎性细胞因子基因转录增加,导致激素反应性下降。

图2 糖皮质激素抗炎作用机制[26]
四、重症哮喘的治疗
对于上述临床诊断确诊为哮喘,采用规范长期治疗,同时去除诱发因素,合理控制并存疾病后,仍不能达到理想控制目标的患者,应考虑采取进一步治疗措施[6]。
1. 药物治疗
(1)传统药物治疗:以上重症哮喘的定义揭示了这部分人群可能对传统的药物治疗不敏感。通常采取GINA推荐4~5级药物治疗方案,即成人吸入氟替卡松量>500 μg/d(或其等价剂量),联合吸入长效β2受体激动剂等两种或两种以上缓解药物(如白三烯受体拮抗剂、抗胆碱能药物、茶碱等)。但在成人重症哮喘患者中,约有30%患者应用上述方案不能完全控制症状,甚至需要采取口服或肌肉注射糖皮质激素治疗。需要口服激素治疗的最佳时机尚无统一标准。至于是多次间隔给予激素负荷量,还是持续小剂量口服激素治疗,以上哪种给药方式更有利于控制重症哮喘的急性发作,尚无临床比较结果。对于这类患者,获得有效的哮喘控制状态,常要以骨质疏松、糖尿病、高血压、胃肠道出血、易合并感染等严重的副作用为代价。2013年ERS/ATS关于重症哮喘指南中推荐,在成人重症哮喘中,可结合临床症状和痰嗜酸性粒细胞计数来调整用药,但痰嗜酸性粒细胞计数对大部分临床医生并不适用。同时,该指南不推荐根据FeNO水平调整药物用量[4]。
(2)抗感染治疗:上呼吸道感染,尤其是鼻病毒感染,容易诱发重症哮喘急性加重。研究发现,预防性使用大环内酯类抗生素如克拉霉素能减少气道内细胞因子释放,减轻气道非嗜酸粒细胞炎症,特别是中性粒细胞炎症。但2013年ERS/ATS重症哮喘指南中不推荐预防性使用大环内酯类抗生素,仅用于支气管炎、鼻窦炎或其他有指征的细菌感染。同时建议在合并过敏性支气管肺曲霉病(allergic bronchopulmonary aspergillosis, ABPA)时使用抗真菌药,而对于不伴ABPA的重度哮喘患者,无论其是否存在真菌致敏(如皮肤挑刺试验或血清真菌特异性IgE阳性),均建议不采用抗真菌药治疗[4]。
(3)不同哮喘表型的生物制剂治疗:重症哮喘是一种异质性疾病,具有不同的表型特点。针对不同的气道炎症表型特点,可进行相应的生物靶向治疗。这种治疗方式旨在通过抑制Th2或Th17介导的炎症反应环节中的某些细胞因子或趋化因子,发挥抗炎作用。表3总结了目前正在临床研究的靶向制剂。
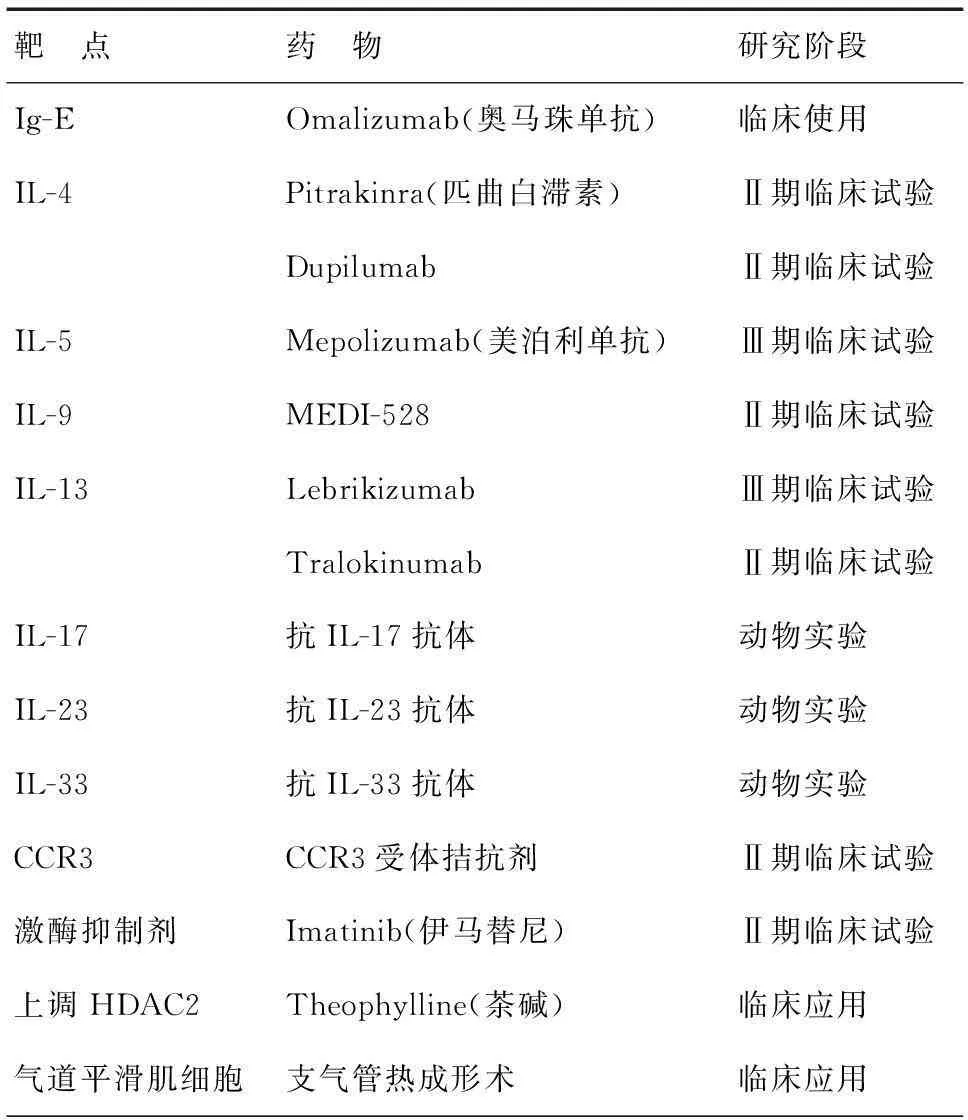
表3 重症哮喘靶向制剂[30]
(a)抗IgE单克隆抗体:Omalizumab 是自 2006 年起GINA 推荐作为治疗重症哮喘的靶向药物之一。通过阻断游离的IgE 与其效应细胞( 肥大细胞、嗜碱性粒细胞) 表面受体结合,但不会诱导相应效应细胞的脱颗粒反应,可以显著地改善哮喘急性发作症状,减少糖皮质激素使用量,减少哮喘急性加重和住院率。研究发现,在特应性、早发性、Th2细胞介导的重症哮喘患者中,气道中肥大细胞、嗜碱性粒细胞表面IgE受体高表达。当血清总IgE水平在30~700 IU/ml时,抗IgE单抗(omalizumab)能降低血清游离IgE水平,调节周围血嗜碱细胞的IgE受体,显著降低鼻部和支气管的嗜酸细胞、肥大细胞及T细胞和B细胞的数目,有效减少严重过敏性哮喘急性发作次数。2013年ERS/ATS对于重症哮喘治疗指南中推荐,变应性重症哮喘患者血清总IgE水平在30~700 IU/ml时可考虑试验性使用抗IgE单抗。但由于目前该药物价格较高,限制了其广泛应用[4]。
(b)抗IL-5单克隆抗体:IL-5 是由Th2 细胞分泌的细胞因子,参与调控嗜酸性粒细胞的分化、成熟、黏附、浸润、凋亡,并能够为嗜酸性粒细胞从骨髓迁移至肺部及其他器官提供重要的信号。Mepolizumab是一种实验性全人源化单克隆抗体,特异性靶向结合IL-5。其作用机制是:阻断IL-5与嗜酸性粒细胞表面受体的结合,抑制IL-5对受体的结合作用,降低血液、组织、痰液中的嗜酸性粒细胞水平,从而降低嗜酸性粒细胞所介导的炎症。近期的两项Ⅱ期临床试验观察结果显示,IL-5单克隆抗体可明显减少难治性嗜酸性粒细胞增多性哮喘患者的恶化频率。通过抑制IL-5可以阻止嗜酸性粒细胞成熟、分化及迁移到肺组织从而治疗哮喘 。目前mepolizumab还未获任何监管批准。
其他新型生物制剂,如抗TNFα单抗(Golimumab,Etanercept),抗IL2R单抗(Daclizumab),抗CXCR2单抗(SCH527123),抗IL-13单抗(Lebrikizumab,Tralokinumab),都是针对不同表型重症哮喘炎症反应机制,抑制相应的细胞因子释放,阻断炎症反应发生,达到有效减少哮喘急性发作。
2. 支气管热成型术(bronchial thermoplasty, BT): 是一种通过直接作用于气道平滑肌来治疗重症哮喘的新型治疗技术。该疗法使非急性发作期患者处于全麻或局麻状态下,通过支气管镜,向支气管壁释放能够消融平滑肌的射频热能,作用范围从主支气管到直径3~10 mm的远端支气管,通过促进细胞凋亡、坏死及自我吞噬作用,选择性地降低支气管平滑肌细胞数量,同时改变支气管上皮细胞、黏液腺、神经和微血管的特性来修饰气道炎症,从而降低支气管平滑肌收缩能力,降低气道高反应性。多项临床随机对照试验证实,使用支气管热成型术,能提高重症哮喘患者生活质量,降低急性发作次数和就诊率。2010年Castro等在美国哮喘干预研究(AIR)第 2 阶段临床试验中,进行了一项多中心、随机、双盲对照实验。参与研究的共有288例重症哮喘患者(吸入支气管扩张剂前FEV160%~85%预计值),其中190名在服用药物治疗同时接受了支气管热成型术治疗(BT组),对照组98例单纯使用大剂量吸入激素联合LABA治疗。BT组中 181 例,对照组中97例,完成了治疗后1年随访。在术后第 1年的时间里,BT组发生严重急性发作、急诊率、年不良事件等,较术前基线值及对照组有所下降,AQLQ评分,BT组增加1.35,对照组增加1.16。该研究说明,对于中重度持续性哮喘患者,加用BT介入治疗比单纯使用吸入激素联合LABA的安全性更好,并能明显缓解哮喘症状,改善气道高反应性,减少急性发作次数,改善生活质量。
3. 支气管肺泡灌洗术(bronchoavleolar lavage, BAL): 有研究者将常规治疗无效的61例支气管哮喘患者随机分成两组,对照组继续采用支气管舒张剂等常规治疗,支气管镜肺灌洗组在常规治疗基础上加用支气管肺泡灌洗术。治疗前及治疗后48 h观察两组患者的临床表现,检测FEV1、呼气峰流速(peak expiratory flow, PEF)等,选用改良英国 MRC呼吸困难指数(mMRC)进行病情评估。并对两组患者住院天数进行比较。结果显示,经支气管镜肺灌洗组显著优于对照组,且住院天数缩短。哮喘患者进行BAL,一方面可解除痰栓阻塞气道,清除气道内炎症细胞、炎性介质及过敏源,从而使气道的炎症反应得到改善,通畅气道;另一方面可以通过细胞分类了解气道炎症表型,有助于评估治疗反应和未来疾病风险,指导个体化治疗。但其长期有效性及安全性还有待于进一步研究。
总之,重症哮喘越来越被证明是一种异质性疾病,其发病机制是复杂的,在众多危险因素作用下,由多种细胞-细胞因子交织构成复杂的网络。重症哮喘的表型还需要更多的临床试验进一步证实。新的治疗手段,大多仍在研发和进一步临床验证中。确定其分类,明确潜在发病机制,开发出新型、有效的治疗方法,能改善预后、降低医疗成本,也成为目前研究的重点。
参考文献
1王长征. 改善支气管哮喘控制现状,需要重视患者的长期管理[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(4): 296-298.
2李喆, 莫琳芳, 任成山. 支气管哮喘药物治疗现状及进展[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(5): 571-573.
3Global strategy for asthma management and prevention. Global Initiative for Asthma (GINA) 2011. Available from www.ginasathma.org.
4Bousquet J, Mantzouranis E, Cruz AA, et al. Uniform definition of asthma severity,control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma[J]. J Allergy Clin. Immunol, 2010, 126(5): 926-938.
5Mishra A, Yao X, Levine SJ. From bedside to bench to clinic trials: identifying new treatments for severe asthma[J]. Dis Models Mech, 2013, 6(4): 877-888.
6Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma[J]. Eur Respir J, 2014, 43(2): 343-373.
7Bel EH, Sousa A, Fleming L, et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI)[J]. Thorax, 2011, 66(10): 910-917.
8中华医学会呼吸病学分会哮喘学组. 难治性哮喘诊断与处理专家共识[J]. 中华结核和呼吸杂志,2010, 33(8): 572-577.
9Guerra S, Graves PE, Morgan WJ, et al. Relation of beta2-adrenoceptor polymorphisms at codons 16 and 27 to persistence of asthma symptoms after the onset of puberty[J]. Chest, 2005, 128(2): 609-617.
10de Paiva AC, Marson FA, Ribeiro JD, et al. Asthma: Gln27Glu and Arg16Gly polymorphisms of the beta2-adrenergic receptor gene as risk factors[J]. Allergy Asthma Clin Immunol, 2014, 10(1): 8.
11Chanez P, Wenzel SE, Anderson GP, et al. Severe asthma in adults:what are the important questions[J]. J Allergy Clin Immunol, 2007, 119(6): 1337-1348.
12Kiljander TO, Junghard O, Beckman O, et al. Effect of esomeprazole 40 mg once or twice daily on asthma: a randomized, placebo-controlled study[J]. Am J Respir Crit Care Med, 2010, 181(10): 1042-1048.
13Lötvall J, Ekerljung L, Lundbäck B. Multi-symptom asthma is closely related to nasal blockage, rhinorrhea and symptoms of chronic rhinosinusitis-evidence from the West Sweden Asthma Study[J]. Respir Res, 2010, 11: 163.
14Ekerljung L, Bossios A, L tvall J, et al. Multi-symptom asthma as an indication of disease severity in epidemiology[J]. Eur Respir J, 2011, 38(4): 825-832.
15Forno E, Lescher R, Strunk R, et al. Decreased response to inhaled steroids in overweight and obese asthmatic children[J]. J Allergy Clin Immunol, 2011, 127(3): 741-749.
16Bruno A, Pace E, Cibella F, et al. Body mass index and comorbidities in adult severe asthmatics[J]. Biomed Res Int, 2014, ID: 607192.
17林江涛. 难治性哮喘的临床特征及发生的危险因素[J]. 实用临床医药杂志, 2009, 13(23): 11-14.
18Sandrock CE, Norris A. Infection in severe asthma exacerbations and critical asthma syndrome[J]. Clinic Rev Allerg Immunol, 2015, 48(1): 104-113.
19Willemse BW, ten Hacken NH, Rutgers B, et al. Smoking cessation improves both direct and indirect airway hyperresponsiveness in COPD[J] . Eur Respir J, 2004, 24 (3): 391-396 .
20Kobayashi Y, Bossley C, Gupta A, et al. Passive smoking impairs histone deacetylase-2 in children with severe asthma[J]. Chest, 2014, 145(2): 305-312.
21郭志宏, 杜永成, 许建英. 吸烟对支气管哮喘大鼠气道转化生长因子β1 mRNA和Ⅲ型胶原表达的影响[J]. 中华结核和呼吸杂志, 2008, 31(1): 42-45.
22王锐英, 杜永成, 许建英. 吸烟对致敏大鼠肺组织基质金属蛋白酶9及其抑制剂1表达的影响[J]. 国际呼吸杂志,2008, 28(16): 975-980.
23Porsbjerg CM, Gibson PG, Pretto JJ, et al. Relationship between airway pathophysiology and airway inflammation in older asthmatics[J]. Respirology, 2013, 18(7): 1128-1134.
24Gibson PG. Inflammatory phenotypes in adult asthma: clinical applications [J].Clin Respir J, 2009, 3(4): 198-206.
25Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial[J]. Lancet, 2012, 380(9842): 651-659.
26Al-Ramli W, Préfontaine D, Chouiali F, et al . T ( H ) 17-associated cytokinase ( IL-17A and IL-17F) in severe asthma[J]. J Al lergy Clin Immunol, 2009, 123(5): 1185-1187.
27Zhao Y, Yang J, Gao YD, et al . Th17 immunity in patients with allergic asthma[J]. Int Arch Allergy Immunol, 2010, 151(4): 297-307.
(本文编辑:黄红稷)
冯维,宋旸,李满祥. 成人重症哮喘发病机制及治疗的进展[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(4): 489-494.
·综述·
收稿日期:(2014-10-21)
文献标识码:中图法分类号: R562 A
通讯作者:李满祥,Email: manxiangli@hotmail.com
DOI:10.3877/cma.j.issn.1674-6902.2015.04.023

