乳腺癌髓系来源抑制细胞中吲哚胺2,3-双加氧酶表达与Tregs分布关系及临床意义*
黄亚琼, 赵庆丽, 张锋军, 顾丽萍
(中国人民解放军兰州军区总医院乳腺科, 甘肃 兰州 730050)
肿瘤的产生是多步骤、多因素参与的结果,其中肿瘤细胞使机体形成的免疫耐受在肿瘤的发生、发展中发挥着重要作用。正常组织细胞在发生恶性转变的过程中都会出现一些异常物质表达或正常物质表达量的改变,而在机体免疫功能正常的情况下这些异常物质会激活免疫相关的特异性T细胞[1],以清除这些发生恶性转化的细胞,维持内环境的稳态,防止肿瘤的发生。人体中几乎所有的肿瘤均存在相应的逃避免疫监视机制[2],因此研究肿瘤免疫耐受产生机制,对于肿瘤的免疫治疗、肿瘤预防有重大意义[3]。多项研究显示[4],髓系来源抑制细胞中吲哚胺2,3-双加氧酶(IDO)表达,可能参与肿瘤免疫耐受的形成,但对于髓系来源的抑制细胞是如何导致肿瘤免疫耐受产生的机制仍不甚了解。本研究分析肿瘤组织中免疫抑制细胞IDO表达与Foxp3+Tregs分布的关系,初步探索乳腺癌免疫耐受形成的相关可能机制。
1 材料与方法
1.1 实验材料:选取我院肿瘤乳腺外科2009年6月至2012年9月病例120例,术后经病理证实为原发性导管侵润癌,患者均为女性,年龄在30-64岁,平均48岁;绝经68例,未绝经52例;组织学分级:Ⅰ级24例,Ⅱ级50例,Ⅲ级46例;临床分期:Ⅰ期20例,Ⅱ期74例,Ⅲ期26例;手术取样,术前所有患者均未接受任何放疗及化疗治疗。
1.2 方 法
1.2.1 免疫组化单染SP法:将获得的乳腺癌标本石蜡包埋、切片。常规免疫组化染色,脱蜡后去除内源性过氧化物酶,冲洗后进行切片修复、暴露,依次滴加特异性一抗、二抗并孵育,最后在切片上滴加DAB显色并用苏木素复染。
1.2.2 免疫组化双染SP法:采用免疫组化双染技术,试剂来自美国 California Biotech Inc公司,对样本CD33+MDSCs中IDO表达情况进行检测,操作严格按照说明书进行。
1.2.3 免疫组化的结果评定:由两位经验丰富的病理科医生分别双盲阅片,在高倍镜(400*)下随机选取10个视野,每个视野计数100个细胞。按阳性细胞在所占细胞百分比计分:小于5%计0分;6%-25%计1分;26%-50%计2分;51%-75%计3分;大于75%计4分。规定0-2分为表达缺失,大于2分则为阳性表达。CD33定位于胞浆和胞核,Foxp3主要定位于胞核,如存在二者表达,则细胞呈现不同程度棕黄色。乳腺癌标本中,免疫组化双染阳性细胞均呈现为胞浆淡红色、胞核紫黑。CD33+MDSCs样本中IDO的表达情况统计,仍按上述统计标准记录。
1.3 统计学分析:采用统计学软件SPSS16.0进行统计分析,计数资料、率的比较采用χ2检验,检测水准设定为 0.05。
2 结果
2.1 乳腺癌癌组织中MDSCs IDO表达与临床病理之间的联系:癌组织中MDSCs IDO的表达与患者年龄、是否绝经、肿瘤大小和组织学分级无明显相关性(P>0.05),但与肿瘤是否出现转移有密切联系(P<0.05)。见表1。
2.2 乳腺癌中CD33+MDSCs IDO表达与Foxp3+调节性T细胞(Tregs)分布的关系:癌组织中CD33+MDSCs IDO表达的样本Foxp3+Tregs分布比例也较高,差别有统计学意义(P<0.05)。见表2。
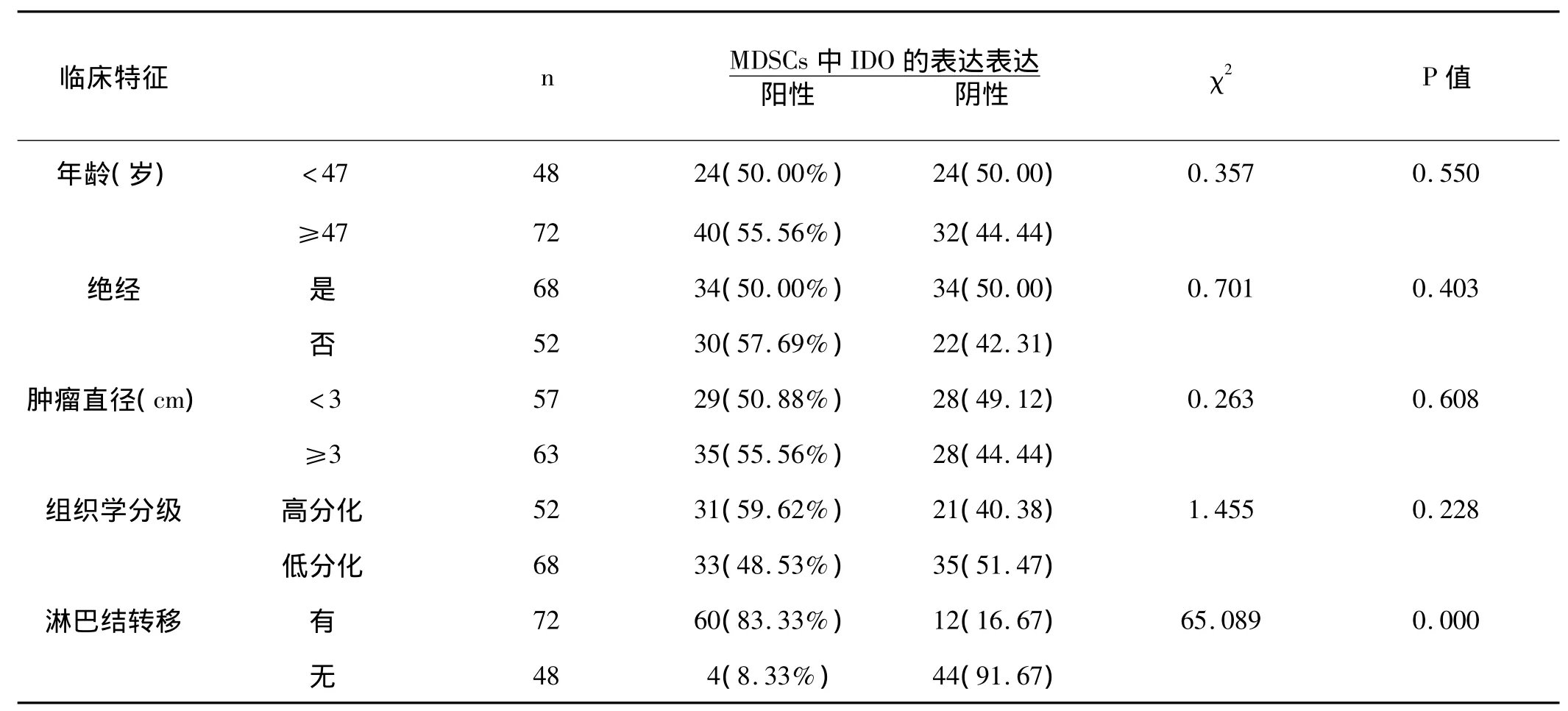
表1 乳腺癌中MDSCs中IDO表达与临床病理之间的联系 n(%)

表2 CD33+MDSCs IDO表达与Foxp3+Tregs分布之间的影响
3 讨论
肿瘤对正常机体来说是一种异物,必然会引起特异性免疫反应,对肿瘤细胞的生长产生抑制作用。但许多研究表明[5],在肿瘤发生后机体的免疫系统并不针对肿瘤产生特异性免疫反应清除肿瘤细胞,这表明患者机体对肿瘤存在产生了免疫耐受。本研究前期观察中我们发现,乳腺癌癌组织中CD33+MDSCs表达的IDO,能够促进肿瘤细胞出现免疫抑制,且其表达水平的高低跟乳腺癌患者预后密切相关[6,7]。肝癌的相关研究[8]中也发现IDO表达高低与肝癌的不良预后密切相关,推测其可以作为判断肝癌预后的指标之一。MDSCs细胞来源于骨髓中不同发育阶段的抗原呈递细胞,最早在老鼠体内发现[9],已有多项研究证明MDSCs能够促进肿瘤细胞免疫耐受的产生。
IDO是存在于细胞内的一种免疫抑制酶,专门由树突细胞及其他髓样细胞表达,能够降解特异性T细胞增值所必须的色氨酸,并生成一些具有细胞毒作用的中间产物,抑制机体免疫功能。前期研究表明,低浓度色氨酸会使特异性T细胞的增值留在G1期,防止特异性免疫反应激活,Inaba等在研究60例卵巢癌患者及体外小鼠肿瘤模型发现,加入IDO抑制剂1-甲基色氨酸后(1-MT)能明显抑制肿瘤细胞的生长。Nakanura等通过研究子宫颈癌患者病理标本后发现,表达IDO的癌细胞具有更强的侵袭能力。癌组织中CD33+MDSCs IDO的表达明显升高,这有利于降低癌组织局部色氨酸浓度,使机体对肿瘤细胞表达的相关抗原产生免疫耐受。这可能是肿瘤免疫耐受形成的重要机制之一。
本研究发现,Foxp3+Tregs高比例样本中 CD33+MDSCs IDO表达水平也明显升高,差别有统计学意义(P<0.05),表明癌组织中CD33+MDSCs IDO 表达,可能能够募集调节性T细胞Foxp3+Tregs进入癌组织,介导肿瘤免疫耐受的产生。研究结果还显示MDSCs中IDO表达水平在存在淋巴结转移的乳腺癌中比例明显升高(P<0.05),表明IDO的表达可能与乳腺癌的转移有关,这与国外研究腺病毒转移的IDO角化细胞侵蚀性明显增强相一致。阐明乳癌中MDSCs中IDO表达跟肿瘤耐受产生的分子生物学机制,有助于明确乳癌的发病机制,为免疫治疗、基因治疗提供必要的理论依据,对乳癌患者预后的监测都有重要意义。
[1] Schreiber RD,Old LJ,Smyth MJ.Cancer immunoediting:integrating immunity’s roles in cancer suppression and promotion[J].Science,2011,331(6024):1565-1570.
[2] 余宗林,李中琴.乳腺癌微转移的检测及临床意义[J].临床和实验医学杂志,2009,8(1):134-136.
[3] 陆作洁.首发为血液系统表现的骨髓转移癌39例分析[J].检验医学与临床,2013,10(7):841-842.
[4] Movahedi K,Guilliams M,Van den Bossche J,et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity[J].Blood,2008,111(8):4233-4244.
[5] Jessiea B.Katz,Alexander J.Muller,GeorgeC.Prendergast Indoleamine 2,3-dioxygenasein Teell toleranee and tumoral imrnunee sea[J].Immunologieal Reviews,2008,(222):206-221.
[6] Baban B,Chandler PR,Sharma MD,et al.IDO activates regulatory T cells and blocks their conversion into Th17-like T cells[J].Immunol,2009,183(4):2475-2483.
[7] Godin-Ethier J,Hanafi LA,Piccirillo CA,et al.Indoleamine 2,3-dioxygenase expression in human cancers:clinical and immunologic perspectives[J].Clin Cancer Res,2011,17(22):6985-6991.
[8] 杜华劲,张月君,周彩云,等.Ki-67和p53在三阴性乳腺癌中的表达和意义[J].中华全科医学,2013,11(9):1393-1395.
[9] Kusmartsev S,Su Z,Heiser A,et al.Reversal of myeloid cell-mediated immunosuppression in patients with metastatic renal cell carcinoma[J].Clin Cancer Res,2008,14(24):8270-8278.

