家族性腺瘤性息肉病伴发硬纤维瘤2例并文献复习
家族性腺瘤性息肉病伴发硬纤维瘤2例并文献复习
黄晋熙,王程虎,原伟伟,陈贝贝,周一※
(郑州大学附属肿瘤医院普外科,郑州 450003)
关键词:家族性腺瘤性息肉病;硬纤维瘤;大肠息肉基因
家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)是一种遗传性疾病,现阶段的主要治疗方法是手术,而硬纤维瘤是FAP患者的一种肠外病变。现收集郑州大学附属肿瘤医院收治的2例FAP合并硬纤维瘤患者的临床资料,结合有关文献探讨FAP合并硬纤维瘤的发生、发展、诊断以及治疗,现报道如下。
1临床资料
例1,男,李某,31岁,因“大便带血3个月余”于2009年8月就诊。患者既往无腹部手术史。入院后行纤维肠镜检查发现,全大肠息肉近百枚,直肠肛管处有一巨大溃疡,活组织检查提示为腺癌。考虑为“FAP恶变”。追问其家族史,其母因结肠癌去世。完善术前准备后行“全大肠切除术+回肠造瘘术”。术中发现空肠系膜有一巨大肿物,因侵犯肠系膜根部血管,考虑切除后短肠综合征可能性大,因此未予切除,仅行活组织检查,提示侵袭性纤维瘤。患者手术顺利,术后恢复
良好,术后病理分期:pT4aN0M0。随访4年,腹腔硬纤维瘤缓慢生长(图1),患者无明显临床症状,目前给予环加氧酶2抑制剂治疗。术后建议患者直系家属行肠镜检查,其四姐妹均未发现结肠息肉,但其弟发现多发肠息肉(图2),但因经济原因当时未予治疗。
例2,男,李某,28岁,例1患者的弟弟,因“大便带血4个月余”于2012年12月入院。患者既往无腹部手术病史。入院后行结肠镜及活组织检查提示:直肠肛管癌合并多发性结肠息肉(镜下见数千枚息肉)。CT提示腹腔内实性占位,下段直肠肠壁增厚。考虑FAP合并硬纤维瘤,遂行手术探查,并行“全大肠切除术+回肠造瘘术+肠系膜肿瘤切除术”治疗。术后病理证实为“FAP(pT4aN0M0)并硬纤维瘤”,见图3~5。患者术后恢复良好,给予氟尿嘧啶类方案化疗并口服环加氧酶2抑制剂维持治疗,随访无临床症状。术后患者行大肠息肉基因(adenomatous polyposis gene,APC)分析,基因测序显示患者为外显子12的1605~1606 TG缺失的移码突变(图6)。
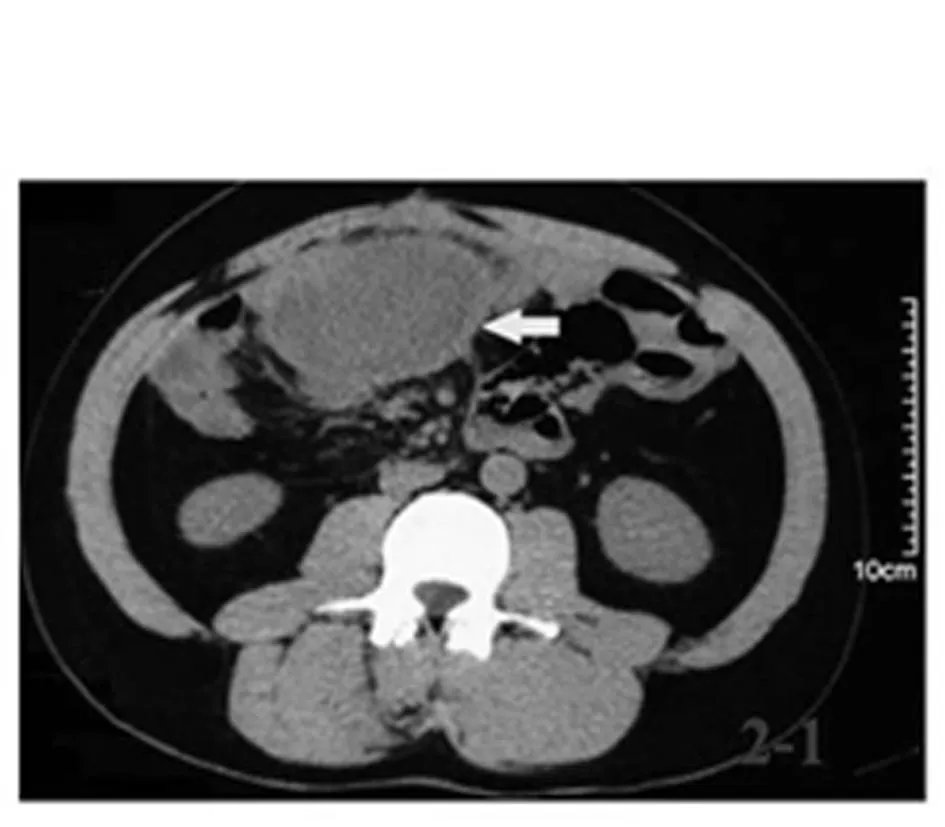
图1 例1家族性腺瘤性息肉 病患者伴硬纤维瘤CT 图像腹腔硬纤维瘤 侵犯小肠系膜

图2 家族性腺瘤性息肉病患者伴硬纤维瘤患者家系系谱图

图3 例2家族性腺瘤性 息肉病患者伴硬纤维 瘤患者CT图像提示 腹腔硬纤维瘤侵犯 小肠系膜

图4 例2家族性腺瘤性息肉病患者伴硬纤维瘤患者,术中切除的部分肛管直肠及小肠系膜硬纤维瘤大体标本

图5例2家族性腺瘤性息肉病患者伴硬纤维瘤患者,小肠系膜硬纤维瘤病理切片,可见大量胶原纤维细胞形成,部分可见梭形纤维细胞,其间可见血管增生5a.HE×40; 5b.HE×100

图6例2家族性腺瘤性息肉病患者伴硬纤维瘤患者APC基因分析6a.例2患者的APC基因分析图; 6b.野生型对照图
2讨论
2.1流行病学及概述FAP是一种常染色体显性遗传性疾病,2009年欧盟国家报道的FAP的发病率为3/10万~10/10万,且年轻男女的患病比例基本相同[1]。FAP的典型过程是患者在20岁左右时发现结肠和直肠上出现数百至数千个腺瘤,如果诊断和治疗不及时几乎所有的患者都会发展成结直肠癌[2]。约50%典型FAP患者会在15岁时发生结肠腺瘤,约95%患者在35岁时发生结肠腺瘤[3]。
除了结直肠的腺瘤,胃底、十二指肠、壶腹部及小肠也会发生腺瘤性病变,其中胃底和小肠的腺瘤发生癌变的概率较低,但十二指肠与壶腹部的腺瘤发生癌变的概率为5%,较正常人高出数百倍[4-7]。
FAP患者一般都会有一些肠外表现,如骨瘤、皮肤疾病、牙齿异常、先天性视网膜色素上皮肥厚、硬纤维瘤及其他肠外脏器的恶性肿瘤(如甲状腺、肝脏、胆管及中枢神经系统的肿瘤)[2]。另一种轻表型FAP(attenuated FAP,AFAP)结肠内息肉数量较少(通常>10个,但<100个),且腺瘤出现的年龄(平均44岁)及恶变时间(平均56岁)较典型FAP患者晚[8]。
硬纤维瘤是一种罕见的良性肿瘤,其在人群中的发病率为0.03%,但FAP患者发生硬纤维瘤的危险系数是正常人的825倍,发病率为10%~20%,男女比例为1∶1.4,可发生于任何年龄段,最常见于20~40岁[9-10]。约81.5%的患者在确诊FAP后又发生硬纤维瘤,仅7%的患者FAP与硬纤维瘤同时发生[10]。本研究的两例患者为同一家系,结直肠内均见大量腺瘤,发病年龄在30岁左右,为典型的FAP患者,其结肠外表现为同时发生的腹腔内小肠系膜硬纤维瘤。患者的母亲也是FAP患者,但因去世多年,无法查证是否同时合并硬纤维瘤。同一家族多例患者同时合并FAP与硬纤维瘤,在国内外均属罕见。
2.2病因学APC基因是位于第5号常染色体长臂q21内的抑癌基因,是含有15个外显子的编码区,编码的蛋白主要是调节细胞的黏附、信号转导及转录,是Wnt通路的重要分子,在结直肠肿瘤的发生、发展中起重要作用[11]。目前认为,APC基因的突变导致了FAP的发生。突变的类型主要是无义突变,其导致了截短蛋白的形成,引起了染色体不稳或错配修复功能缺失,最终导致结直肠癌的发生。密集型FAP的APC基因突变多位于中心区域(1284~1580密码子间),又称突变密集区[12],而AFAP的APC基因突变一般位于4、5、9及15号外显子的3′端[13]。
非FAP患者的硬纤维瘤是因为β联蛋白的突变,而FAP患者的硬纤维瘤是APC基因的突变,其突变位点一般位于1309~1580密码子[14]。FAP患者发生硬纤维瘤的危险因素包括生育期女性、妊娠、口服避孕药[15]、手术史和家族史等。Bertario等[16]发现,APC基因1444~1578密码子的突变更易导致硬纤维瘤发生。本研究两例患者都为男性,表现为家族聚集性,其基因突变是位于12外显子1605~1606的移码突变。
2.3临床表现与诊断大部分硬纤维瘤发生于腹部,且多位于腹腔内(小肠系膜多见),但也可以发生于腹壁(如瘢痕),约10%的患者可发生在腹外器官[17-18]。虽然硬纤维瘤在病理学上表现为良性,几乎不出现远处转移,但其呈浸润性生长,可侵及邻近脏器。根据所在部位,硬纤维瘤可无任何临床表现或表现为疼痛或胃肠道症状,特别是发生在系膜的硬纤维瘤,可引起肠梗阻、输尿管梗阻、小肠缺血、脓肿形成、甚至小肠穿孔或小肠瘘等[19]。对于腹腔外的硬纤维瘤,可用细针穿刺细胞学诊断,而腹腔内的病变可在多普勒超声或CT引导下细针穿刺诊断。当CT或MRI发现有FAP家族史或手术史的患者出现进行性增长的实性肿瘤,排除恶性肿瘤复发后,应考虑硬纤维瘤。
2.4治疗有研究报道,有5%~10%的硬纤维瘤可自发缓解消失,30%出现缓解与发展交替,50%诊断后无变化,只有10%会持续生长并浸润其他器官[18,20]。因此,只有当硬纤维瘤引起症状、对周围组织有浸润风险或影响美观的情况下才需要治疗[19]。
由于大部分对于硬纤维瘤的研究都是基于与FAP相关或散发病例,因此现阶段暂无有效控制硬纤维瘤的方法[21]。对于腹壁或腹外的硬纤维瘤,手术治疗可作为一线方案[18],术后可给予辅助放疗[22];而对于腹腔内的硬纤维瘤,舒林酸(非甾体类消炎药)和(或)选择性雌激素受体抑制剂(如他莫昔芬或托瑞米芬)是一线治疗方案[10,21]。对于有临床症状但手术无法切除或其他治疗方法无效但呈浸润性生长的硬纤维瘤,细胞毒药物化疗药物,如阿霉素加卡铂[23]或阿霉素+达卡他嗪[24]也是可以选择的方案。对于腹腔内的硬纤维瘤,因高复发及死亡风险,手术并不是一线治疗方案,但对于药物治疗失败且有临床症状的患者手术仍为可选择的治疗方法之一[25]。
2.5监测虽然未对FAP患者行硬纤维瘤监测形成共识,但因筛查的普及而导致FAP患者结直肠癌的病死率降低及硬纤维瘤发生率升高,进行腹腔CT或MRI扫描还是有必要的,特别是对于突变位点在密码子1444~1578或有硬纤维瘤家族史的患者[19]。此外,对于存在硬纤维瘤高危因素的高龄患者来说,是否需要手术治疗或采用什么类型的手术需要慎重考虑[26-27]。
3小结
对于大部分的FAP患者,硬纤维瘤多发生在手术后,同时合并FAP和腹腔硬纤维瘤的较少见,因而国内外暂无统一治疗意见。本研究例1患者虽未行腹腔硬纤维瘤切除,但至今仍无明显临床症状,正常生存;例2患者虽行硬纤维瘤切除,术后也未发生明显的并发症,但术中发生并发症的风险及术后复发风险均较高,是否将术中手术切除硬纤维瘤视为标准治疗方案还有待商榷。
参考文献
[1]Church JM,Xhaja X,Warrier SK,etal.Desmoid tumors do not prevent proctectomy following abdominal colectomy and ileorectal anastomosis in patients with familial adenomatous polyposis[J].Dis Colon Rectum,2014,57(3):343-347.
[2]Half E,Bercovich D,Rozen P.Familial adenomatous polyposis[J].Orphanet J Rare Dis,2009,4(6):22.
[3]Ngamruengphong S,Boardman LA,Heigh RI,etal.Gastric adenomas in familial adenomatous polyposis are common,but subtle,and have a benign course[J].Hered Cancer Clin Pract,2014,12(1):4.
[4]Bianchi LK,Burke CA,Bennett AE,etal.Fundic gland polyp dysplasia is common in familial adenomatous polyposis[J].Clin Gastroenterol Hepatol,2008,6(2):180-185.
[5]Tajika M,Niwa Y,Bhatia V,etal.Risk of ileal pouch neoplasms in patients with familial adenomatous polyposis[J].World J Gastroenterol,2013,19(40):6774-6783.
[6]Groves CJ,Saunders BP,Spigelman AD,etal.Duodenal cancer in patients with familial adenomatous polyposis (FAP):results of a 10 year prospective study[J].Gut,2002,50(5):636-641.
[7]Aihara H,Kumar N,Thompson CC.Diagnosis,surveillance,and treatment strategies for familial adenomatous polyposis:rationale and update[J].Eur J Gastroenterol Hepatol,2014,26(3):255-262.
[8]Plawski A,Banasiewicz T,Borun P,etal.Familial adenomatous polyposis of the colon[J].Hered Cancer Clin Pract,2013,11(1):15.
[9]Church J,Lynch C,Neary P,etal.A desmoid tumor-staging system separates patients with intra-abdominal,familial adenomatous polyposis-associated desmoid disease by behavior and prognosis[J].Dis Colon Rectum,2008,51(6):897-901.
[10]Knudsen AL,Bülow S.Desmoidtumour in familial adenomatous polyposis.A review of literature[J].Fam Cancer,2001,1(2):111-1119.
[11]Groden J,Thliveris A,Samowitz W,etal.Identification andcharacterization of the familial adenomatous polyposis coli gene[J].Cell,1991,66(3):589-600.
[12]Zhang J,Cao H,Zhang B,etal.Berberine potently attenuates intestinal polyps growth in ApcMin mice and familial adenomatous polyposis patients through inhibition of Wnt signalling[J].J Cell Mol Med,2013,17(11):1484-1493.
[13]Laurent S,Franchimont D,Coppens JP,etal.Familial adenomatous polyposis:clinical presentation,detection and surveillance[J].Acta Gastroenterol Belg,2011,74(3):415-420.
[14]Bertario L,Russo A,Sala P,etal.Multiple approach to the exploration of genotype-phenotype correlations in familial adenomatous polyposis[J].J Clin Oncol,2003,21(9):1698-1707.
[15]Lazar AJ,Tuvin D,Hajibashi S,etal.Specific mutations inthe beta-catenin gene ( CTNNB1) correlate with local recurrence inspo-radic desmoid tumors[J].Am J Pathol,2008,173(5):1518-1527.
[16]Bertario L,Russo A,Sala P,etal.Genotype and phenotype factors as determinants of desmoid tumors in patients with familial adenomatous polyposis[J].Int J Cancer,2001,95(2):102-107.
[17]Li M,Gerber DA,Koruda M,etal.Hepatocelluar carcinoma associated with attenuated familial adenomatous polyposis:a case report and review of the literature[J].Clin Colorectal Cancer,2012,11(1):77-81.
[18]Claes E,Renson M,Delespesse A,etal.Psychological implications of living with familial adenomatous polyposis[J].Acta Gastroenterol Belg,2011,74(3):438-444.
[19]Lahat G,Nachmany I,Itzkowitz E,etal.Surgery for sporadic abdominal desmoid tumor:is low/no recurrence an achievable goal?[J].Isr Med Assoc J,2009,11(7):398-402.
[20]Barrow P,Khan M,Lalloo F,etal.Systematic review of the impact of registration and screening on colorectal cancer incidence and mortality in familial adenomatous polyposis and Lynch syndrome[J].Br J Surg,2013,100(13):1719-1731.
[21]Sturt NJ,Phillips RK,Clark SK.High-dose tamoxifen and sulindac as first-line treatment for desmoid tumors.[J]Cancer,2004,101(3):652.
[22]Bülow S,Sφndergaard JO,Moesgaard F.Familial adenomatous polyposis[J].Ugeskr Laeger,1990,152(37):2628-2632.
[23]Garbay D,Le Cesne A,Penel N,etal.Chemotherapy in patients with desmoid tumors:a study fromthe French Sarcoma Group (FSG)[J].Ann Oncol,2012,23(6):182-186.
[24]Kim B,Giardiello FM.Chemoprevention in familial adenomatous polyposis[J].Best Pract Res Clin Gastroenterol,2011,25(4/5):607-622.
[25]Middleton SB,Phillips RK.Surgery for large intra-abdominal desmoid tumors:report of four cases[J].Dis Colon Rectum,2000,43(12):1759-1762.
[26]Heinrich MC,McArthur GA,Demetri GD,etal.Clinical and molecular studies of theeffect of imatinib on advanced aggressive fibromatosis (desmoid tumor)[J].J Clin Oncology,2006,24(7):1195-1203.
[27]Tudyka VN,Clark SK.Surgical treatment in familial adenomatous polyposis[J].Ann Gastroen terol,2012,25(3):201-206.
《医学综述》杂志被美国化学文摘社收录
美国化学文摘社(CAS)是全球最大、最全面的化学和科学信息数据库提供机构,是美国化学学会(ACS)的分支机构。美国《化学文摘》是涉及学科领域最广、权威性最高、影响力最大、实用性最强、收集文献类型最全、提供检索途径最多、部卷也最为庞大的一种著名的世界性检索工具。
《医学综述》杂志接到美国化学文摘社(CAS)中国文献处理中心通知,经过严格评估,本刊被列入美国化学文摘社2012年中国期刊收录名单,进入国际著名文摘数据库。由此,标志着本刊办刊水平和学术地位得到了国际化学文献检索权威机构的认可。这是广大作者和全体编审人员的荣耀,是亿万读者的福音,也是我们跨出了与国际交流的第一步,实现了成为国际权威数据库来源期刊的工作目标。
《医学综述》欢迎您阅读,欢迎您赐稿,欢迎您指导。
Familial Adenomatous Polyposis Superimposed Desmoid Tumor:A Report of Two Cases and Review of the LiteraturesHUANGJin-xi,WANGCheng-hu,YUANWei-wei,CHENBei-bei,ZHOUYi.(DepartmentofGeneralSurgery,theCancerHospitalAffiliatedofZhengzhouUniversity,Zhengzhou450003,China)
Key words:Familial adenomatous polyposis; Desmoid tumor; Colorectal polyposis gene
收稿日期:2014-12-27修回日期:2015-07-02编辑:辛欣
doi:10.3969/j.issn.1006-2084.2015.20.073
中图分类号:R735.3
文献标识码:A
文章编号:1006-2084(2015)20-3839-03

