猪源肺炎克雷伯菌的分离鉴定
林星宇,王 印,2*,杨泽晓,姚学萍,胡 凌,彭善珍,陈 平,邬旭龙
(1.四川农业大学 动物医学学院,四川 雅安 625014;2.动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
肺炎克雷伯菌(Klebsiella Pneumoniae,Kpn)为革兰氏阴性菌,属于肠杆科克雷伯菌属,能够导致人畜发病的机会致病菌[1]。该菌可以引起肺炎、脑膜炎、肝脓肿、眼内炎、泌尿系统发炎,伤口感染和全身败血症等,发病死亡率极高[2]。近年来Kpn 耐药性普遍存在,而且多为多重抗药性,给临床治疗造成困难。
2014 年5 月,四川某猪场发生疫情,发病猪主要表现为呼吸道症状,本研究通过病理剖检、细菌分离培养、生化鉴定、药敏试验、小鼠致病性试验及16S rRNA 基因的扩增测序,证明分离菌株为具有多重耐药,培养特性发生改变,而且为毒力较强的Kpn 肺炎亚种。
1 材料和方法
1.1 病料样品、实验动物及主要试剂 临床样品采集自四川省某猪场病死猪;健康小鼠(体质量约20 g)购自四川大学华西实验动物中心;营养琼脂培养基、麦康凯琼脂培养基、药敏纸片及微量生化反应管均购自杭州微生物试剂有限公司;2×Taq PCR MasterMix、DNA 分子量标准、凝胶回收试剂盒等均购自天根生化科技(北京)有限公司。
1.2 分离培养 无菌采集病理剖检有典型病理变化的猪肺脏样品,经姬姆萨染色镜检肺脏组织中带菌情况,接种于营养琼脂培养基进行分离纯化培养;然后接种于麦康凯培养基,37 ℃恒温培养18 h~24 h,同时进行厌氧培养。并用5 %的兔鲜血平板鉴定其溶血性。
对各培养条件下细菌菌落进行观察,将分离株纯培养物革兰氏染色镜鉴,观察细菌的个体形态及染色特征。
1.3 理化鉴定 将上述纯培养得到的细菌接种于普通LB 中培养24 h,按常规方法进行细菌生化试验。
1.4 分子生物学鉴定 参照文献[3]合成细菌16S rRNA 基因通用引物16 SF(5'-AGAGTTTGATCCTGG CTCAG-3')/16 SR(5'-GGTTACCTTGTTACGACT-3'),由上海生工生物工程技术服务有限公司合成。以纯培养细菌染色体DNA 为模板,扩增16S rRNA 基因片段。PCR 反应条件为94 ℃5 min;94 ℃45 s、55 ℃30 s、72 ℃、30 s,30 个循环;72 ℃10 min。PCR产物经10 g/L 的琼脂糖凝胶电泳检测,并纯化回收目的片段由华大基因测序。
1.5 小鼠致病性试验 纯化菌株在普通培养基培养24 h 后,以无菌生理盐水冲洗菌苔,采用麦氏比浊法测定菌液浓度后稀释至1×108cfu/mL。将8 只小鼠随机分为两组,每组4 只,腹腔注射菌液测定其致病力(0.2 mL/只),对照组注射生理盐水(0.2 mL/只)。
1.6 药敏试验 采用纸片扩散法进行药敏试验,按抑菌圈直径大小和各抗菌药的具体标准评定为高度敏感、中度敏感和不敏感。
2 结果
2.1 病理剖检结果 对病死猪进行剖检可见肺脏出血水肿,机体其他组织器官和体表无明显肉眼可见的病变。肺脏组织触片后经姬姆萨染色镜检,可见组织中有大量的卵圆形、球杆状的菌体单个、成对或呈链状排列。
2.2 细菌的分离培养及形态学观察 无菌操作取病死猪肺脏组织接种于营养琼脂培养基,经分纯培养显示为半透明、灰白色、圆凸、闪光、表面湿润的光滑型菌落,拉动成丝线状。在麦康凯平板发现形成隆起大而黏液样、易融合的橙黄色菌落,边缘有时为粉红色(图1A);并且先为红色菌落,后变为橙黄色菌落,与以往分离的Kpn 也有差异[4-7],表明该分离菌代谢机制与以往Kpn 分离菌有所不同。血平板上形成较大、圆凸、灰白色的菌落,并呈现α 溶血现象。在光学显微镜下可见该菌为革兰氏阴性杆菌,呈卵圆形或球杆状,单个或成双排列(图1B)。
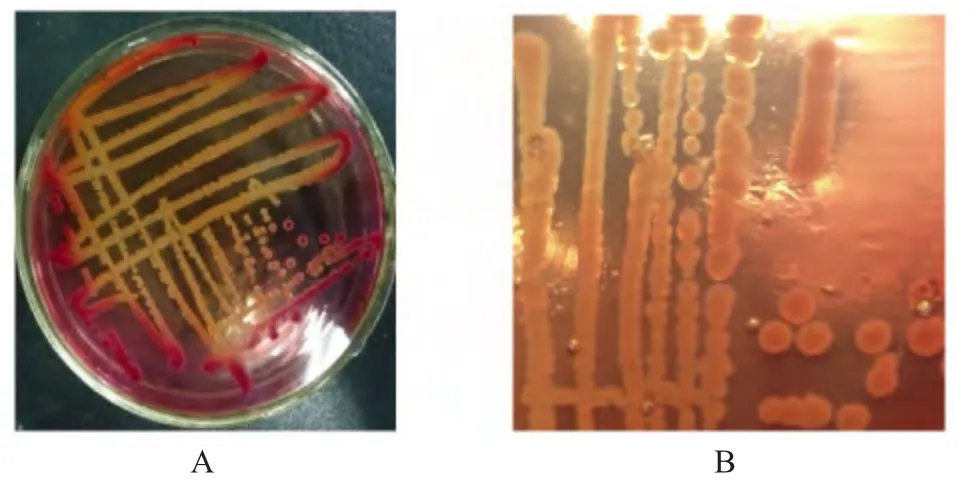
图1 分离菌株在麦康凯和血平板培养结果Fig.1 Cultivation results of isolated bacterial strains on MacConkey and blood agar
2.3 细菌的理化鉴定 以无菌生理盐水冲洗菌苔,将菌液接种于生化管中进行生化鉴定,结果详见表1。培养特性结果显示,该菌为兼性厌氧发酵型无运动能力的G-杆菌。根据以上实验结果,参考文献[8-9],表明该分离菌株为Kpn 肺炎亚种。
2.4 分离株的16S rRNA扩增及测序鉴定结果 琼脂糖凝胶电泳检测16S rRNA 的扩增片段约1 500 bp,与预期目的片段大小一致(图2)。将纯化回收的目的片段测序结果经BLAST 分析比对显示该菌株16S rRNA 基因部分序列与肺炎克雷伯菌同源性达99 %(KM272989),确定该分离菌株为Kpn。

表1 分离菌的生理生化特性Table 1 Physiological and biochemical characteristics test of the isolate

图2 分离菌株16S rRNA 序列PCR 扩增Fig.2 Amplification of 16S rRNA from the isolate by PCR
2.5 小鼠致病性试验 人工感染组小鼠于接种6 h后,开始表现神经症状,在接种后24 h 内全部死亡。剖检小鼠组织病变表现为肝脏肿胀、边缘淤血,脾脏肿大,肺脏充血水肿,对照组无发病或死亡。剖检后取内脏器官按前述方法进行细菌分离,并通过生化试验和16S rRNA PCR 法鉴定,结果与猪肺脏中分离到的Kpn 一致。
2.6 药敏试验结果 药敏试验结果见表2,分离株对庆大霉素、丁胺卡那和头孢唑肟高度敏感,而对头孢哌酮、哌拉西林、阿莫西林+克拉维酸、四环素、环丙沙星、复方新诺明等19 种常用药物耐受,表明该分离菌株为多重耐药菌株。
3 讨论
本研究分离得到的Kpn 菌株在血平板上呈现α溶血现象,而以往分离的Kpn 尚无溶血活性的报道,本实验分离的Kpn 菌株这一特性可能与其对小鼠具有较强致病性相关。经分析有3 种可能性:第一种可能性是该菌发生基因突变,使得有关溶血方面的基因得到表达;第二种可能性是溶血素基因的水平转移,并在Kpn 中得到表达,因有报道表明α溶血素分泌系统基因在革兰氏阴性杆菌间存在基因传递潜能[10-11];第三种可能性是该菌分泌的代谢产物使得血细胞破碎。其确切的溶血原因,还有待进一步研究。

表2 药敏试验结果Table 2 Drug sensitivity tests results
在分离培养的过程中本研究发现该菌在麦康凯培养基上菌落颜色先红色,后橙黄色,分析可能是因为该菌代谢较快,先利用乳糖为碳源产生酸性物质,当乳糖被消耗完后,该菌又利用这些酸性产物作为碳源,并且该菌通过脱羧作用等分泌一些碱性物质,从而使培养基pH 值由酸性变为碱性,所以眼观菌落表现为由红色变为橙黄色。
药敏试验结果显示该菌株对氨基糖苷类抗生素敏感,利用庆大霉素等药物对发病猪场进行防治后,疫情得到了控制。本实验结果显示其对青霉素类、青霉素类与β-内酰胺酶抑制剂的复合制、部分头孢类、喹诺酮类、四环素类、磺胺类等抗生素耐药,该菌具有多重耐药性。该菌株对青霉素类及青霉素类与β-内酰胺酶抑制剂的复合制剂不敏感,且对部分头孢类抗生素低程度耐药,提示其可能含有耐酶抑制剂β-内酰胺酶[12-13]。同时该菌对供试的喹诺酮类抗生素耐药,提示其gyrA 和parC 基因可能已经发生变异[14]。
本研究从猪肺脏分离得到的Kpn 菌株不仅在培养特性上发生改变,而且具有较强的致病性及多重耐药性,以上结果为Kpn 耐药机制和致病机理的相关研究提供了科学依据。
[1]Brisse S,Duijkeren v.Identification and antimicrobial susceptibility of 100 Klebsiella animal clinical isolates[J].Vet Microbiol,2005,105(3):307-312.
[2]Hooi S H,Hooi S T.Culture-proven bacterial general hospital[J].Med J Malaysia,2005,60(5):614-623.
[3]Greisen K,Loeffelholz M,Purohit A,et al.PCR primers and probes for the 16S rRNA gene of most species of pathogenic bacteria,including bacteria found in cerebrospinal fluid[J].J Clin Microbiol,1994,32(2):335-351.
[4]胡本钢,杜崇涛,雷连成,等.貂源肺炎克雷伯菌的分离及鉴定[J].中国预防兽医学报,2011,33(8):598-600.
[5]荣光,赵军明,侯冠彧,等.五指山猪肺炎克雷伯菌肺炎亚种的分离及鉴定[J].西北农业学报,2012,20(10):1-5.
[6]王印,熊焰,徐志文.梅花鹿肺炎克雷伯氏菌的分离鉴定[J].中国兽医杂志,2009,(4):70-71.
[7]马磊,颜其贵,万莉,等.竹鼠肺炎克雷伯氏菌的分离鉴定[J].中国人兽共患病学报,2011,27(9):825-827.
[8]布坎南.伯杰细菌鉴定手册,第八版[M].科学出版社,1984.
[9]陆承平.兽医微生物学[M].中国农业出版社,2007.
[10]Noegel A,Rdest U,Goebel W,et al.Determination of the functions of hemolytic plasmid pHly152 of Escherichia coli[J].J Bacteriol,1981,145(1):233-247.
[11]Müller D,Hughes C,Goebel W,et al.Relationship between plasmid and chromosomal hemolysin determinants of Escherichia coli[J].J Bacteriol,1983,153(2):846-851.
[12]Pérez-Moreno M O,Pérez-Moreno M,Carulla M,et al.Mechanisms of reduced susceptibility to amoxycillin-clavulanic acid in Escherichia coli strains from the health region of Tortosa(Catalonia,Spain)[J].Clin Microbiol Infect,2004,10(3):234-241.
[13]Lemozy J,Sirot D,Chanal C,et al.First characterization of inhibitor-resistant TEM(IRT)beta-lactamases in Klebsiella pneumoniae strains[J].Antimicrob Agents Chemother,1995,39(11):2580-2582.
[14]高山,普珍,孙晓明,等.肺炎克雷伯杆菌对氟喹诺酮类抗生素耐药机制的研究[J].华西药学杂志,2006,21(1):21-24.

