大鼠GAD65 基因慢病毒载体的构建及其在MSCs 中的表达
赵元淑,邓 镇,陈 丽,周玉波,马 猛,罗亚楠,胡景鑫,雷水生,朱晓琴
GAD65 是脑内GABA(γ-aminobutyric acid,GABA)合成的限速酶。GABA 是哺乳动物脑内重要的抑制性神经递质[1],在正常机体内GABA 和兴奋性神经递质谷氨酸(glutamic acid,Glu)的量在脑内保持相对平衡,当神经元损伤GAD65 含量降低时脑内GABA 浓度降低可以引起癫痫的发生。目前细胞移植法已经成为癫痫疗法的研究热点,研究表明将GAD65 基因通过细胞移植的方法导入脑内可以有效抑制癫痫的发生[2,3],但是这些研究中使用的种子细胞如神经干细胞、神经前体细胞等由于取材不方便、涉及伦理等问题,限制了其在实验和临床中的应用,因此选择一种理想的种子细胞是细胞移植的根本。骨髓MSCs 在体内外具有很强的增殖能力和多分化潜能[4,5],是一种理想的种子细胞,为了探讨GAD65 基因修饰的MSCs 移植对癫痫的作用,本实验拟通过基因重组技术构建GAD65 的慢病毒载体并感染MSCs,为进一步研究细胞移植后GAD65 基因在脑内的表达及对癫痫的治疗效果奠定基础。
1 材料和方法
1.1 材料和试剂 大肠杆菌DH5α、293 T 细胞、pCDNA3.1-GAD65 质粒由本实验室保存;LV5-GFP 及包装质粒由广州医科大学药理实验室惠赠;NotI、Eco31I、DNA 连接酶购于Fermentas 公司;DNA凝胶回收试剂盒购于天根生化科技有限公司;Lipofectamin2000、Opti-MEM 购于Invitrogen 公司;胎牛血清、低糖DMEM、胰酶购于Gibco;一抗购于Abcam,二抗购于北京中杉金桥。
1.2 方法
1.2.1 LV5-GAD65 慢病毒载体的构建与鉴定PCR 扩增pCDNA3.1-GAD65 中的GAD65 基因片段,根据Genbank 中GAD65(NM_012563.1)的序列设计引物,上下游引物分别加上NotI 和Eco31I 及保护碱基。上游引物5’GATATGCGGCCGCATGGCATCTCCGGGCTCTGGCTTTTGG 3’,下游引物5’CTATCGGTCTCGGATCCTTACAAATCTTGTCCCAGGCGTTC 3’扩增片段为1758 bp。PCR 条件为:95℃3 min;94 ℃30 s;55 ℃30 s;72 ℃30 s;30 个循环72 ℃5 min。利用Agarose 电泳并切胶回收目的片段。酶切、电泳,用DNA 凝胶回收试剂盒回收GAD65 基因片段和载体LV5。用T4 DNA ligase 连接GAD65 基因片段和线性化的载体。小量抽提质粒,送上海英骏生物技术公司测序。
1.2.2 慢病毒的包装与滴度测定 转染前1 d,将293 T 细胞接种于15 cm 平皿中,37 ℃5%CO2培养过夜。取1.5 ml Opti-MEM,加入100 μl 的含有穿梭质粒和包装质粒的(pGag/pol、pRev、pVSVG、LV5-GFP-GAD65)慢病毒;另取1.5 ml Opti-MEM,加入300 μl Lip2000;将上述两种液体混合,室温放置20 min。用上述混合液转染平皿中的细胞,6 h 后吸除转染液。72 h 收集细胞上清液,离心过滤后分装,-80 ℃冰箱保存。
将293 T 细胞以3×104浓度接种于96 孔板,各孔加入不同浓度梯度的病毒液100 μl(10-1、10-2、10-3、10-4、10-5),以LV5-GFP 作为对照组,37 ℃5% CO2培养24 h。72 h 后通过荧光显微镜计算荧光数,并根据公式TU/μl=(GFP 阳性细胞率×转染细胞数/100×每孔加入病毒稀释液体积)×1/稀释因子计算出病毒液滴度。
1.2.3 慢病毒感染MSCs 转染前1 d,将对数期生长的MSCs 以5×103接种于96 孔板中,将待转染细胞分3 组:A 组:LV5-GFP-GAD65 转染组;B组:空质粒转染组;C 组:未转染组。次日,将病毒液以MOI 200 感染细胞,并加入终浓度5 μg/ml 的Polybrene 增加转染率(B 组以同样方法转染空质粒LV5-GFP,C 组不转染)。24 h 后换液,48 h 观察转染细胞荧光表达情况。通过嘌呤霉素筛选得到稳定扩大培养后进行实验指标检测。
1.2.4 Western blot 检测感染后GAD65 蛋白的表达 取病毒感染后2 w 的MSCs,加入裂解液提蛋白,BCA 法测蛋白浓度。取40 μl 蛋白上样行丙烯酰胺凝胶电泳,将蛋白转到PVDF 膜上,5%脱脂奶粉封闭1 h,一抗(稀释至1:2000)4 ℃封闭过夜,加入二抗(稀释至1:5000)室温孵育1 h,ECL 曝光显色。
1.3 统计学处理 采用SPSS13.0 统计软件对各数据进行分析,统计数据用±s 表示。各组间数据比较采用单因素方差分析(ANOVA),组间两两比较采用LSD 检验,检验水准为α=0.05。
2 结果
2.1 LV5-GFP-GAD65 慢病毒载体的构建与鉴定 构建成功的LV5-GAD65 慢病毒载体经限制性内切酶NotI 和Eco31I 酶切电泳鉴定结果(见图1)显示:扩增出大小为1 758 bp 的GAD65 基因片段,和大小为9 337 bp 的LV5 基因片段。测序结果(见图2)显示与Genbank 中GAD65(NM_012563.1)的序列完全一致,无读码框移。LV5-GAD65 慢病毒载体构建成功。
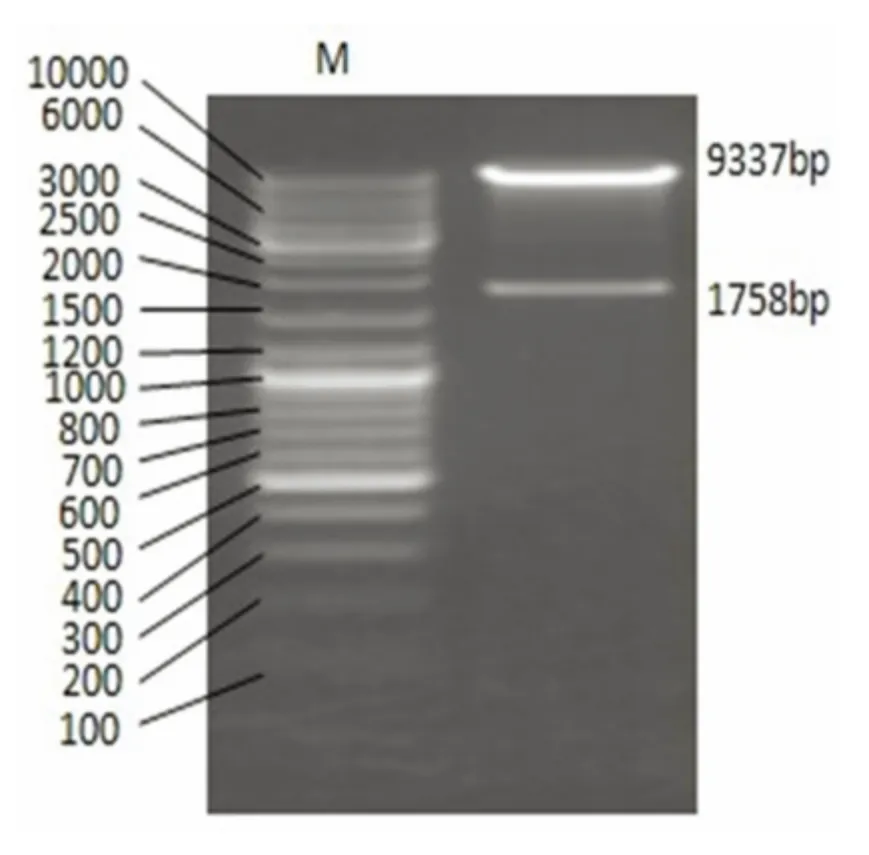
图1 重组质粒酶切鉴定

图2 重组质粒LV5-GFP-GAD65 部分测序图
2.2 慢病毒包装与滴度测定 慢病毒4 种质粒共转染293 T 细胞后,72 h 观察细胞荧光表达。构建的质粒能够成功感染293 T 细胞。根据病毒滴度计算公式计算出浓缩后LV5-GAD65 慢病毒病毒液滴度为5×107TU/ml,空质粒LV5 的滴度为7×107TU/ml,能够满足实验对病毒液滴度的要求。
2.3 慢病毒感染MSCs 病毒液以MOI 300 感染大鼠MSCs,24 h 换液后荧光不是很明亮,感染72 h后荧光显微镜下可以观察到明亮的绿色荧光,感染率达到90%以上(见图3)。

图3 A:LV5-GFP-GAD65 感染MSCs,可见光;B:LV5-GFPGAD65 感染MSCs,荧光
2.4 Western blot 检测MSCs 中GAD65 蛋白的表达 提取病毒液感染后的各组MSCs 的蛋白,行Western blot 检测,结果显示(见图4):LV5-GFPGAD65 转染组过表达GAD65 蛋白,而LV5-GFP 空质粒转染组、未转染组未检测到GAD65 蛋白表达。说明包装浓缩的病毒液感染间充质细胞后,能够稳定过表达GAD65 蛋白。
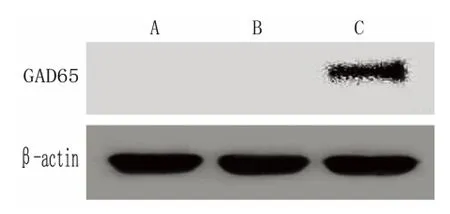
图4 Western blot 检测MSCs 中GAD65 的表达
3 讨论
颞叶癫痫是目前最难治疗的癫痫类型之一,主要表现为海马硬化,抑制癫痫发作的GABA 能神经元数量大幅度减少,导致脑内神经递质失衡从而引起癫痫的发生[6~8]。细胞移植作为癫痫的替代疗法因其应用安全有效越来越受到重视。骨髓MSCs 是一种来源于骨髓的非造血前体细胞,由于其具有向非间充质细胞谱系如神经细胞、神经胶质细胞、少突胶质细胞等分化的多向分化的能力而成为治疗神经损伤的理想种子细胞[9];移植MSCs 可以用于治疗脊髓损伤、癫痫等疾病[10,11],但是由于MSCs 在脑内分化成为神经元需要大概3 w 的时间[12,13],而GAD65 基因修饰的MSCs 可以在短时间内产生高浓度的GABA[14],因此移植GAD65 基因修饰的MSCs是治疗癫痫的理想选择。
GAD65 cDNA 全长1758 bp,编码585 个氨基酸,GAD65 在脑组织内主要位于神经轴突末梢,合成突触释放的GABA。本实验对GAD65 基因进行扩增测序,结果与Genbank 中序列完全一致,无碱基突变和读码框移。将DNA 导入真核细胞的方式有两种:瞬时转染与稳定转染:瞬时转染中,转染的DNA 不必整合到宿主染色体,转染的基因会随着细胞的增殖逐渐丢失;稳定转染是将转染的目的基因整合到染色体DNA 中,从而建立克隆的细胞系[15]。研究基因化细胞移植对癫痫的疗效则需要GAD65 基因在MSCs 中长期稳定的表达。慢病毒载体是细胞稳定转染的理想载体。慢病毒载体来源于人类免疫缺陷病毒-1(HIV-1)一种基因转移载体,因其具有可感染分裂及非分裂细胞、转移基因片段容量大、目的基因表达时间长、不易引起免疫反应等优点被广为应用[16~18]。因此,将长为1758 bp 的GAD65 基因稳定转入MSCs,并建立稳定转染的细胞系选用慢病毒作为载体是非常合适的。本实验应用的慢病毒载体是以国际通用的第3 代载体系统为基础,通过改建构成的四质粒系统,慢病毒载体删除了全部HIV-1 的编码基因,应用安全稳定。用包装产生的高滴度的病毒液感染MSCs,感染效率高,感染率大于90%,通过嘌呤霉素筛选扩大培养后得到稳定表达GAD65基因的细胞株。
本实验构建了GAD65 慢病毒表达载体,经酶切、测序鉴定,证实慢病毒载体构建成功。包装产生的病毒液浓度为5×107TU/ml。将病毒液感染大鼠MSCs。Western blot 检测显示蛋白表达显著升高。本实验成功构建GAD65 慢病毒表达载体,并可以在MSCs 中正确过表达,为进一步研究基因化细胞治疗癫痫奠定基础。
[1]Lindefors N.Dopaminergic regμlation of glutamic acid decarboxylase mRNA expression and GABA release in the striatum:a review[J].Prog Neuropsychopharmacol Biol Psychiatry,1993,17(6):887-903.
[2]Thompson KW,Suchomelova LM.Transplants of cells engineered to produce GABA suppress spontaneous seizures[J].Epilepsia,2004,45(1):4-12.
[3]Thompson KW.Genetically engineered cells with regulatable GABA production can affect afterdischarges and behavioral seizures after transplantation into the dentate gyrus[J].Neuroscience,2005,133(4):1029-1037.
[4]Phinney DG.Building a consensus regarding the nature and origin of mesenchymal stem cells[J].J Cell Biochem Suppl,2002,38:7-12.
[5]Jackson WM,Nesti LJ,Tuan RS.Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells[J].Expert Opin Biol Ther,2010,10(4):505-517.
[6]Wilson CL,Maidment NT,Shomer MH,et al.Comparison of seizure related amino acid release in human epileptic hippocampus versus a chronic,kainate rat model of hippocampal epilepsy[J].Epilepsy Res,1996,26(1):245-254.
[7]Simantov R,Crispino M,Hoe W,et al.Changes in expression of neuronal and glial glutamate transporters in rat hippocampus following kainate-induced seizure activity[J].Brain Res Mol Brain Res,1999,65(1):112-123.
[8]Friedman LK,Pellegrini GDE,Sperber EF,et al.Kainate-induced status epilepticus alters glutamate and GABAA receptor gene expression in adult rat hippocampus:an in situ hybridization study[J].J Neurosci,1994,14(5 Pt 1):2697-2707.
[9]李禄全,余加林,官晓清,等.鼠骨髓间充质干细胞在缺氧缺血性脑病新生鼠脑内的分布及分化[J].第三军医大学学报,2005,(4):327-330.
[10]Uccelli A,Prockop DJ.Why should mesenchymal stem cells(MSCs)cure autoimmune diseases[J]?Curr Opin Immunol,2010,22(6):768-774.
[11]Voulgari KA,Fairless R,Karamita M,et al.Mesenchymal stem cells protect CNS neurons against glutamate excitotoxicity by inhibiting glutamate receptor expression and function[J].Exp Neurol,2012,236(1):161-170.
[12]Long Q,Qiu B,Liu W,et al.Functional recovery and neuronal regeneration of a rat model of epilepsy by transplantation of Hes1-down regulated bone marrow stromal cells[J].Neuroscience,2012,212:214-224.
[13]Abdanipour A,Tiraihi T,Mirnajafi ZJ.Improvement of the pilocarpine epilepsy model in rat using bone marrow stromal cell therapy[J].Neurol Res,2011,33(6):625-632.
[14]Castillo CG,Mendoza TS,Aguilar MB,et al.Intranigral transplants of a GABAergic cell line produce long-term alleviation of established motor seizures[J].Behav Brain Res,2008,193(1):17-27.
[15]Sambrook J,Russell WD.分子克隆实验指南[M].北京:科学出版社,2002.1272.
[16]褚 波,黄雪峰,唐云明.慢病毒载体及其应用进展[J].生物医学工程学杂志,2008,(1):224-226.
[17]王淑艳,张 愚.慢病毒载体的设计及应用进展[J].中国生物工程杂志,2006,(11):70-75.
[18]杨 馨,胡应和.慢病毒载体介导的RNA 干扰[J].细胞生物学杂志,2006,(4):497-500.
——一道江苏高考题的奥秘解读和拓展

