耐甲氧西林金黄色葡萄球菌MecA基因的实时荧光定量PCR方法学评价*
欧红玲,陈凤华,王 岩,张巧云,王欣茹
(第二炮兵总医院检验科,北京 100088)
·论 著·
耐甲氧西林金黄色葡萄球菌MecA基因的实时荧光定量PCR方法学评价*
欧红玲,陈凤华,王 岩,张巧云,王欣茹△
(第二炮兵总医院检验科,北京 100088)
目的 评估实时荧光定量聚合酶链反应(FQ-PCR)检测临床标本中耐甲氧西林金黄色葡萄球菌(MRSA)MecA耐药基因的价值。方法 选择该院2013年6~12月125份临床标本,包括血液40份,痰液52份,创面分泌物33份进行FQ-PCR检测和细菌鉴定,分析结果符合率,以检测FQ-PCR的灵敏度及特异性。结果 FQ-PCR的灵敏度为0.159 pg/μL,检测经细菌培养鉴定的菌株,特异性达到100%,与临床标本结果符合率为97.6%。结论 FQ-PCR检测MRSA的MecA基因更加方便、快速,且灵敏度和特异性等性能指标均比较理想,与细菌鉴定结果符合率较高,适合临床广泛应用。
耐甲氧西林金黄色葡萄球菌; MecA基因; 实时荧光定量聚合酶链反应; 微生物鉴定
耐甲氧西林金黄色葡萄球菌(MRSA)感染的流行是一个严重的临床医学及公共卫生问题。自1961年首次发现MRSA以来[1],MRSA分离率逐年增高,已成为医院感染重要的革兰阳性细菌。MecA基因在MRSA耐药中起决定性作用,MecA基因与MRSA有很强的相关性,是判断MRSA的“金标准”。美国临床和实验室标准化协会(CLSI)推荐用于MRSA耐药的检测方法有纸片扩散法和琼脂筛选法、肉汤和琼脂稀释法。这些检测方法耗时长,均需要在33~35 ℃条件下孵育24 h[2-5]。本文旨在对实时荧光定量聚合酶链反应(FQ-PCR)检测MecA基因进行方法学评价,并评价其与微生物鉴定的复合率,为临床更好地应用提供实验依据。
1 材料与方法
1.1 菌株来源 收集本院2013年6~12月临床标本125份,其中痰液52份,血液40份,创面分泌物33份。痰液标本均为晨痰,咳痰前先用清水反复漱口,用力咳出呼吸道深部痰液,直接吐入无菌痰盒。共分离菌株39株,其中MRSA 21株,非MRSA 18株(包括其他葡萄球菌属、肠球菌属、链球菌属以及革兰阴性菌等)。
1.2 细菌复苏 将-80 ℃低温保存的菌种置于室温下解冻,按无菌操作原则将菌种转入无菌肉汤中复苏增菌,放置于37 ℃孵育箱18~24 h后转种到血平皿37 ℃孵育18~24 h,长出单个菌落备用。
1.3 细菌鉴定和药敏分析 用Vitek Compact全自动微生物鉴定仪进行细菌鉴定。用头孢西丁纸片扩散法检测MRSA菌株,实验操作和判断标准均参照2013年CLSI文件标准[5]。将金黄色葡萄球菌用无菌生理盐水配制成0.5麦氏浊度单位的菌悬液,无菌棉签蘸取菌液均匀涂布于M-H琼脂表面,将每片30 g头孢西丁纸片贴于其上,36 ℃温育16~18 h后测量抑菌环直径。结果判断:抑菌环直径小于或等于21 mm为耐药。
1.4 主要仪器和试剂 FQ-PCR仪(SLAN-96P),高速离心机(Thermo Pico17),干式恒温仪(GL-1800,海门其林贝尔仪器制造公司),MRSA耐药基因检测试剂盒(FQ-PCR法,上海之江生物科技有限公司),TIANamp Bacteria DNA Kit 细菌基因组DNA提取试剂盒(离心柱型)。
1.5 FQ-PCR扩增
1.5.1 模板的制备 临床标本模版DNA的制备。(1)痰液。取痰液加入4倍体积的4%NaOH,摇匀,室温下放置30 min液化,取0.5 mL样品至1.5 mL离心管中,再加入0.5 mL 4%NaOH室温放置10 min后13 000 r/min离心5 min。沉淀加无菌生理盐水1 mL打匀,13 000 r/min离心5 min;再重复洗涤1次。弃上清液,沉淀中直接加入50 μL DNA提取液充分混匀,沸水浴10 min(误差不超过1 min)。13 000 r/min离心5 min,取上清4 μL做PCR。(2)血液。取2 mL抗凝血,静置待自然分层,吸取上层(血浆层)及中层(Buffy coat层),13 000 r/min离心5 min,弃上清液,沉淀中直接加入100 μL DNA提取液充分混匀,沸水浴10 min。13 000 r/min离心5 min,取上清4 μL做PCR。(3)创面分泌物。标本中加入无菌生理盐水1 mL,13 000 r/min离心2 min,弃上清液,沉淀中直接加入100 μL DNA提取液充分混匀,沸水浴10 min。13 000 r/min离心5 min,取上清液4 μL做PCR。临床菌株模版DNA的制备,按TIANGEN TIANamp Bacteria DNA Kit 细菌基因组DNA提取试剂盒(离心柱型)提取细菌DNA,对于较难破壁的革兰阳性菌,加入溶菌酶进行破壁后,再按说明书进行DNA提取。
1.5.2 PCR扩增 (1)FQ-PCR:按照MRSA耐药基因检测试剂盒说明书配成40 μL反应体系:金黄色葡萄球菌核酸FQ-PCR检测混合液35.6 μL,酶(Taq+UNG)0.4 μL,模板4 μL。参数设置:37 ℃变性2 min;94 ℃ 2 min;循环1次,再按93 ℃ 15 s,60 ℃ 60 s,循环40次;单点荧光检测在60 ℃,反应体系40 μL。该试剂盒可同时检测标本中Nuc基因和MecA基因。其中Nuc基因为金黄色葡萄球菌的特异性基因。(2)普通PCR法:反应体系25 μL,参数设置:94 ℃ 3 min;再按94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s循环40次;72 ℃ 5 min。琼脂糖凝胶电泳分析扩增产物。
1.5.3 MRSA FQ-PCR实验结果判断 见表1。
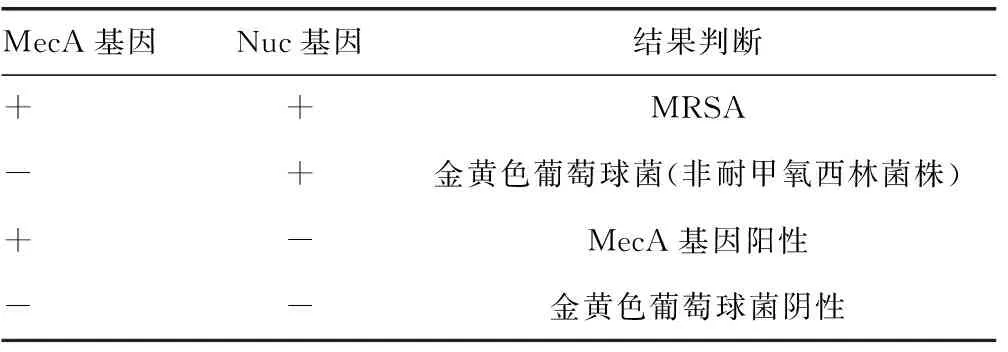
表1 MRSA FQ-PCR不同实验结果判断
注:+表示阳性,-表示阴性。
1.5.4 结果判断 对125份临床标本同时进行FQ-PCR、普通PCR检测和微生物鉴定,统计3种方法的符合率。
2 结 果
2.1 灵敏度 将Vitek Compact全自动微生物鉴定仪鉴定的MRSA临床菌株,进行细菌DNA提取,模版DNA用去离子水10倍比例稀释成15.9 ng/μL、1.59 ng/μL、159 pg/μL、15.9 pg/μL、1.59 pg/μL、0.159 pg/μL、0.015 9 pg/μL系列浓度。结果表明,FQ-PCR的灵敏度为0.159 pg/μL,普通PCR的灵敏度为15.9 pg/μL,FQ-PCR比普通PCR灵敏度高100倍(图1和图2)。
2.2 特异性 21株Vitek Compact全自动微生物鉴定仪鉴定的MRSA菌株经FQ-PCR检测均为阳性,18株经鉴定的非MRSA菌株经FQ-PCR检测为阴性,其中嗜麦芽假单胞菌和表皮葡萄球菌检测到MecA基因,但Nuc基因均为阴性,所以均判定为阴性。结果表明,FQ-PCR检测MRSA特异性为100%。见表2。

1为15.9 ng/μL;2为1.59 ng/μL;3为159 pg/μL;4为15.9 pg/μL;5为1.59 pg/μL;6为0.159 pg/μL;7为0.015 9 pg/μL。
图1 普通PCR MecA基因检测结果
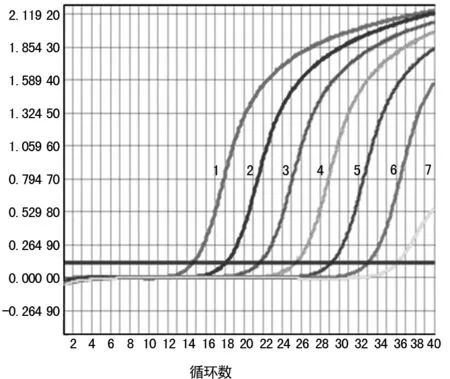
1为15.9 ng/μL;2为1.59 ng/μL;3为159 pg/μL;4为15.9 pg/μL;5为1.59 pg/μL;6为0.159 pg/μL;7为0.015 9 pg/μL。

图2 FQ-PCR MecA基因检测结果表2 39株细菌的MecA基因FQ-PCR检测结果
注:+表示阳性,-表示阴性。
2.3 重复性 对提取的15.9 ng/μL和1.59 pg/μL高低两种浓度的MRSA菌株DNA模板进行重复性扩增实验,测定结果进行分析。15.9 ng/μL和1.59 pg/μL平均循环阈值(Ct)和变异系数(CV)分别为14.65和29.20、1.39%和2.97%,CV均小于5.00%,显示具有良好的重复性。
2.4 临床标本结果分析
2.4.1 40份血液标本经FQ-PCR和微生物鉴定,其中2份为MRSA;1份MecA基因阳性,Nuc基因阴性,结果判断为MecA基因携带者。与微生物鉴定符合率100%。
2.4.2 52份痰液经FQ-PCR、普通PCR和细菌鉴定,检出阳性标本结果相符的共36份,阴性结果相符的14份;其中2份FQ-PCR和普通PCR检出MecA基因及Nuc基因阴性,而微生物鉴定均为阳性;1份FQ-PCR MRSA阳性,而普通PCR和微生物鉴定为阴性,与微生物鉴定符合率94%。
2.4.3 33份创面分泌物,检出阳性标本结果相符的共4份,阴性结果相符的29份。与微生物鉴定符合率100%。
3 讨 论
MRSA是引起医院相关性和社区相关性感染的重要致病菌之一,自发现以来,其分离率不断上升,已成为医院相关性感染最重要的革兰阳性菌。近年来世界各地不断报道危及生命的社区获得性MRSA感染,防治形势极为严峻。MRSA对抗菌药物的耐药性日趋严重,且对多种抗菌药物耐药,因此MRSA 引起的医院感染一旦发生,常难以控制。随着MRSA分离率的不断上升,快速、准确、及时检测MRSA对临床选用合适的抗菌药物及控制MRSA传播均具有重要意义[6]。MecA基因在MRSA耐药中起决定性作用,它编码的青霉素结合蛋白2a(PBP2a)与β内酰胺类抗菌药物的亲和力极低,使抗菌药物不能阻碍细胞壁肽聚糖层合成,从而产生耐药性[7]。因此,MecA基因已作为MRSA的分子学标志[8]。
目前,MRSA的检测临床最常用的是纸片扩散法、琼脂筛选法、肉汤和琼脂稀释法。这些检测方法耗时长,均需要在33~35 ℃条件下孵育24 h,易受孵育温度、时间、培养基质量、菌液数量等多种因素的影响[9]。而PCR方法直接检测细菌染色体上的MecA基因,不受药敏实验条件的影响,特异性高,从核酸提取到荧光检测仅需3~4 h,为临床医生的快速诊治提供了更为有效的手段。本研究FQ-PCR的最低检测下限为0.159 pg/μL,灵敏度较普通PCR(15.9 pg/μL)高100倍,特异性达到100%,并对高低两个浓度重复检测的CV均小于5.00%,显示具有良好的重复性,检测性能满足临床检测的需要。
本实验采用FQ-PCR检测2份耐甲氧西林凝固酶阴性葡萄球菌,结果显示:Nuc基因阴性、MecA基因阳性。与Nuc基因是金黄色葡萄球菌特有基因、MecA基因是耐甲氧西林葡萄球菌分子学标志的结论一致。本实验采用临床标本直接进行FQ-PCR法检测。2份临床标本FQ-PCR法和普通PCR检测MecA基因阴性,Nuc基因为阴性的痰液,而微生物鉴定为MRSA阳性。分析其原因可能为:(1)使用 4%NaOH液化标本后,未充分洗涤干净,pH过高可抑制PCR,造成假阴性结果;(2)在标本洗涤、冻存、提取 DNA模板过程中,原始标本中的 MRSA菌水平极低,不能有效提取到 MRSA的DNA模板,造成FQ-PCR结果的假阴性。1份痰液标本FQ-PCR检测MecA基因阳性,Nuc基因为阳性,而微生物鉴定为阴性。分析其原因可能为:痰培养受培养基的成分、细菌接种量、培养时间和培养温度的影响,以及受抗菌药物的抑制,而痰液中细菌分布不均一及培养室仅用标本的极少部分,都可能影响微生物培养法MRSA的检出率。另外,FQ-PCR法检测21份MRSA菌株与细菌培养鉴定的符合率为100%,说明直接用MRSA菌株进行FQ-PCR 检测,实验的准确度明显提高。
综上所述,FQ-PCR法的灵敏度高、特异性强,检测方便、简单、快捷,可以在标本接收后2~3 h内出结果,可迅速对临床治疗做出积极的引导,并可以满足医院感染防控24 h内检测患者入院时是否携带MRSA的要求。
[1]Matouskova I,Janout V.Current knowledge of methicillin-resistant Staphylococcus aureus and community-associated methicillin-resistant Staphylococcus aureus[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008,152(2):191-202.
[2]Liu C,Bayer A,Cosgrove SE,et al.Clinical practice guidelines by the infectious diseases society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children[J].Clin Infect Dis,2011,52(3):18-55.
[3]施瑜.耐甲氧西林葡萄球菌检测方法评价[J].检验医学与临床,2008,5(24):1517-1518.[4]Sturenburg E.Rapid detection of methicillin-resistant Staphylococcus aureus directly from Clinical samples:methods,effectiveness and cost considerations[Z],2009.
[5]Clinical Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twenty-third informational supplement.M100-S23[S].Wayne,PA,USA:CLSI,2013.
[6]Balakuntla J,Prabhakara S,Arakere G.Novel rearrangements in the staphylococcal cassette chromosome mec type V elements of Indian ST772 and ST672 methicillin risistant staphylococcus aureus strains[J].PloS One,2014,9(4):e94293-e94295.
[7]徐伟红,徐斌.耐甲氧西林金黄色葡萄球菌SCCmec基因检测及耐药性分析[J].国际检验医学杂志,2013,34(12):37-39.
[8]郝崇华,万艳红,裴世静,等.耐甲氧西林金黄色葡萄球菌实验室诊断方法[J].中国药物与临床,2013,13(9):1174-1176.
[9]牟晓峰,赵自云.实时荧光定量PCR检测耐甲氧西林金黄色葡萄球菌方法的建立与应用评价[J].中华医院感染学杂志,2011,21(19):4185-4187.
Evaluation of FQ-PCR method for detecting methicillin-resistant Staphylococcus aureus MecA gene*
OUHong-ling,CHENFeng-hua,WANGYan,ZHANGQiao-yun,WANGXin-ru△
(DepartmentofClinicalLaboratory,GeneralHospitaloftheSecondArtillery,Beijing100088,China)
Objective To evaluate the reliability of fluorescent quantitative polymerase chain reaction (FQ-PCR) method for detecting methicillin-resistant Staphylococcus aureus(MRSA) MecA resistant gene.Methods A total of 125 clinical specimens were collected from June 2013 to December 2013,including 40 blood specimens,52 sputum specimens,33 specimens of wound secretions.FQ-PCR method and bacteria identification were used to detect all the specimens,and then analyze the consistent rate of results,sensitivity and specifity.Results The sensitivity of FQ-PCR method was 0.159 pg/μL,the specificity of FQ-PCR in detecting bacterial strain cultured and identified was100%,and the consistent rate with the results of clinical samples was 97.6%.Conclusion FQ-PCR method is more convenient,fast in detecting MecA gene of MRSA,and sensitivity,specificity are ideal,the consistent rate with bacterial identification result is high,so could be used widely in clinical applications.
methicillin-resistant Staphylococcus aureus; MecA gene; fluorescent quantitative polymerase chain reaction; bacterial identification
全军十二五面上课题(CWS11J205)。
欧红玲,女,硕士,主管技师,主要从事分子生物学研究。△
,E-mail:wangxinru@126.com。
10.3969/j.issn.1672-9455.2015.04.002
A
1672-9455(2015)04-0436-03
2014-10-11
2014-12-10)

