单环刺螠中肠和后肠交替氧化酶对硫化物的应激反应❋
任志强, 张立涛, 刘晓龙, 刘建国, 张志峰
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛 266003)
单环刺螠中肠和后肠交替氧化酶对硫化物的应激反应❋
任志强, 张立涛, 刘晓龙, 刘建国, 张志峰❋❋
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛 266003)
外源性硫化物可通过抑制或阻断线粒体电子传递经典途径而对生物体产生损伤甚至致死,交替氧化酶(Alternative Oxidase,AOX)是线粒体硫化物氧化电子传递分支途径中的1个关键酶。为了研究硫化物环境中单环刺螠的生存对策,本文利用间接竞争性ELISA和酶活性分析等技术检测了单环刺螠在硫化物应激前后中肠和后肠中AOX的蛋白含量以及活性的变化。结果显示:在未处理的单环刺螠中,后肠的AOX蛋白含量和酶活性均高于中肠。当单环刺螠暴露在硫化物(50和150μmol·L-1)环境中时,2个器官的AOX含量和酶活性水平均随着硫化物浓度的提高和暴露时间的延长而提高,并且150μmol·L-1硫化物处理组的单环刺螠2个器官AOX蛋白含量和酶活性普遍高于相同处理时间下的50μmol·L-1组。结合已报道的单环刺螠硫化物应激下细胞色素c氧化酶活性的变化,提出单环刺螠体内存在线粒体电子传递分支途径;提高组织线粒体中AOX活性是其应对环境硫化物毒性的对策之一。
单环刺螠; 交替氧化酶; 硫化物; 线粒体; 电子传递链
硫化物(H2S,HS-,S2-的总称)是潮间带底质和水体中常见的有毒物质,毫摩尔级浓度就可以对生物体产生毒害作用[1]。硫化物可以抑制线粒体电子传递链细胞色素c氧化酶的活性,从而阻止有氧呼吸的进行,进而导致生物体的死亡[2]。然而某些潮间带无脊椎动物却能够在富含硫化物的环境中生存,已知沙蠋(Arenicolamarina)线粒体内的交替氧化酶在此过程中起到了重要的作用[3]。
交替氧化酶(Alternative Oxidase,AOX)最早发现于1970年代,Bendall和Bonner在研究天南星科植物臭崧的抗氰化物呼吸时,发现该植物在氰化物处理下线粒体仍然能消耗氧,但该反应可被水杨基羟肟酸所抑制,提出其线粒体中存在1条区别于经典电子传递的途径——交替氧化途径,并将这一途径的关键分子命名为交替氧化酶[4]。作为交替途径的末端氧化酶,AOX通过在经典电子传递链上建立支路,从而绕过复合体III和复合体IV,将上游传递过来的电子传递给氧,进而生成水[5]。AOX保持呼吸链电子流的传递及三羧酸循环(TCA)的正常运行,对生物体有重要的意义[6]。与经典电子传递途径中的细胞色素c氧化酶不同,AOX不将H+泵入线粒体膜间隙[7],能量以热能的形式散失[8]。已知AOX广泛存在于植物、藻类、真菌和原生生物中,对于提高生物体的环境适应能力,增强生物体抗逆性都具有重要的意义[9]。目前,关于AOX的研究多集中于植物领域。通过基因组数据库可见AOX基因广泛存在于海绵动物到脊索动物的各种动物类群中[10],然而对于AOX在这些动物类群中的功能尚缺少清晰地认识。
单环刺螠(Urechisunicinctus)俗称海肠子,分布于中国黄渤海、俄罗斯、朝鲜和日本等沿海地带,栖息于潮间带泥沙底质的U形洞穴中[11]。已有研究报道,单环刺螠具有耐受和代谢硫化物的能力[12-15],并确定硫化物的应激可引起单环刺螠aoxmRNA表达量的提高[16]。本实验采用间接竞争性ELISA和酶活性分析等技术揭示了单环刺螠中肠和后肠中存在AOX线粒体电子传递通路,进一步分析了单环刺螠暴露在硫化物环境中2个器官AOX的适应性反应,为深入探讨动物应对硫化物的生存机制提供基础数据。
1 材料与方法
1.1 实验动物
单环刺螠购自青岛市四方路海产品市场,产地为烟台沿海。选择体表无伤痕,体态均一的健康个体(体重(28.1±7.4)g,体长(10.7±3.4)cm),于实验室暂养1周。每日换水1/2(温度(21±2)℃,盐度30±1,pH=8.0),并投喂适量单细胞藻,实验前一天停止投喂。
1.2 实验分组与样品处理
实验设定3个组,包括2个实验组(50μmol·L-1硫化物组、150μmol·L-1硫化物组)和1个对照组(不添加硫化物),不同浓度的硫化物使用硫化物母液(Na2S·9H2O,10mmol·L-1)稀释而成。实验在密封的养殖玻璃缸中进行,每个实验缸内含60L不同硫化物浓度的过滤海水,每缸15个个体,每组设置3个平行缸,实验期间每2h测定1次实验水体硫化物浓度,通过补充硫化物母液以维持硫化物浓度的恒定。硫化物浓度按照亚甲基蓝法测定[17]。分别于实验的0、6、12、24、48和72h取样,每缸随机取样2个个体,每组实验动物数共计6个个体。解剖虫体取中肠和后肠,液氮冷冻后,保存于-80℃冰箱中备用。
1.3 组织总蛋白提取和含量测定
单环刺螠中肠和后肠组织在冰浴中剪碎,电动匀浆器(Pro Scientific PRO 200,美国)匀浆。利用蛋白提取试剂盒(CW0891A,康为,北京)并按照操作指南提取中肠和后肠的总蛋白,于5000r/min离心,取上清即为总蛋白,保存于-20℃冰箱中。总蛋白含量以牛血清蛋白(BSA)为标准,采用考马斯亮蓝法测定[18]。
1.4 单环刺螠各组织AOX含量的测定
采用间接竞争性ELISA对单环刺螠中肠和后肠中AOX蛋白含量进行了测定。
利用碳酸盐包被缓冲液(0.05mol·L-1,pH=9.6)对实验室前期获得的AOX蛋白进行稀释,在酶标板的每个孔中加入100μL稀释后的AOX蛋白包被聚苯乙烯酶标板,4℃过夜。弃包被液,PBST(PBS+0.5%Tween-20)清洗3次,每次3min。再向每孔中加入200μL的5%脱脂奶粉封闭抗原表位,37℃封闭1.5h。弃封闭液,PBST清洗3次,每次3min。在每孔中加入50μL稀释后的一抗(AOX多克隆抗体)和50μL竞争抗原(单环刺螠组织总蛋白),37℃孵育1.5h。弃孔内液体,PBST清洗5次,每次3min。再向每孔中加入100μL稀释后的二抗(羊抗兔酶标抗体),37℃孵育1h。去孔内液体,PBST清洗5次,每次3min。最后利用TMB显色试剂盒(Tiangen,北京)进行显色,每孔加入100μL的显色液,室温下显色,待孔中反应液明显变黄后加50μL 2mol·L-1的硫酸终止显色反应。最后利用酶标仪在450nm下对各孔的吸光度进行测定。
1.5 组织线粒体提取和线粒体总蛋白含量测定
按照Schöttler的方法略加改动提取组织线粒体。400mg单环刺螠组织样本中加入9倍体积预冷的线粒体提取缓冲液(58.4mmol·L-1蔗糖,140.2mmol·L-1甘氨酸,40mmol·L-1Tris,2mmol·L-1EGTA,0.2%牛血清蛋白,pH=7.5),冰浴中剪碎,电动匀浆器(Pro Scientific PRO 200,美国)匀浆。3800g离心15min(4℃),取上清,再11000g离心10min(4℃),沉淀即为线粒体,然后重悬于提取缓冲液中[19]。线粒体总蛋白含量以BSA为标准,采用考马斯亮蓝法测定[18]。
1.6 交替氧化酶活性测定方法
利用clark型氧电极(Unisense,丹麦)在25℃下进行检测,反应体系为0.3mol·L-1蔗糖,10mmol·L-1的三羟甲基甲胺基乙磺酸(TES free acid)(pH=7.2),5mmol·L-1KH2PO4,10mmol·L-1NaCl,2mmol·L-1MgSO4,0.1% (w/v) BSA。pH通过2mol·L-1HC1或2mol·L-1KOH调节。开始反应时,反应体系中加入0.1mmol·L-1ATP和0.5mmol·L-1KCN,待体系中读数保持稳定,迅速加入10mmol·L-1琥珀酸钠,0.5mmol·L-1丙酮酸钠,1mmol·L-1ADP等反应底物,读取耗氧速率值,利用0.2mmol·L-1没食子酸丙酯(nPG)终止反应[20]。在加入KCN抑制经典电子传递链的情况下,以单位线粒体总蛋白的耗氧速率作为交替氧化酶活性的标准。每个取样时间进行6个个体的样本重复和2个平行的检测。
1.7 数据统计分析
所有数据以平均值±标准误(Mean±S.E.M.)表示。采用SPSS(Statistics Package for Social Science)17.0进行单因素方差分析(One-Way ANOVA)和Tukey检验法统计分析,以P<0.05作为差异显著水平。
2 结果
2.1 单环刺螠中肠和后肠中AOX的表达和活性
间接竞争性ELISA检测发现,未经硫化物处理的单环刺螠后肠中AOX含量显著高于中肠(P<0.05),分别为0.12ng·μg-1(中肠)和0.25ng·μg-1(后肠)(见图1A)。此外,未经硫化物处理的单环刺螠后肠线粒体中AOX的活性显著高于中肠(P<0.05),分别为48.9nmol O2·min-1·mg-1和61.9nmol O2·min-1·mg-1(见图1B)。

(图中数据均为平均值±标准误,n=6;不同的字符表示2个数据之间存在显著差异(P<0.05)。Data are indicated as mean ± S.E.M.,n=6; Different letters indicate significant differences between the mid-gut and the hindgut (P<0.05).)
图1 单环刺螠中肠和后肠交替氧化酶的含量(A)和活性(B)
Fig.1 Content (A) and activity (B) of AOX in mid-gut and hindgut ofUrechisunicinctus
2.2 硫化物暴露下单环刺螠AOX的组织表达特征
当暴露于硫化物环境中时,单环刺螠中肠和后肠中的AOX蛋白含量均随着硫化物暴露时间的延长和硫化物浓度的增加而增加(见图2)。150μmol·L-1硫化物处理24h后,2个器官的AOX表达量相对于对照组均呈显著性提高(P<0.05),中肠提高了2.4倍,后肠提高了6.3倍。150μmol·L-1硫化物处理72h后,AOX表达量进一步提高,分别达到了5.8倍(中肠)和12.9倍(后肠)。50μmol·L-1硫化物处理组,AOX蛋白表达量普遍明显低于150μmol·L-1硫化物组。

(图中数值为平均值±标准误,n=6;不同字母表示在组间存在显著性差异(P<0.05)。Data are indicated as mean±S.E.M.,n=6. Different letters indicate significant differences among different groups (P<0.05).)
图2 硫化物暴露下单环刺螠中肠(A)和后肠(B)交替氧化酶的含量变化
Fig.2 Content changes of AOX in mid-gut (A) and hindgut (B) ofUrechisunicinctusexposed to sulfide
2.3 硫化物暴露下单环刺螠组织线粒体AOX的酶活性变化
当单环刺螠暴露在硫化物环境中时,其中肠和后肠线粒体AOX活性随着硫化物浓度的升高和处理时间的延长逐渐升高。50μmol·L-1硫化物处理组中2个组织线粒体AOX酶活性的提高程度均较150μmol·L-1组的低,并且起始发生变化的时间也较150μmol·L-1硫化物组晚(见图3)。50μmol·L-1硫化物实验组,单环刺螠在处理48h时其后肠的AOX活性均较对照组显著提高(P<0.05),为对照组的1.44倍;中肠于处理24h时出现显著增加(P<0.05),为对照组的1.37倍(见图3(A),(B))。150μmol·L-1硫化物处理组中的AOX酶活性均在单环刺螠暴露6h时出现显著地提高(P<0.05),中肠和后肠线粒体的AOX酶活分别是对照组的1.6倍和1.9倍。72h时达到最高,分别为3.2倍(中肠)、2.3倍(后肠)(见图3(C),(D))。单环刺螠2个组织在应对硫化物环境时其交替氧化途径的能力是不同的,中肠较后肠对硫化物更敏感:硫化物处理时,中肠AOX活性的对硫化物的反应速度和增加的幅度都高于后肠。
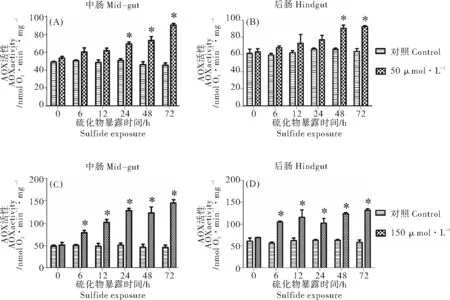
(酶活性为平均值±标准误,n=6;*表示与同一时间对照组有显著差异(P<0.05)。(A)、(B)为50μmol·L-1硫化物处理组;(C)、(D)为150μmol·L-1硫化物处理组。Activity value is the mean±S. E.M.,n=6; * indicates a significant difference between the treatment and the control at the same time (P<0.05). (A), (B): 50 μmol·L-1sulfide; (C), (D): 150 μmol·L-1sulfide.)
图3 暴露于硫化物中的单环刺螠中肠和后肠交替氧化酶活性
Fig.3 Activity of AOX in mid-gut and hindgut ofUrechisunicinctusexposed to sulfide
3 讨论
硫化物通过与细胞色素c氧化酶(Cytochromecoxidase, CCO)中细胞色素aa3上的血红素卟啉环Fe3+可逆性结合阻碍其还原成为含Fe2+的还原型氧化酶,从而抑制细胞色素c氧化酶的活性[1],进而减弱或阻断线粒体经典途径的电子传递,导致多余电子的积累和活性氧(Reactive oxygen species, ROS)的增加,破坏细胞内环境氧化还原态的稳定,导致其细胞生理功能的不利影响,并产生有机体的损伤[21]。Wagner等在研究天南星科植物魔芋的呼吸链时,发现当低温条件下经典电子传递链受到抑制,AOX通过接受呼吸链上游泛醌的电子,传递给氧生成水,这一过程保证了呼吸链电子传递的畅通,避免了ROS的积累并维持了TCA循环的正常进行[22]。综上可见AOX的存在对生物体正常生存于高浓度的硫化物环境中起到重要的作用。
已有研究报道,单环刺螠暴露在一定浓度的硫化物中,其组织线粒体的细胞色素c氧化酶(CCO)活性明显下降[12]。其中50μmol·L-1硫化物处理组单环刺螠体壁和后肠分别于暴露72和48h时CCO活性均较对照组显著降低,分别降低了约60%和25%[16]。本实验发现,相同硫化物浓度处理的单环刺螠后肠AOX酶活性在暴露48和72h时呈现显著性提高。类似的aoxmRNA表达特点也在Huang等的研究中被报道[16]。表明单环刺螠体内的确存在AOX电子传递途径。进一步,150μmol·L-1硫化物中暴露24h后体壁和后肠的CCO活性均显著低于对照组,单环刺螠体壁和后肠CCO活性较对照组显著降低了60%和50%[16],这一降低幅度较50μmol·L-1程度更高,说明此硫化物浓度下经典电子通路被大幅度降低甚至抑制。此时AOX酶活在硫化物处理6h后较之对照组显著提高,继续处理AOX活性持续提高。这表明此时线粒体中的电子传递很大程度上由交替氧化途径所替代。综上可以得出,单环刺螠体内存在交替氧化途径,当电子传递由于环境硫化物抑制CCO活性而受到阻碍时,其体内的AOX通过交替氧化途径传递电子,以此降低ROS对单环刺螠的损伤。
比较硫化物应激下单环刺螠中肠和后肠AOX蛋白含量和AOX酶活性可以看出,两者均随硫化物暴露时间的延长和硫化物浓度的提高而提高,并且AOX酶活性的提高与其蛋白含量的增加规律是一致的,表明AOX在硫化物应激下酶活性的提高主要是通过提高该蛋白的表达量来实现的。这不同于植物中的AOX。在烟草等植物中发现,AOX酶活性的提高既可以通过增加AOX蛋白的含量,同时还存在AOX结构改变提高其活性的机制[23]。植物中AOX有单体和二聚体2种形式,单体形式的AOX具有活性;二聚体由2个单体通过二硫键结合形成,二聚体AOX丧失活性[24]。在动物中,人们发现其AOX氨基酸序列N端缺少植物中参与二聚体的二硫键形成的关键氨基酸—半胱氨酸,由此动物中的AOX不存在二聚体形式[25]。单环刺螠AOX序列中,同样也不存在这一关键的氨基酸,因此也就可以解释单环刺螠中肠和后肠AOX酶活性在硫化物应激下的提高主要是通过提高AOX的蛋白表达量的机制。至于是否存在着硫化物对AOX蛋白结构产生其他影响而影响其活性,有待进一步探索和验证。
分析本实验中单环刺螠中肠AOX对硫化物暴露的酶活性变化较后肠更敏感的现象,认为这可能与2个器官在单环刺螠中的空间位置有关。单环刺螠为滤食性动物,含有饵料和硫化物的海水依次由口经过食道、嗉囊、砂囊、中肠、后肠和直肠,并由肛门排出体外[26]。其消化道长而迂回,约占体长的5倍[27],中肠是单环刺螠消化和吸收的主要部位,约占消化道长度的60%[28]。后肠在充水后其肠壁将变为单层,是发生气体交换的场所,因此又称呼吸肠[26]。已有研究报道,当单环刺螠暴露在硫化物环境中,其中肠和后肠均参与了硫化物的氧化解毒过程,并产生电子进入呼吸链[13-14]。根据分布位置,中肠较后肠更早和更多地接触硫化物,中肠线粒体的经典电子传递链较后肠线粒体更早地受到影响,因此中肠线粒体AOX的酶活性敏感度要高于后肠。
[1] Nicholls P, Kim J K. Sulphide as an inhibitor and electron donor for the cytochromecoxidase system [J]. Canadian Journal of Biochemistry, 1982, 60: 613-623.
[2] Dorman D C, Moulin F J M, McManus B E, et al. Cytochrome oxidase inhibition induced by acute hydrogen sulfide inhalation: correlation with tissue sulfide concentrations in the rat brain, liver, lung, and nasal Epithelium [J]. Toxicological Sciences, 2002, 65: 18-25.
[3] Tatjana M H, Manfred K G. Redox regulation of mitochondrial sulfide oxidation in the lugworm,Arenicolamarina[J]. The Journal of Experimental Biology, 2008, 211: 2617-2623.
[4] Bendall D S, Bonner W D. Cyanide-insensitive respiration in plant mitochondrial [J]. Plant Physiology, 1971, 47: 236-245.
[5] Juszczuk I M, Rychter A M. Alternative oxidase in higher plants [J]. Acta Biochimica Polonica, 2003, 50(4): 1257-1271.
[6] Simons B H, Millenaar F F, Mulder L, et al. Enhanced expression and activation of the alternative oxidase during infection of arabidopsis withPseudomonassyringaepv tomato [J]. Plant Physiology, 1999, 120(2): 529-538.
[7] Moore A L, Bonner W D, Rich P R. The determination of the proton-motive force during cyanide-insensitive respiration in plant mitochondria [J]. Archives of Biochemistry and Biophysics, 1978, 186: 298-306.
[8] Vanlerberghe G C, McIntosh L. Alternative oxidase: from gene to function [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48: 703-734.
[9] Hilal M, Zenoff A M, Ponessa G, et al. Saline stress alters the temporal patterns of xylem differentiation and alternative oxidase expression in developing soybean roots [J]. Plant Physiology, 1998, 117(2): 695-701.
[10] McDonald A E, Vanlerberghe G C, Staples J F. Branched mitochondrial electron transport in the animalia: presence of alternative oxidase in several animal phyla [J]. Iubmb Life, 2009, 212: 2627-2634.
[11] 李凤鲁, 王玮, 周红. 黄渤海螠虫动物(螠虫动物门的研究) [J]. 中国海洋大学学报: 自然科学版, 1994, 24(2): 203-210.
[12] 张志峰, 王思峰, 霍继革, 等. 单环刺螠对硫化物暴露的呼吸代谢适应 [J]. 中国海洋大学学报: 自然科学版, 2006, 36(4): 639-664.
[13] Ma Y B, Zhang Z F, Shao M Y, et al. Function of the anal sacs and mid-gut in mitochondrial sulphide metabolism in the echiuran wormUrechisunicinctus[J]. Marine Biology Research, 2012, 8: 1026-1031.
[14] Ma Y B, Zhang Z F, Shao M Y, et al. Response of sulfide: quinone oxidoreductase to sulfide exposure in the echiuran wormUrechisunicinctus[J]. Mar Biotechnol, 2012, 14: 245-251.
[15] Wang S F, Zhang Z F, Cui H, et al. The effect of toxic sulfide exposure on oxygen consumption and oxidation products inUrechisunicinctus(Echiura: Urechidae) [J]. Periodical of Ocean University of China, 2010, 9(2): 157-161.
[16] Huang J, Zhang L T, Li J L, et al. Proposed function of alternative oxidase in mitochondrial sulfide oxidation detoxification in the Echiuran worm,Urechisunicinctus[J]. Journal of the Marine Biological Association of the United Kingdom, 2013, 93(8): 2145-2154.
[17] Céline H T, Kevin M F, Daniel K, et al. Concentration-dependent effect of anions on the anaerobic oxidation of hemoglobin and myoglobin [J]. The Journal of Biological Chemistry, 2000, 275(50): 39048-39054.
[18] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248-254.
[19] Schroff G, Schottler U. Anaerobic reduction of fumarate in the body wall musculature ofArenicolamarina(Polychaeta) [J]. Journal of Comparative Physiology, 1977, 116: 325-336.
[20] Day D A, Millar A H, Wiskich J T, et al. Regulation of alternative oxidase activity by pyruvate in soybean mitochondria [J]. Plant Physiology, 1994, 106: 1421-1427.
[21] Purvis A C, Shewfelt R L. Does the alternative pathway ameliorate chilling injury in sensitive plant tissues [J]. Plant Physiology, 1993, 88: 712-718.
[22] Wagner A M, Wagner M J, Moore A L. In vivo ubiquinone reduction levels during thermogenesis in Araceae [J]. Plant Physiology, 1998, 117(4): 1501-1506.
[23] McDonald A E, Sieger S M, Vanlerberghe G C. Methods and approaches to study plant mitochondrial alternative oxidase [J]. Physiol Plant, 2002, 116: 135-143.
[24] Umbach A L, Siedow J N. Covalent and noncovalent dimers of the cyanide-resistant alternative oxidase protein in higher plant mitochondria and their relationship to en-zyme activity [J]. Plant Physiol, 1993, 103: 845-854.
[25] McDonald A E, Vanlerberghe G C, Staples J F. Alternative oxidase in animals: unique characteristics and taxonomic distribution [J]. The Journal of Experimental Biology, 2009, 212: 2627-2634.
[26] 张新明, 李慷均. 单环刺螠生物学及生理学研究进展 [J]. 河南农业科学, 2011, 40(11): 26-29.
[27] 邵明瑜, 张志峰, 康庆浩, 等. 单环刺螠消化道组织学和细胞学 [J]. 中国水产科学, 2003, 10(4): 265-270.
[28] 陈宗涛, 张志峰, 康庆浩, 等. 单环刺螠消化道的发生和分化 [J]. 中国水产科学, 2006, 13(5): 700-707.
责任编辑 朱宝象
Response of Alternative Oxidase in the Mid-Gut and Hindgut ofUrechisunicinctusAfter Sulfide Stress
REN Zhi-Qiang, ZHANG Li-Tao, LIU Xiao-Long, LIU Jian-Guo, ZHANG Zhi-Feng
(The Key Laboratory of Marine Genetics and Breeding, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Exogenous sulfide can damage or even kill the organism by inhibiting or blocking classical pathway of mitochondrial electron transport (MET), while alternative oxidase as a key enzyme, conducts a branch pathway of the sulfide oxidation MET. In order to study the animal's survival countermeasures to sulfide environment, in this study we determined the protein expression and activity change of alternative oxidase (AOX) in the mid-gut and hindgut ofUrechisunicinctusbefore and after sulfide stress by indirect competitive ELISA, and AOX enzyme activity analysis. The result showed: it was detected that the presence of AOX protein and enzyme activity in mid-gut and hindgut, which were higher in hindgut than mid-gut. When exposed at 50 and 150 μmol·L-1sulfide, the AOX protein amount and enzyme activity in mid-gut and hindgut both increased with elevation of sulfide concentration and delay of sulfide exposure time. AOX expression and activity in the 2 tissues exposed in 150 μmol·L-1is almost higher than that of 50 μmol·L-1. Combining with changes of activity of cytochromecoxidase which has been reported inU.unicinctusexposed to sulfide, we discussed the role of AOX in 2 tissues ofU.unicinctusexposed to different concentrations of sulfide, and suggested that an AOX branch pathway of MET existed inU.unicinctus, and the increase of the AOX activity was one of strategy for response to the toxicity of environment sulfide in the worm.
Urechisunicinctus; alternative oxidase; sulfide; mitochondria; electrons transport chain
国家自然科学基金项目(31072191)资助
2013-10-31;
2014-04-02
任志强(1987-),男,硕士生,研究方向:细胞生物学。
❋❋ 通讯作者: E-mail: zzfp107@ouc.edu.cn
Q554+.9
A
1672-5174(2015)02-066-06
10.16441/j.cnki.hdxb.20130400

