SG97A平衡致死系统的构建及其初步应用
耿士忠,陈晓娟,潘志明,焦新安
(扬州大学 江苏省人兽共患病学重点实验室/江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
SG97A平衡致死系统的构建及其初步应用
耿士忠#,陈晓娟#,潘志明,焦新安*
(扬州大学 江苏省人兽共患病学重点实验室/江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
敲除鸡伤寒沙门菌(SG)减毒疫苗株97Aasd基因,构建宿主载体平衡致死系统并表达新城疫病毒(NDV)F蛋白,构建二价活菌苗。PCR扩增两段位于asd基因外侧的序列作为等位基因,以氯霉素抗性(CmR)基因替代asd基因,构建自杀质粒pGMB151Δasd::CmR,通过E.coliχ7213与SG97A固相杂交,将质粒转入SG97A,反向筛选获得SG97AΔasd::CmR,利用质粒pCP20去除CmR后,DAP的依赖菌株命名为SG97AΔasd。将含asd基因的质粒pYA3334转入SG97AΔasd中构建宿主载体平衡致死系统,并表达NDV-F蛋白。结果表明,通过等位基因重组方法,成功构建SG97AΔasd及宿主载体平衡致死系统,重组菌能够表达NDV-F蛋白,并能在鸡体内诱导产生特异性抗体。本研究成功构建SG97AΔasd宿主载体平衡致死系统,并表达NDV-F蛋白及其诱导宿主产生抗体,为应用该系统构建二价活菌苗的研究奠定了基础。
鸡伤寒沙门菌;asd基因; 宿主载体平衡致死系统;NDV-F蛋白
鸡伤寒(fowl typhoid)是由鸡伤寒沙门菌引起的鸡的常见多发性传染病,呈急性或慢性败血症状,以肝、脾等实质器官的病变和下痢为特征,主要发生于成年鸡和青年鸡,产蛋期母鸡对本病最为敏感,蛋鸡一旦暴发鸡伤寒,其死亡率急剧上升。该菌除了水平传播外,也能经卵垂直传递,带菌种鸡所产种蛋的带菌率可达20%~30%,不仅孵化率低,并有死雏病雏,还可污染孵化器、出雏器和育雏室,造成水平传播扩散,使整个养鸡周期呈恶性循环,给养鸡业带来的直接和间接损失巨大。减毒鸡沙门菌97A是经转座突变及粗糙变异方法筛选所获得,研究结果表明该减毒株具有较好的安全性和免疫效力,也能显著地限制强毒株在鸡体内的定居和增殖[1]。
多价疫苗和黏膜免疫是未来免疫预防传染病的主要方向。利用宿主载体平衡致死系统使沙门菌作为疫苗载体已在医学与兽医学领域引起广泛重视,但目前研究沙门菌载体多为鼠伤寒沙门菌[2-3],其他沙门菌较为少见。作者以减毒鸡沙门菌疫苗株97A为亲本菌,敲除asd基因后,构建以减毒鸡沙门菌疫苗株97AΔasd基因缺失株为宿主和含asd基因的pYA3334质粒为载体的宿主载体平衡致死系统,并利用该系统表达NDV-F蛋白,为构建二价活疫苗的研究奠定基础。
1 材料与方法
1.1 菌株与质粒
试验所用的细菌和质粒,见表1。
表1 试验所用的细菌和质粒
Table 1 Bacteria and plasmids used in this study

材料Material名称Name用途Use来源Source细菌BacteriaSG97ARecipientOurlabE.coliDH5αHostforpMD18OurlabE.coliχ7213(KmRΔasd)HostforpGMB151OurlabE.coliSpy372(λ⁃pir)HostforpGMB151Ourlabχ4550(S.typhimurium)STΔasdOurlabE.coliχ6216HostforpGMB151OurlabE.coliχ3730HostforpGMB151tomethylateOurlab质粒PlasmidpUC18(AmpR)CloningvectorOurlabpMD18⁃TCloningvectorTaKaRapKD3IncludingCmRgeneOurlabpGMB151(AmpRSmR)SuicidevectorOurlabpYA3334(asd+)PlasmidofexpressingDAPOurlabpYA3334⁃dsRED(asd+)PlasmidofexpressingDAPanddsREDOurlab
1.2 主要试剂
用于分子克隆的 Primer STAR HS聚合酶、限制性内切酶、连接酶、产物纯化试剂盒和胶回收试剂盒均购自TaKaRa公司,羊抗鸡HRP-IgG和羊抗鼠HRP-IgG购自Sigma公司,GST-F蛋白及其小鼠抗血清自备。
1.3 引物设计与合成
根据GenBank中已发表的沙门菌基因组序列,以软件Primer5.0设计出特异性的引物,如表2所示。引物由南京金思瑞生物有限公司合成。
表2 PCR扩增所用的引物序列
Table 2 The primer sets for PCR in this study

目的基因Geneamplified引物名称Primers引物序列(5′⁃3′)Primesequences扩增片段长度/bpAmpliconsize备注Noteasd12asdp1asdp2TTGGATCCCCGTTGAATGATGATGACCGTTCTCGAGTGCGTTAGGAAGGGAATC1959BamHⅠXhoⅠasd34asdp3asdp4TTCTCGAGGTAGCTTAATCCCGCGGGTATTGGATCCGAGCGTTCATTGTCATCGAC2079XhoⅠBamHⅠasd56asdp5asdp6TTGCTTTCCAACTGCTGAGCTCCTATCTGCGTCGTCCTAC1796(wt)1360(Δasd+CmR)CmRCmFCmRACTCGAGGTGTAGGCTGGAGCTGCTTCACTCGAGATGGGAATTAGCCATGGTCC1032XhoⅠXhoⅠHtohtoFhtoRACTGGCGTTATCCCTTTCTCTGCTGATGTTGTCCTGCCCCTGGTAAGAGA495SalmonellaNDV⁃FFp1Fp2AACCATGGGAAATGCTGCCAACATCCTCAAGGATCCATCCAAATCGGTCTCTAC594NcoⅠBamHⅠ
1.4 鸡伤寒沙门菌减毒株SG97AΔasd缺失株的构建
根据本实验室所建立的沙门菌基因敲除方法[4-5],通过扩增asd基因上下游1 959和2 079 bp两个片段作为同源臂,以便等位基因交换。以CmR替代asd基因,构建重组自杀质粒,固相杂交法转移重组自杀质粒到鸡伤寒沙门菌减毒株97A中获得单同源臂交叉互换重组菌后,运用10%蔗糖和无NaCl培养基及氯霉素筛选DAP生长依赖细菌,即可以获得asd基因缺失株,命名为SG97AΔasd。
1.5 宿主载体平衡致死系统的构建
将含有asd基因的pYA3334质粒及含有红色荧光蛋白基因(dsRED)的pYA3334-dsRED质粒转化到χ4550和SG97AΔasd中,构建宿主载体平衡致死系统,观察重组菌对DAP的生长依赖性及外源红色荧光蛋白基因表达。
1.6 宿主载体平衡致死系统表达NDV-F基因
1.6.1 构建表达NDV-F基因宿主载体平衡致死系统 PCR扩增含NDV-F基因,克隆测序后,亚克隆到pYA3334(asd+)质粒限制性内切酶识别位点NcoⅠ和BamHⅠ间,形成重组质粒pYA3334-F。经宿主菌E.coliχ6212及中间宿主E.coliχ3730(甲基化重组质粒)后,再转化至终末宿主减毒鸡伤寒沙门菌SG97AΔasd缺失株及χ4550,形成重组菌SG97A(pYA3334-F)和χ4550(pYA3334-F)。1.6.2 重组质粒pYA3334-F在SG97AΔasd和χ4550中的表达 分别取OD600 nm=1.0的重组沙门菌χ4550(pYA3334-F)、SG97A(pYA3334-F)及空载体菌χ4550(pYA33340)和SG97AΔasd(pYA3334)各1 mL,12 000 r·min-1离心2 min,弃上清,沉淀用PBS洗涤3次后,加50 μL的ddH2O重悬,加等体积的2 ×上样缓冲液,煮沸5 min,各取20 μL进行SDS-PAGE电泳;并以χ4550表达的F蛋白割胶免疫法制备小鼠抗血清作Western blotting分析。
1.6.3 重组菌免疫接种雏鸡 以重组菌SG97AΔasd(pYA3334-F) 免疫接种10日龄雏鸡,3组,10羽·组-1,1×109CFU·羽-1,肌肉注射免疫3次,中间间隔2周。各免疫组免疫后第12 天采血,制备血清,-20 ℃保存。同时设SG97AΔasd(pYA3334)阴性对照组和PBS空白对照组。
1.6.4 抗体效价的测定 GST-F蛋白经纯化后包被ELISA板,20 μg·孔-1,4 ℃包被过夜,PBST洗涤3次;加入含10% BSA的封闭液,200 μL·孔-1,4 ℃封闭过夜后,PBST洗涤5次;加入各免疫组血清,同时设立阴性血清对照和PBS空白对照,37 ℃作用3 h后,PBST洗涤3次;加入HRP标记的羊抗鸡IgG抗体(工作浓度1∶10 000),37 ℃作用1 h后,PBST洗涤4次;加入底物OPD,37 ℃避光显色15 min,用2 mol·L-1H2SO4终止后测OD492 nm值。
2 结 果
2.1 鸡伤寒沙门菌减毒株SG97AΔasd的构建
asdp1/p2扩增出约2 kb基因片段asd12,asdp3/p4扩增出约2 kb基因片段asd34,asdp5/p6能扩增出SG97AΔasd约1.4 kb基因片段,而野生菌(wt)则扩增出1.84 kb基因片段;CmF/CmR能扩增出1.0 kbCmR基因,亲本株SG97A则不能被扩增(图1)。结果显示通过多对引物PCR鉴定,扩增产物都与预期的大小一致,表明鸡伤寒沙门菌减毒株SG97AΔasd被成功构建,且通过特异性引物htoF/htoR PCR证实该菌为鸡伤寒沙门菌(图2)。

M.DL2000 DNA相对分子质量标准;1,3,5,7.SG97AΔasd;2,4,6,8.SG97A;1,2.asdP1/P2 PCR;3,4.asdP3/P4 PCR;5,6. asdP5/P6 PCR;7,8.CmF/CmR PCRM.DL2000 DNA marker;1,3,5,7.SG97AΔasd;2,4,6,8.SG97A;1,2.asdP1/P2 PCR;3,4.asdP3/P4 PCR;5,6.asdP5/P6 PCR;7,8.CmF/CmR PCR图1 SG97AΔasd缺失株的PCR鉴定Fig.1 PCR identification of SG97AΔasd

M. DL2000 DNA相对分子质量标准; 1. 野生菌; 2、3. SG97AΔasd; 4. ddH2O对照M. DL2000 DNA marker; 1. wt; 2, 3. SG97AΔasd; 4. ddH2O control图2 SG97A沙门菌属特异性鉴定Fig.2 PCR identification of Salmonella
2.2 宿主载体平衡致死系统的构建
根据asd基因表达产物特性,SG97AΔasd对二氨基庚二酸(DAP)生长依赖,图3中显示SG97AΔasd在含DAP培养基上能生长(A),而在无DAP培养基上则不能生长(B)。同样,转化了质粒pYA3334的SG97AΔasd在无DAP的培养基上则能生长,而没有转化质粒pYA3334的SG97AΔasd则不能在无DAP的培养基上生长。两个结果都说明SG97AΔasd对DAP具有生长依赖性。通过将能够表达红色荧光蛋白的pYA3334-dsRED质粒转化入SG97AΔasd,互补细菌中能够表达外源基因(A),显现红色荧光;而仅转化pYA3334的质粒则无荧光出现(B)(图4)。

图3 SG97AΔasd在LB+DAP平板(A)和LB平板(B)上的生长情况Fig.3 The growth of SG97A Δasd on LB with DAP (A) or without DAP (B)
2.3 宿主载体平衡致死系统的生长特性及其稳定性
如图5所示,转化pYA3334质粒的SG97AΔasd缺失株形成载体宿主互补的平衡致死系统后,互补菌生长速度与SG97AΔasd缺失株相当,与野生菌的生长速度有显著的差别。通过FACS测定转化了pYA3334-dsRED质粒的SG97AΔasd能观察红色荧光蛋白的表达,第100代载体宿主互补菌与第50代和第1代的细菌差异不大(图6),说明载体宿主之间能够形成的平衡致死系统有良好的稳定性。
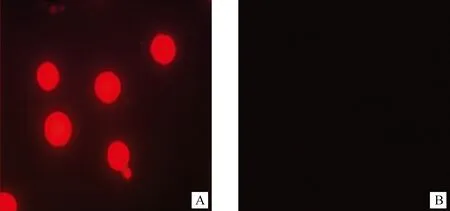
A. SG97AΔasd (pYA3334-dsRED);B. SG97AΔasd (pYA3334)图4 SG97AΔasd互补细菌表达红色荧光Fig.4 Red fluorescence expressed by SG97AΔasd(pYA3334-dsRED)

图5 SG97AΔasd缺失株生长曲线Fig.5 The growth curves of SG97A and SG97AΔasd

图6 FACS测定不同代次SG97A Δasd (pYA3334-dsRED)中dsRED的稳定性Fig.6 The stability of SG97A Δasd (pYA3334-dsRED) by FACS analysis
2.4 利用SG97AΔasd宿主载体平衡致死系统表达新城疫病毒F基因
2.4.1 表达质粒重组菌的构建 PCR扩增新城疫病毒(NDV)F基因,克隆测序正确后,亚克隆入pYA3334载体限制性内切酶识别位点NcoⅠ和BamHⅠ间,构建宿主平衡致死系统表达质粒pYA3334-F,经感受态E.coliχ6212扩增,及中间宿主E.coliχ3730完成重组质粒的甲基化过程后,重组质粒pYA3334-F转化χ4550和SG97AΔasd,分别命名为χ4550(pYA3334-F)和SG97AΔasd(pYA3334-F)。
2.4.2 重组菌χ4550(pYA3334-F)和SG97AΔasd(pYA3334-F)的Western blotting鉴定 新城疫病毒F蛋白能够在重组菌χ4550(pYA3334-F)中正确表达,约20 kd(图7)。但是在重组菌SG97AΔasd(pYA3334-F)表达产物约40 ku,为理论值的2倍(图8A),Western blotting分析显示该表达产物能与小鼠F蛋白抗血清特异性反应(图8B)。
2.4.3 重组沙门菌SG97AΔasd(pYA3334-F)诱导的F蛋白抗体测定结果 SG97AΔasd(pYA3334-F)以1×109CFU·羽-1的剂量肌注免疫雏鸡,SG97AΔasd(pYA3334)作为阴性对照,分别在二免及三免后第12天采血,制备血清。间接ELISA结果显示在鸡二免后血清内检测到抗NDV-F蛋白的抗体,平均抗体效价为1∶200;三免后平均抗体效价为1∶400(图9)。

M.蛋白质相对分子质量标准; 1.χ4550 (pYA3334-F); 2. χ4550 (pYA3334)M.Protein marker;1.χ4550 (pYA3334-F);2.χ4550 (pYA3334)图7 χ4550 (pYA3334-F)的SDS-PAGE鉴定Fig.7 SDS-PAGE identification of χ4550 (pYA3334-F)

M.蛋白质相对分子质量标准;1.SG97AΔasd (pYA3334-F);2.SG97AΔasd (pYA3334)M.Protein marker;1.SG97AΔasd (pYA3334-F);2.SG97AΔasd (pYA3334)图8 SG97AΔasd (pYA3334-F)的SDS-PAGE(A)及Western blotting(B)鉴定Fig.8 SDS-PAGE(A) and Western blotting(B) identification of SG97AΔasd (pYA3334-F)

图9 间接ELISA检测鸡血清中抗NDV-F抗体滴度Fig.9 The titers of anti-NDV-F antibody in chicken sera by indirect ELISA
3 讨 论
多价苗由于免疫后同时获得对多种病原的免疫保护,减少对动物的应激,省时省力而备受青睐。1988年,宿主载体平衡致死系统首次被报道应用于重组减毒沙门菌疫苗(recombinant attaunatedSalmonellavaccines,RASVs)。此系统能够确保编码外源基因的重组质粒在重组菌免疫宿主后的稳定性,避免抗生素耐药基因的使用[6]。以减毒沙门菌作为载体构建双价或多价活疫苗,是目前研制新型疫苗的重要途径之一。所构建的重组减毒沙门菌可经口服免疫、鼻内免疫[7-8]和直肠免疫[9]等多种途径免疫,在机体内表达特异抗原[10]诱导获得体液免疫、细胞免疫及黏膜免疫[11-12],提供对细菌[13]、寄生虫[14]和病毒[15]感染的保护作用。
当前减毒鼠伤寒沙门菌χ4550(Δasd)是宿主载体平衡致死系统研究较多的工程菌,有学者应用携带能编码乙肝病毒核心抗原质粒的χ4550菌株经胃肠道免疫小鼠后,诱导出了较长久的黏膜保护性抗体[16-17],表明减毒鼠伤寒沙门菌χ4550作为口服疫苗载体具有应用价值。以其他血清型沙门菌为疫苗载体的研究也在研究尝试中,如猪霍乱沙门菌[18]、鸡白痢沙门菌[2]、迟钝爱德华菌[19]。本研究则利用已有的减毒鸡伤寒沙门菌97A,通过缺失其asd基因成功构建宿主载体平衡致死系统,并表达外源蛋白,诱导动物机体产生免疫。
在研究中,作者发现pYA3334-F 质粒在χ4550内表达F蛋白与理论值一样,但在SG97AΔasd中体外表达蛋白质大小是理论值的2倍,Western blotting分析显示其能够与鼠源F蛋白抗血清特异反应,SG97A(pYA3334-F)以1×109CFU·羽-1的剂量肌注免疫雏鸡,阳性血清二免平均抗F抗体效价为1∶200,三免平均抗F抗体效价为1∶400,该结果说明pYA3334-F在减毒鸡伤寒沙门菌SG97AΔasd中表达了外源F蛋白,但2倍于理论值大小的原因不详,有待进一步研究。
4 结 论
成功构建SG97AΔasd宿主载体平衡致死系统,能够表达NDV-F蛋白并诱导宿主产生抗体,为应用该系统构建沙门菌二价活菌苗的研究奠定了基础。
[1] 刘海侠,王宝安,潘志明,等.减毒鸡沙门氏菌疫苗株97A安全性评价[J].中国兽医杂志,2007,43(11):72-73. LIU H X,WANG B A,PAN Z M,et al.Evaluation on safety to Chicken of attenuatedSalmonellavaccine strain 97A[J].ChineseJournalofVeterinaryMedicine,2007,43(11):72-73.(in Chinese)
[2] 陈松彪,李 静,尚 珂,等.鸡白痢沙门菌C79-13 ΔcrpΔasd平衡致死系统的构建及其生物学特性的研究[J].中国免疫学杂志,2014,30(8):1083-1087,1092. CHEN S B,LI J,SHANG K,et al.Construction ofSalmonellaPullorum C79-13 ΔcrpΔasd mutant balanced-lethal host-vector system and its biological features[J].ChineseJournalofImmunology,2014,30(8):1083-1087,1092.(in Chinese)
[3] 徐引弟,郭爱珍,刘维红,等.猪霍乱沙门菌C500 株ΔcrpΔasd缺失株平衡致死载体系统的构建及鉴定[J].生物工程学报,2006,22(3):366-372. XU Y D,GUO A Z,LIU W H,et al.Construction and characterization ofΔcrpΔasdMutant host-vector balanced lethal system ofSalmonellacholeraesuisC500 strain[J].ChineseJournalofBiotechnology,2006,22(3):366-372.(in Chinese)
[4] GENG S Z,JIAO X A,PAN Z M,et al.An improved method to knock out theasdgene ofSalmonellaentericaserovar Pullorum[J].JBiomedBiotechnol,2009,2009:646380.doi:10.1155/2009/646380.
[5] 耿士忠,刘男男,焦新安,等.鸡白痢沙门菌S06004ΔspiC突变株的构建与鉴定[J].中国兽医科学,2014,44(4):379-386. GENG S Z,LIU N N,JIAO X A.et al.Development and identification ofspiCgene-deletedSalmonellapullorummutant strainΔspiC[J].ChineseVeterinaryScience,2014,44(4):379-386.(in Chinese)
[6] WANG S F,KONG Q K,CURTISS R III.New technologies in developing recombinant attenuatedSalmonellavaccine vectors[J].MicrobPathog,2013,58:17-28.
[7] GALEN J E,GOMEZ-DUARTE O G,LOSONSKY G A,et al.A murine model of intranasal immunization to assess the immunogenicity of attenuatedSalmonellatyphilive vector vaccines in stimulating serum antibody responses to expressed foreign antigens[J].Vaccine,1997,15(6-7):700-708.
[8] VECINO W H,MORIN P M,AGHA R,et al.Mucosal DNA vaccination with highly attenuatedShigellais superior to attenuatedSalmonellaand comparable to intramuscular DNA vaccination for T cells against HIV[J].ImmunolLett,2002,82(3):197-204.
[9] KARPENKO L I,NEKRASOVA N A,IGNAT’EV G M,et al.Immune response in oral and rectal immunization by the attenuated strain ofSalmonellacarrying the HIV DNA-vaccine[J].VoprVirusol,2003,48(4):16-20.
[10] PASETTI M F,LEVINE M M,SZTEIN M B,et al.Animal models paving the way for clinical trials of attenuatedSalmonellaentericaserovar typhi live oral vaccines and live vectors[J].Vaccine,2003,21(5-6):401-418.
[11] CURTISS R Ⅲ,ZHANG X,WANDA S Y,et al.Induction of host immune responses usingSalmonella-vectored vaccines//Brogden K A,Minion F C,Cornick N(ed).Virulence mechanisms of bacterial pathogens[M].4th ed.ASM Press,Washington,DC.2007:297-313.
[12] 刘 婷,焦新安,潘志明,等.表达破伤风毒素C片段的重组鼠伤寒沙门菌的构建与鉴定[J].中国兽医科技,2005,35(11):883-887. LIU T,JIAO X A,PAN Z M,et al.Construction and identification of recombinantSalmonellatyphimuriumstrain expressing tetanus toxin fragment C[J].ChineseJournalofVeterinaryScienceandTechnology,2005,35(11):883-887.(in Chinese)
[13] SCHRIEFER A,MALTEZ J R,SILVA N,et al.Expression of a pilin subunit BfpA of the bundle-forming pilus of enteropathogenicEscherichiacoliin anaroAliveSalmonellavaccine strain[J].Vaccine,1999,17(7-8):770-778.
[14] QU D,WANG S,CAI W,et al.Protective effect of a DNA vaccine delivered in attenuatedSalmonellatyphimuriumagainstToxoplasmagondiiinfection in mice[J].Vaccine,2008,26(35):4541-4548.
[15] WANG J,MICHEL V,LECLERC C,et al.Immunogenicity of viral B-cell epitopes inserted into two surface loops of theEscherichiacoliK12 LamB protein and expressed in an attenuatedaroAstrain ofSalmonellatyphimurium[J].Vaccine,1999,17(1):1-12.
[16] HOPKINS S,KRAEHENBUHL J P,SCHÖDEL F,et al.A recombinantSalmonellatyphimuriumvaccine induces local immunity by four different routes of immunization[J].InfectImmun,1995,63(9):3279-3286.
[17] BACHTIAR E W,SHENG K C,FIFIS T,et al.Delivery of a heterologous antigen by a registeredSalmonellavaccine(STM1)[J].FEMSMicrobiolLett,2003,227(2):211-217.
[18] 徐引弟.猪霍乱沙门氏菌C500株crp-、asd-缺失株平衡致死系统的构建及应用[D].武汉:华中农业大学,2006. XU Y D.Construction and application ofcrp-,asd-deleted mutants host-vector balanced lethal system ofSalmonellacholeraesuisC500 strain[D].Wuhan:Huazhong Agricultural University,2006.(in Chinese)
[19] 闫一剑.迟钝爱德华氏菌平衡致死系统的构建及其在新型疫苗开发中的应用[D].上海:华东理工大学,2013. YAN Y J.Construction of anasdbalanced-lethal system inEdwardsiellatardaand its potential application in multivalent vaccine development[D].Shanghai:East China University of Science and Technology,2013.(in Chinese)
(编辑 白永平)
Construction and Preliminary Application of Balanced Lethal System Based on AttenuatedSalmonellaSG97A
GENG Shi-zhong#,CHEN Xiao-juan#,PAN Zhi-ming,JIAO Xin-an*
(JiangsuKeyLaboratoryofZoonoses,JiangsuCo-InnovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,YangzhouUniversity,Yangzhou225009,China)
The aim of this study was to deleteasdgene ofSalmonellagallinarum(SG) attenuated vaccine strain 97A and construct bivalent live vaccine based on host-vector balanced lethal system to express F protein of Newcastle disease virus(NDV).Two DNA fragments flankingasdgene as allele were amplificated by PCR andasdgene was replaced by chloramphenicol resistance(CmR) gene to construct the suicide plasmid pGMB151Δasd::CmR.After conjugation,the recombiant plasmid was transformed into SG97A fromE.coliχ7213,SG97AΔasd::CmRwas reversely screened out under the selectable pressure of chloramphenicol,DAP-dependent strain was named SG97AΔasd.Vector-host balanced lethal system was construct by pYA3334 containingasdgene being transferred into SG97AΔasdand to expressed F protein of NDV.SG97AΔasdwas successfully constructed by allelic exchanges,its growth was DAP-dependent.Vector-host balanced lethal system was constructed by pYA3334 being transferred to SG97AΔasd and could express F protein of NDV and also induce specific antibodies in infected chickens.Vector-host balanced lethal system was constructed successfully based on attenuatedSalmonellaSG97AΔasdin this study and could expressFgene of NDV as foreign gene to induce special antibodies in animal model,it laid a foundation for bivalent live vaccine based on attenuatedSalmonella.
Salmonellagallinarum(SG);asdgene;vector-host balanced lethal system;NDV-F protein
10.11843/j.issn.0366-6964.2015.12.016
2015-04-13
公益性行业(农业)项目(201403054);“863”项目(2011AA10A212);中国博士后基金(2014M551670);江苏省重点实验室开放课题(0273896034819);江苏省博士后基金(1302067C);扬州大学创新培育基金(2013CXJ070)
耿士忠(1972-),男,江苏高邮人,副教授,博士,主要从事沙门菌致病机制研究及疫苗开发,Tel:0514-87971136,E-mail:gszzsg115@163.com。耿士忠、陈晓娟对本文贡献相同
*通信作者:焦新安,教授,E-mail:jiao@yzu.edu.cn
S852.612
A
0366-6964(2015)12-2243-08

