文蛤(Meretrix meretrix)C-型凝集素基因的分子克隆及表达分析*
李 猛 周素明 刘 璐 彭 頔 王国良
(宁波大学 应用海洋生物技术教育部重点实验室 宁波 315211)
文蛤(Meretrix meretrix)隶属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchiata)、帘蛤目(Veneroida)、帘蛤科(Veneridae)、文蛤属(Meretrix)。具有很高的食用和药用价值, 广泛分布于山东、江苏、广西、浙江等沿海地区。近年来, 由于养殖规模扩大, 环境恶化, 管理方法不当等导致病害滋生, 严重阻碍了文蛤养殖业的健康发展。为提高文蛤的抗病害能力, 有必要对其免疫相关因子进行深入研究。
凝集素是一类可结合糖类物质的蛋白, 最初于植物中发现, 在细菌、真菌和动物中同样大量存在。凝集素在多种生命过程包括细胞间通信、蛋白的折叠和装配、信号转导、非己识别等中发挥着重要作用(Vastaet al, 2004)。根据凝集素糖类识别结构域CRD的结构特征不同, 可将凝集素分为 C-、L-、P-、I-、R-和 S-型凝集素等(Janewayet al, 2002)。C-型凝集素家族是目前研究最多的一类凝集素, 其主要特征是在蛋白质分子的 C末端含有糖识别的结构域 CRD,具有保守特征性功能域, 其凝集活性具有钙离子依赖性(罗展等, 2010)。贝类动物的免疫机制以非特异性免疫为主, 其中 C-型凝集素作为可与糖专一性结合并能促使细胞凝集的蛋白质或糖蛋白, 在免疫识别和防御系统中专一地与异物表面特定的糖基结合,从而吸附和凝集异物, 促进机体清除和杀灭异物(Tamplinet al, 1989)。目前, 已经在栉孔扇贝(Chlamys farreri)(Wanget al, 2007; Zhanget al, 2009a)、海湾扇贝(Argopecten irradians)(Zhuet al, 2008)、合浦珠母贝(Pinctada fucata)(胡钰婷等, 2011)、刺参(Apostichopus japonicus) (Hanet al, 2012)、凡纳滨对虾(Litopenaeus vannamei)(Zhanget al, 2009b)、三疣梭子蟹(Portunus trituberculatus)(于金红等, 2013)等不同海洋动物中发现并克隆获得 C-型凝集素基因的全长序列, 但在文蛤中对 C-型凝集素的研究相对较少。本实验成功获得了文蛤 C-型凝集素基因的 cDNA全序列, 明确了它的序列特征、系统进化关系及其对环境因子胁迫影响的表达变化, 为进一步深入研究文蛤 C-型凝集素的免疫功能提供实验依据和理论基础。
1 材料与方法
1.1 实验材料
文蛤采样于温州市龙湾区文蛤养殖场, 选择壳色正常、无异味, 健康无发病症状的文蛤于实验室暂养3天后进行试验。大肠杆菌E.coliTG1和溶藻弧菌菌株为本实验室保存, 连接载体 pMD18T购于TaKaRa公司。
TRizol总 RNA 提取试剂盒(Invitrogen), 3¢-Full RACE Core Set with PrimeScriptTMRtase (TaKaRa),5¢-Full RACE Core Set with PrimeScriptTMRtase(TaKaRa), PrimeScriptTM1st Strand cDNA Synthseis Kit (TaKaRa), GenClean柱式琼脂糖凝胶DNA回收试剂盒(上海捷瑞生物工程有限公司)。PCR仪(Bio-Rad), 微量核酸蛋白测定仪(Bio-Rad), 冷冻离心机(Eppendorf),凝胶成像仪(Bio-Rad)。
1.2 引物设计与合成
根据GenBank上已有的贝类C-型凝集素基因序列, 设计克隆及定量PCR所需引物(表1, 表2)。
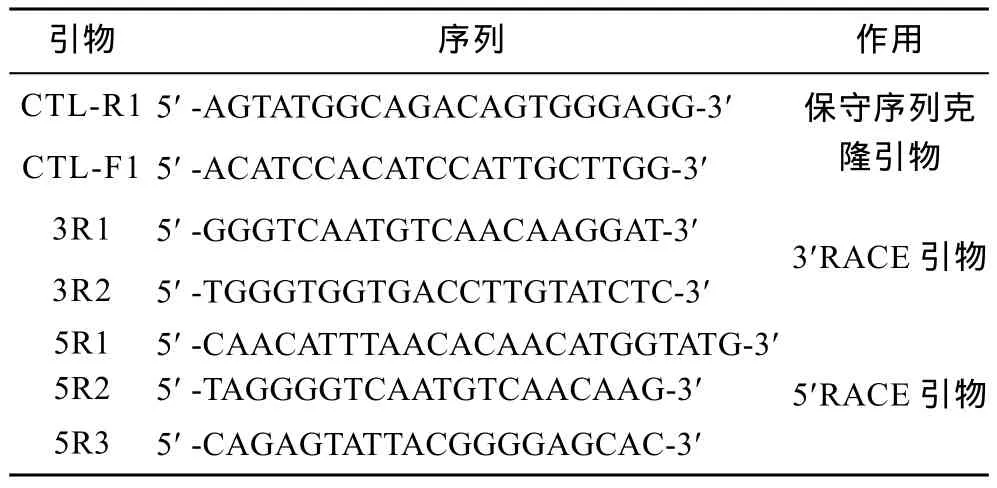
表1 文蛤C-型凝集素基因克隆所用引物及序列Tab. 1 Primers used to clone the C-type lectin gene of M. meretrix
1.3 文蛤总RNA提取及cDNA第一链合成
挑选三只健康文蛤并取肝胰腺组织 20—50mg,采用RNA提取试剂盒(Trizol Reagent, Invitrogen)提取总RNA。使用反转录试剂盒(PrimeScriptTM1st Strand cDNA Synthseis Kit, TaKaRa)将之反转录成cDNA,37 °C反转录15min, 85°C 5s。合成的cDNA产物于–20°C保存以供后续实验使用。
1.4 文蛤C-型凝集素基因克隆
根据文蛤C-型凝集素基因(Mm-CTL)的EST序列设计一对引物CTL-R1和CTL-F1(表1), 以cDNA为模板 PCR 扩增。扩增体系: 超纯水 15.7μL, cDNA 1.0μL, 10×PCR buffer 2.5μL, MgCl21.5μL, dNTP 2.0μL, CTL-R1 1.0μL, CTL-F1 1.0μL, rTaq 0.3μL。反应条件: 94°C 5min, 94°C 30s, 56°C 30s, 72°C 40s, 共35个循环, 72°C延伸10min。扩增产物经过凝胶电泳后, 利用 GenClean 柱式琼脂糖凝胶 DNA回收试剂盒回收目的条带, 与 pMD18T载体连接并转化进大肠杆菌TG1中, PCR检测正确并送至上海英骏生物公司测序。
根据所得序列分别设计3¢RACE和5¢RACE引物(表 1), 按照 3¢-Full RACE Core Set with PrimeScriptTMRTase试剂盒和 5¢-Full RACE Core Set with PrimeScriptTMRTase试剂盒说明书进行扩增。扩增产物进行凝胶电泳确认, 并将出现的条带割胶回收, 回收产物连接转化, PCR检测正确并送样测序。
1.5 生物信息学分析
将拼接后的 Mm-CTL进行生物信息学分析。利用 NCBI 的 ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)程序对所得序列作开放阅读框分析, 预测编码氨基酸序列, 同时利用 Smart (http://smart.embl-heidelberg.de/)预测蛋白的功能域。使用 NCBI的blastn (http://www.ncbi.nlm.nih.gov/)进行氨基酸同源性分析, 用MEGA 4.1软件构建系统进化树。
1.6 感染及环境胁迫实验
制备浓度为107cells/mL的溶藻弧菌菌悬液, 取菌悬液以 1︰100的比例与过滤海水稀释后, 将文蛤放入其中浸染, 对照组采用过滤后海水, 盐度 20, 温度25°C。对照组与实验组同步取样, 分别在0h、6h、12h、24h、48h、72h随机选取每组三只文蛤提取肝胰腺RNA, 反转录成cDNA备用。
将健康的文蛤随机分成6组, 分别放在盐度为5、10、15、20、25、30的海水中 25°C 培养, 12h后每组随机选取3只文蛤提取肝胰腺RNA, 反转录成cDNA备用。
将健康的文蛤随机分成6组, 分别放在温度分别为 10、15、20、25、30、35°C 的海水中(盐度 20)培养, 12h后每组随机选取 3只文蛤提取肝胰腺 RNA,反转录成cDNA备用。
分别以上述所制备的 cDNA 为模板, 以 P-β-ACTIN-F、P-β-ACTIN-R、P-C-F、P-C-R (表 2)为引物进行目的基因和内参基因β-actin的RT-PCR扩增,扩增体系同上。目的基因扩增条件为94°C 5min, 94°C 30s, 55°C 30s, 72°C 30s, 共 35 个循环, 72°C 延伸10min。内参基因扩增条件为 94°C 5min, 94°C 30s,56°C 30s, 72°C 30s, 共 28 个循环, 72°C 延伸 10min。反应重复三次 RT-PCR。将 PCR结果用 1.2%琼脂糖凝胶电泳检测后, 在凝胶成像仪下成像。
2 结果
2.1 文蛤C-型凝集素的基因克隆与生物信息学分析
通过PCR和RACE技术获得Mm-CTL核心序列和3¢端与 5¢端序列, 经过拼接该基因的全长为 1855bp(GenBank序列号: JX232217), 其开放阅读框为519bp,编码172个氨基酸(图1)。利用Smart软件预测蛋白的功能域(图1, 图2)。结果显示, 第34个蛋白到168个蛋白为 Mm-CTL的糖识别结构域(CRD), 该 CRD 含有的参与二硫键形成的 6个保守的半胱氨酸, 分别位于 Cys34、Cys47、Cys64、Cys143、Cys159、Cys167。在CRD区域中找到决定糖结合的特异性序列“EPN”。

图1 文蛤C-型凝集素基因cDNA序列Fig.1 cDNA sequences of C-lectin gene in M. meretrix阴影表示CRD, 曲线下划线表示决定糖结合特异性的序列(EPN)

图2 C-型凝集素预测蛋白结构域Fig.2 Domain analysis on putative C-lectin protein
将拼接后的序列进行同源性比对, 结果显示与日本刺参(Apostichopus japonicus), 青鳉(Oryzias latipes),中国对虾(Fenneropenaeus chinensis), 日本囊对虾(Marsupenaeus japonicus), 长牡蛎(Crassostrea gigas),大竹蛏(Solen grandis)相对应的氨基酸序列相似性分别为 13.5%、13.5%、21.5%、23.2%、23.9%、56.5%(图 3)。
利用MEGA4.1软件对Mm-CTL进行生物信息学分析, 构建进化树, 用 N-J方法进行聚类分析。进化树结果显示(图 4), 不同物种的凝集素各自成簇, 脊椎动物聚在一类, 无脊椎动物聚在一类。从文蛤体内获得的Mm-CTL与大竹蛏(Solen grandis)聚类在一起,与长牡蛎(Crassostrea gigas)进化距离较近。
2.2 环境因子对文蛤C-型凝集素基因表达量变化的影响
2.2.1 弧菌感染对文蛤体内 C-型凝集素基因表达量的影响 在溶藻弧菌刺激下, 文蛤肝胰腺 Mm-CTL表达量变化结果见图5。溶藻弧菌感染6h时表达量明显上升, 在12h时达到最高值, 随后有所下降,72h时趋于稳定并与对照组无明显差异。
2.2.2 盐度变化对文蛤体内 C-型凝集素基因表达量的影响 在不同盐度胁迫下, 文蛤肝胰腺 Mm-CTL表达量变化结果见图 6。在盐度 5时 Mm-CTL表达量比较低, 在盐度10—20范围时Mm-CTL表达量相对较高, 当盐度高于20时, Mm-CTL的表达量反而较低。
2.2.3 温度变化对文蛤体内 C-型凝集素基因表达量的影响 在不同温度胁迫下, 文蛤肝胰腺 Mm-CTL表达量变化结果见图7。在水温25°C以上时, 随着水温的上升表达量明显上升, 水温 25°C以下时,随着温度下降表达量明显下降。35°C时表达量相对最高, 10°C时表达量明显较低。

图3 文蛤C-型凝集素氨基酸序列与其它物种凝集素氨基酸序列的比对Fig.3 Multiple alignments of amino acid sequence of C-lectin of M. meretrix with other known species genes黑色背景表示相同的氨基酸, 灰色背景表示性质相似的氨基酸
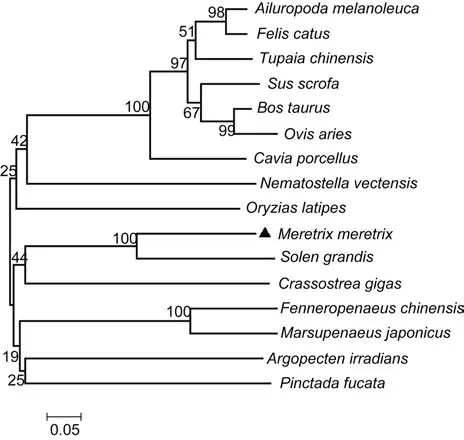
图4 不同物种凝集素氨基酸序列系统进化树Fig.4 The evolutionary tree of lectin amino acid sequence of different species
3 讨论
C-型凝集素是一类钙离子依赖活性的糖蛋白,包含至少一个保守的糖基识别结构域(陈政良, 1997),低等生物的 C-型凝集素基因一般只有一个 CRD, 而其它物种则有的两个或多个CRD (Songet al, 2010)。对于虾类而言, 日本囊对虾已报道的 C-型凝集素基因中均只含 1个 CRD结构域, 罗氏沼虾已报道的 4个C-型凝集素基因中都含2个CRD结构域(Renet al,2012)。中国明对虾和凡纳滨对虾则存在C-型凝集素基因中既有包含1个CRD的又有含2个CRD结构域的情况(Liuet al, 2007; Sunet al, 2008; Weiet al,2012)。合浦珠母贝和栉孔扇贝 C-型凝集素基因中也都包含1个CRD结构域(胡钰婷等, 2011)。本研究中克隆获得的文蛤 C-型凝集素基因和合浦珠母贝和栉孔扇贝相似, 只含1个CRD结构域。CRD结构域中,主要由 2个基序与钙离子共同作用完成对糖基分子的结合, 第一个典型的基序为 EPN或 QPD, 第二个典型的基序为WND。EPN可对甘露糖进行识别, QPD则可识别半乳糖(Drickamer, 1992; Kolatkaret al,1996)。本研究显示, 文蛤 C-型凝集素基因糖基结合位点为 EPN, 表明文蛤 C-型凝集素可能对甘露糖进行识别并结合。
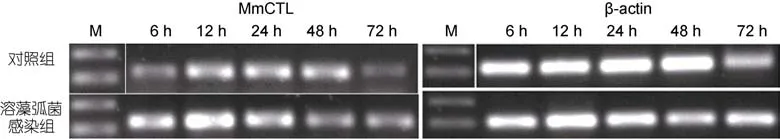
图5 文蛤肝胰腺C-型凝集素在溶藻弧菌刺激后的RT-PCR电泳图Fig.5 RT-PCR electrophoregrams of C-lectin gene in hemocytes of M. meretrix after V. alginolyticus challenge
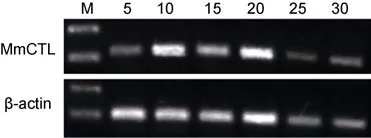
图6 文蛤肝胰腺C-型凝集素基因在不同盐度刺激后的RT-PCR电泳图谱Fig.6 RT-PCR electrophoregrams of C-lectin gene in hemocytes of M. meretrix in different salinities

图7 文蛤肝胰腺C-型凝集素基因在不同温度刺激后的RT-PCR电泳图谱Fig.7 RT-PCR electrophoregrams of C-lectin gene in hemocytes in M. meretrix in different temperatures
贝类具有非特异免疫系统, 免疫系统比较简单,易受外界胁迫影响。在通过先天免疫对病原菌感染的应答过程中, C-型凝集素扮演着重要的作用(Willmentet al, 2008)。吴彪等(2013)用鳗弧菌感染虾夷扇贝后4h表达量显著上升, 8h达到最高峰, 随后下降, 16h后与对照基本无差异。胡钰婷等(2011)在合浦珠母贝C-型凝集素基因研究中, 用溶藻弧菌刺激后的 4h至24 h表达量显著上调。本实验用溶藻弧菌感染文蛤,Mm-CTL在6h时表达量明显上升, 在12h时达到最高值, 随后有所下降, 72h时趋于稳定。说明Mm-CTL的表达量可受微生物刺激而诱导, 也表明 Mm-CTL参与对微生物入侵的免疫应答, 有助于提高文蛤的免疫防御能力。
温度和盐度是影响贝类生长, 摄食, 免疫应答等非常重要的环境因子(Kimet al, 2009)。有研究表明, 贝类病害的爆发与盐度的变化有直接的关系, 这可能与盐度胁迫导致贝类免疫能力下降有关。Cheng等(2004)研究盐度对杂色鲍(Haliotis diversicolor supertexta)免疫能力的影响表明, 当杂色鲍由盐度 30的环境, 转移到盐度20、25和35的环境中时, 其血细胞数量减少,酚氧化酶活力、吞噬活力、呼吸爆破活力和清除副溶血弧菌的能力降低, 杂色鲍容易受到致病菌的侵袭而死亡。盐度变化不仅可以通过影响免疫因子活力的方式来影响机体的免疫能力, 还可以通过影响免疫因子表达量变化来影响机体免疫能力。本实验在研究不同盐度对 Mm-CTL表达量变化时发现, 盐度 10、15和20时Mm-CTL的表达量相对较高。表明盐度在一定的变化幅度内能诱导 Mm-CTL的表达, 起免疫保护作用, 但超出一定范围则免疫功能将受到抑制。
Dang等(2012)的研究发现欧洲鲍螺(Haliotisrubra)在水温由 18°C升至 21°C和 24°C时, 其抗菌活力和抗病毒活力上升, 但长时间胁迫, 会导致欧洲鲍螺抗菌活力和抗病毒活力受到抑制。李晓英等(2009)对青蛤(Cyclina sinensis)的研究表明, 短时间内, 温度骤升能提升青蛤超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力, 但长时间的高温刺激, 反而会抑制两种酶活性。本实验结果显示, 在温度高于25°C时, Mm-CTL的表达量随温度升高明显上升, 表明温度的变化可以诱导文蛤免疫因子的表达, 从而调节免疫反应。
4 结论
本研究从文蛤中克隆到一种 C-型凝集素的基因,通过蛋白序列分析, 发现在 Mm-CTL存在典型的糖基识别结构域。通过表达分析发现, Mm-CTL的表达不仅受到弧菌感染的影响, 同时也受环境温度和盐度变化的影响。由于贝类是一种海洋无脊椎动物, 其免疫系统极有可能对环境的变化做出响应。本研究结果将为贝类先天性免疫因子表达的调控以及贝类病害的防控奠定基础。
于金红, 潘鲁青, 2013. 三疣梭子蟹C-型凝集素的原核表达和活性检测. 渔业科学进展, 34(5): 58—63
李晓英, 沈睿杰, 董志国等, 2009. 温度骤升和窒息胁迫对青蛤抗氧化酶活性的影响. 中国饲料, 20(1): 39—42
吴 彪, 迟长凤, 杨爱国等, 2013. 虾夷扇贝 C-型凝集素母源传递与抑菌作用的初步研究. 水产学报, 37(5): 777—783
陈政良, 1997. 哺乳类 C-型凝集素超级家族. 生物化学与生物物理展, 24(6): 491—496
罗 展, 张继泉, 李富花等, 2010. 凡纳滨对虾 C-型凝集素LvLec2对不同刺激的免疫应答. 海洋科学, 34(11):103—110
胡钰婷, 张殿昌, 崔淑歌等, 2011. 合浦珠母贝 C-型凝集素基因的序列特征和功能分析. 水产学报, 35(9): 1327—1336
Cheng W, Juang F M, Hsu C H, 2004. The immune response of Taiwan abaloneHaliotis diversicolorsupertextaand its susceptibility toVibrio parahaemolyticusat different salinity levels. Fish & Shellfish Immunology, 16(3): 295—306
Dang V T, Speck P, Benkendorff K, 2012. Influence of elevated temperatures on the immune response of abalone,Haliotis rubra. Fish & Shellfish Immunology, 32(5): 732—740
Drickamer K, 1992. Engineering galactose-binding activity into a C-type mannose-binding protein. Nature, 360(6400):183—186
Han L L, Yuan Z, Dahms H Uet al, 2012. Molecular cloning,characterization and expression analysis of a C-type lectin(AJCTL) from the sea cucumberApostichopus japonicus.Immunology Letters, 143(2): 137—145
Janeway C A Jr, Medzhitov R, 2002. Innate immune recognition.Annual Review of Immunology, 20(1): 197—216
Kim M, Ahn I Y, Cheon Jet al, 2009. Molecular cloning and thermal stress-induced expression of a pi-class glutathione S-transferase (GSP) in the Antarctic bivalveLaternulaelliptica. Comparative Biochemistry and Physiology, Part A:Molecular & Integrative Physiology, 152(2): 207—213
Kolatkar A R, Weis W I, 1996. Structural basis of galactose recognition by C-type animal lectins. The Journal of Biological Chemistry, 271(12): 6679—6685
Liu Y C, Li F H, Dong Bet al, 2007. Molecular cloning,characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimpFenneropenaeus chinensis. Molecular Immunology, 44(4): 598—607
Ren Q, Li M, Du Jet al, 2012. Immune response of four dual-CRD C-type lectins to microbial challenges in giant freshwater prawnMacrobrachium rosenbergii. Fish &Shellfish Immunology, 33(2): 155—167
Song X Y, Zhang H, Wang L Met al, 2010. An immune responsive multidomain galectin from bay scallopArgopectens irradians. Fish & Shellfish Immunology, 28(2):326—332
Sun Y D, Fu L D, Jia Y Pet al, 2008. A hepatopancreas-specific C-type lectin from the Chinese shrimpFenneropenaeus chinensisexhibits antimicrobial activity. Molecular Immunology, 45(2): 348—361
Tamplin M L, Fosher W S, 1989. Occurrence and characteristics of agglutination ofVibrio choleraeby serum from the eastern oyster,Crassostrea virginica. Applied and Environmental Microbiology, 55(11): 2882—2887
Vasta G R, Ahmed H, Du S Jet al, 2004. Galectins in teleost fish:Zebrafish (Danio rerio) as a model species to address their biological roles in development and innate immunity.Glycoconjugate Journal, 21(8—9): 503—521
Wang H, Song L S, Li C Het al, 2007. Cloning and characterization of a novel C-type lectin from Zhikong scallopChlamys farreri. Molecular Immunology, 44(5):722—731
Wei X M, Liu X Q, Yang J Met al, 2012. Two C-type lectins from shrimpLitopenaeus vannameithat might be involved in immune response against bacteria and virus. Fish &Shellfish Immunology, 32(1): 132—140
Willment J A, Brown G D, 2008. C-type lectin receptors in antifungal immunity. Trends Microbiology, 16(1): 27—32
Zhang H, Wang H, Wang L Let al, 2009a. Cflec-4, a multidomain C-type lectin involved in immune defense of Zhikong scallopChlamys farreri. Developmental and Comparative Immunology, 33(6): 780—788
Zhang Y, Qiu L M, Song L Set al, 2009b. Cloning and characterization of a novel C-type lectin gene from shrimpLitopenaeus vannamei. Fish & Shellfish Immunology, 26(1):183—192
Zhu L, Song L S, Xu Wet al, 2008. Molecular cloning and immune responsive expression of a novel C-type lectin gene from bay scallopArgopecten irradians. Fish & Shellfish Immunology, 25(3): 231—238

