不同氮浓度下盐胁迫对坛紫菜(Pyropia haitanensis)生长和光合作用的影响*
吴海一 丁 刚 徐智广①
(1. 山东省海洋生物研究院 青岛 266104; 2. 青岛市大型海藻工程技术研究中心 青岛 266104)
坛紫菜(Pyropia haitanensis)属于红藻门(Rhodophyta)、原红藻纲(Protoflorideae)、红毛菜目(Bangiales)、红毛菜科(Bangiaceae)、紫菜属(Pyropia), 是中国南方海域重要的大型经济海藻, 由于在食品、纺织、医药等行业的广泛应用, 其人工养殖面积和规模越来越大, 成为南方海藻栽培的主要品种之一(Fei, 2004)。坛紫菜生活于南方暖温海域潮间带, 在干出和沉水的交替过程中, 经历着光照、盐度、温度以及碳、氮营养等环境因子的剧烈变化, 而这些环境条件的频繁变动,往往对坛紫菜生理特性产生或正或负的影响, 成为该藻正常生长的促进或胁迫因子。已有的研究表明:坛紫菜的生长和光合作用被高温胁迫(王淑刚等,2013)、紫外线辐射(姜红霞等, 2009; 徐军田等, 2013)以及高浓度氨氮(秦梅等, 2014)所抑制; 提高 CO2的浓度水平不仅提高该藻的生长速率和光合固碳, 还能够缓解紫外线(徐军田等, 2013)和氨氮(秦梅等,2014)的负面影响; 氮、磷营养盐的浓度水平对坛紫菜的生长和光合色素合成也能够产生直接影响(柳佩娟等, 2009)。
盐度是影响藻类生理活动的一个重要环境因子。在不同的分布区域, 海水的盐度存在着很大的差异,外海的盐度一般在34—37, 在河口区, 由于河流淡水的注入, 盐度随着淡水注入的规律出现一定的日变动和季节变动, 通常在 20—22左右浮动。潮间带是一个特殊的区域, 生长在潮间带的海藻所处的盐度环境变化十分频繁, 蒸发会使海藻周围的海水盐度升高, 而降雨会导致盐度的下降, 这些过程在退潮时更加明显, 尤其是生长在高潮带的海藻, 其生长环境盐度变化在10—77 (Gessneret al, 1971)。一般来讲,大型藻类的生长都有适宜的盐度范围, 过高或过低的盐度都会对其生理过程造成胁迫。已有的研究表明,盐度胁迫下, 绿藻门石莼(Xiaet al, 2004)、红藻门长心卡帕藻(黄园等, 2010)和刺枝鱼栖苔(丁兰平等,2013)以及褐藻门鼠尾藻(梁洲瑞等, 2011)的生长和光合作用都受到了明显的抑制。与此同时, 在长期适应中, 大型海藻可以通过调节抗氧化系统等生理过程来保护自身免于盐度胁迫带来的负面压力(周亚维等,2010; 马兴宇等, 2014), 这些保护机制的运转效率在一定条件下往往会受到氮、光照、pH值等环境因子的调节(Liuet al, 2007), 从而盐度胁迫与这些因子一起协同影响大型海藻的生长与光合生理。
坛紫菜是一种广盐性海藻, 适宜栽培的海区较广。为了向河口区扩大其栽培面积, 国内学者围绕耐低盐品种的筛选开展了部分工作(陈昌生等, 2009; 檀应华等, 2014), 但关于盐度胁迫下该藻的光合响应目前仍未见报道。而除了在干出与沉水交替过程中面临的盐度剧烈变化, 作为修复中国南方近海富营养化的推荐品种(Fei, 2004), 人工栽培的坛紫菜将可能长期处于高氮营养的富营养化条件。本研究立足于此,通过探讨不同氮浓度下盐度胁迫对坛紫菜生长和光合作用的影响, 揭示氮在坛紫菜应对盐度胁迫中的作用, 以期为坛紫菜的人工栽培和利用其对富营养化海区的修复功能提供理论参考。
1 材料与方法
1.1 材料
坛紫菜(Pyropia haitanensis)采自广东省南澳县深澳湾养殖筏架, 采集后放于低温箱(5°C)于2 h内运到实验室。采集回的紫菜叶状体用自然海水洗净, 选择健康一致的个体用锋利的剪刀剪成 2cm×5cm的片段, 在实验室内用自然海水暂养 24 h用于后续实验。自然海水的盐度30; 无机氮浓度50 μmol/L; 无机磷浓度 0.8 μmol/L。暂养条件如下: 温度 20°C; 光照强度80μmol photons/(m2s); 光周期L︰D=12︰12;连续充气。
1.2 盐度和氮浓度设计
暂养后的坛紫菜叶状体片段分别在不同的盐度和氮营养条件下适应培养。盐度设置3个梯度: 15、30和45, 氮设置2个浓度梯度: 低氮(L-N, 50 μmol/L)和高氮(H-N, 500 μmol/L)。培养基使用PES加富的人工海水(Provasoli, 1968), 其中不同盐度通过蒸馏水和 NaCl调节, 不同氮浓度通过向培养基添加硝酸盐获得, 不同处理的无机磷浓度都添加至 50 μmol/L,以保证藻体不受到磷营养的限制。光照和温度同暂养条件, 不间断充气, 隔天换水。适应培养7 d后分别测定不同盐度和氮条件下藻体的生长和光合作用等生理指标。
1.3 生长测定
分别称量藻体的初始湿重(W0)和t天后湿重(Wt),通过公式: RGR = ln(Wt/W0) ×t–1×100 计算叶状体的日相对生长速率(Relative growth rate, RGR), 其中t为培养时间(单位为d)。
1.4 干鲜比的获得
在实验结束时, 称量各个处理组藻体湿重(Fresh weight, FW), 测量前用吸水纸吸干藻体表面的水分,用电子天平(TP-114, Denver Instrument, USA)称量。称量完湿重的藻体, 置于 70°C 烘箱(202, 上海树立仪器仪表有限公司)烘干至恒重后称量干重(Dry weight, DW)。计算得到干重占鲜重的百分比。
1.5 光合放氧速率测定
光合放氧速率采用氧电极法测定。测定时, 取待测藻体样品, 剪成 1cm×1cm 的片段, 分别在原培养条件下恢复培养1h左右以避免机械损伤对光合作用的影响。称取约 0.1g左右湿重的片段, 置于氧电极(Chlorolab3, Hansatech, UK)反应杯中, 加入8 mL反应介质溶液, 盖上反应杯, 打开光照, 适应 5 min待放氧稳定, 记录光合放氧速率。氧电极反应杯温度以恒温循环器(DTY-5A, 北京德天佑科技发展有限公司)控制在20°C, 光源用碘钨灯提供, 光强设定为80 μmol photons/(m2s), 反应介质溶液分别使用不同盐度和氮条件培养所配制的人工海水。
1.6 快速光反应曲线的获得
取不同条件下培养7 d后的活体材料, 通过叶绿素荧光仪(WATER-PAM, Walz, Germany)直接测定不同光强(I)下活体光系统Ⅱ的相对电子传递速率(rETR),光强设置 148, 224, 335, 505, 750, 1070, 1482和2388μmol photons/(m2s) 8个梯度。相对电子传递速率-光强曲线(rETR-Icurve), 即快速光反应曲线通过以下公式拟合(Eilerset al, 1998): rETR =I/ (aI2+bI+c),式中a为光抑制项值, 代表着藻体电子传递在高光强下的受抑制程度。光饱和点(Ik)、电子传递效率(α, 即快速光反应曲线的初始斜率)和最大相对电子传递速率(rETRmax)分别通过以下公式计算得到:Ik= (c/a)0.5;α = 1/c; rETRmax= 1 / [b+ 2(ac)0.5]。
1.7 光合色素的含量测定
叶绿素a(Chla)和类胡萝卜素(Car)含量测定参照Jensen(1978)的方法。称取0.1 g湿重(FW)的藻体,用丙酮研磨, 定容至10 mL提取5h, 离心取上清液测定波长450nm、666nm和730nm处的吸光值。通过如下公式计算含量: Chla= (OD666-OD730)×V×10/(890×FW); Car = OD450×V×10/(2500×FW)。其中, OD为吸光值,V为定容后的溶液体积(单位为mL), FW为藻体湿重(单位为g)。
藻蓝蛋白(PC)和藻红蛋白(PE)含量测定参照Siegelman等(1978)的方法。称取0.1 g湿重(FW)的藻体, 用0.1mol/L的磷酸缓冲液研磨, 定容至10 mL提取 5h, 离心取上清液测定波长 455、564、592、618和645nm处的吸光值。通过如下公式计算含量: PE =[(OD564-OD592)-(OD455-OD592) × 0.2] × 0.12 ×V/FW;PC = [(OD618-OD645)-(OD592-OD645) × 0.2] × 0.15 ×V/FW。其中, OD为吸光值,V为定容后的溶液体积(单位为mL), FW为藻体湿重(单位为g)。
以PC和PE含量之和除以Chla的含量, 得到藻胆蛋白与Chla的含量比值。
1.8 统计分析
所有的测定结果表示为平均值±标准差(n≥3),用单因素方差分析(One way ANOVA, Tukey)进行统计差异性分析, 以P=0.05作为差异的显著性水平。
2 结果
2.1 生长与干鲜比
坛紫菜在不同的氮和盐度条件下适应培养7d后,测定不同处理下叶状体的日相对生长速率, 结果见图1所示。在低氮条件下, 随着盐度的增加, 藻体的生长速度显著加快(P<0.05); 但在高氮条件下, 藻体在 30的盐度时(接近养殖海区自然海水盐度)生长速率最大, 过高和过低的盐度都显著降低生长速率(P<0.05)。另一方面, 在不同的盐度下, 氮浓度对藻体的生长产生了不同的影响。在 30的盐度下, 高氮培养显著促进了叶状体的生长(P<0.05), 而在过高(45)或过低(15)的盐度胁迫下, 高氮与低氮处理之间没有显著性差异(P>0.05)。
不同条件适应培养后的坛紫菜, 干鲜比除了在高氮下盐度 15和 30之间未发现显著差异(P>0.05),其总的趋势表现为随着盐度的增加而升高(图 2)。氮的浓度在盐度 15和 30条件下对干鲜比无显著影响(P>0.05), 但在盐度45时, 高氮培养的藻体干鲜比低于低氮条件(P<0.05)。
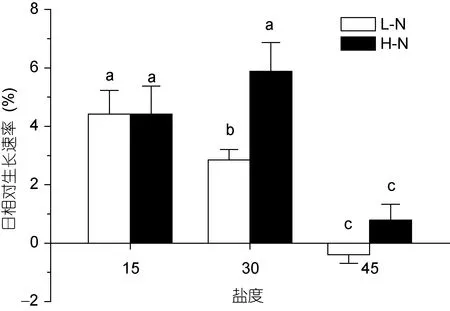
图1 不同培养条件下坛紫菜的生长速率Fig.1 Growth rate of P. haitanensis cultured under different conditions不同的小写字母代表处理间具有显著性差异(P<0.05)
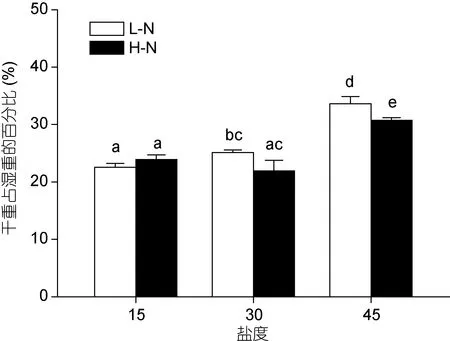
图2 不同培养条件下坛紫菜的干鲜比Fig.2 Ratio of DW/FW in P. haitanensis cultured under different conditions不同的小写字母代表处理间具有显著性差异(P<0.05)
2.2 光合色素
不同氮和盐度培养对坛紫菜色素含量的影响如图3所示。在低氮条件下, 高盐胁迫(45)对藻体的Chla、Car、PE和 PC都没有显著影响(P>0.05), 而低盐培养(15)则提高了这四种光合色素的含量(P<0.05)。在高氮条件下, 盐度胁迫没有改变坛紫菜 Chla和Car的含量(P>0.05), 但高盐和低盐胁迫都使得藻体PE和PC含量降低, 虽然这种降低在15盐度的PC含量中并不显著(P>0.05)。总体来说, 无论坛紫菜培养于何种盐度条件, 高氮处理都促进了四种光合色素的合成, 但在低盐(15)胁迫时, 高氮对Car和PC的含量没有产生显著的影响(P>0.05)。
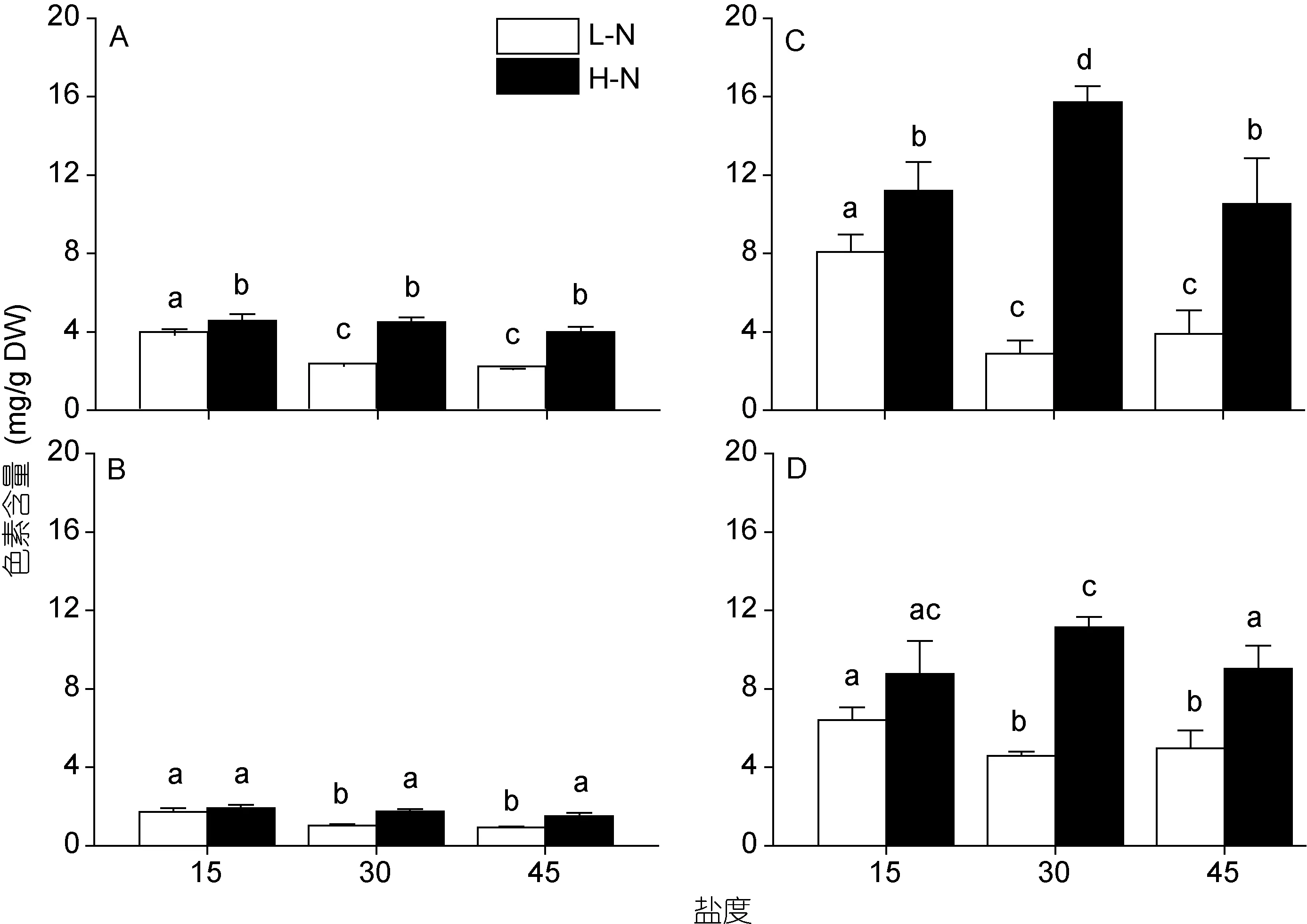
图3 不同培养条件下坛紫菜的色素含量Fig.3 Contents of pigments in P. haitanensis cultured under different conditionsA. 叶绿素a; B. 类胡萝卜素; C. 藻红蛋白; D. 藻蓝蛋白。不同小写字母代表处理间具有显著性差异(P<0.05)
藻胆蛋白与Chla的含量比值几乎没有受到盐度条件的影响, 除了在高氮条件下相比于 30的盐度,低盐处理降低了这一比值(图 4)。在接近自然海水的30盐度下, 高氮培养显著提高了藻胆蛋白与Chla的含量比值(P<0.05), 但这种提高在低盐和高盐胁迫时都没有出现(图4)。

图4 不同培养条件下坛紫菜藻胆蛋白与叶绿素a的含量比Fig.4 Ratio of phycobiliproteins to Chl a in P. haitanensis cultured under different conditions不同的小写字母代表处理间具有显著性差异(P<0.05)
2.3 光合作用
不同氮和盐度条件下培养的坛紫菜快速光反应曲线如图5所示。不管在低氮还是高氮条件下, 盐度胁迫对藻体的电子传递效率(α)、最大相对电子传递速率(rETRmax)和光饱和点(Ik)都没有显著影响(P>0.05,表1), 但光抑制项值却受到盐度不同程度的影响: 高盐胁迫显著提高了光抑制项值(P<0.05), 而低盐胁迫对其没有显著影响(P>0.05)。在相同盐度下, 高氮培养能够显著降低光抑制项值(P<0.05), 并提高 rETRmax和Ik的值(P<0.05), 而对α没有显著影响(P>0.05)。
图6显示了不同处理的单位湿重和单位叶绿素a的光合放氧速率。单位湿重的放氧速率在高氮、盐度30的处理中出现最低值, 而在其它5组处理中未发现显著差异(P>0.05)。低盐和高盐胁迫对单位叶绿素a的放氧速率都没有显著影响(P>0.05)。氮的影响在不同盐度中表现不同: 低盐 15中, 高氮和低氮之间没有显著差异(P>0.05); 盐度30和45的处理中, 高氮培养显著提高了藻体的光合放氧速率(P<0.05)。
3 讨论
大型海藻的生长是一个复杂的生理过程, 与碳、氮代谢密切相关, 因而能够改变光合固碳和氮吸收的环境因子变化常常对大型海藻生长产生或正或负的影响。已有的研究表明: 高光强或紫外辐射能够通过对光合固碳的光抑制来降低海藻的生长速率(Xuet al, 2009), 而氮的加富则通过减轻光抑制来缓解紫外线对生长的负面影响(Zhenget al, 2009); 高浓度的CO2培养虽促进海藻光合固碳, 但由于不同的磷营养供应水平影响了氮的吸收, 从而使高 CO2浓度对生长的影响表现出多样化效应(Xuet al, 2010)。可见,在海藻处在环境压力时, 氮、磷营养盐的供应可以通过调节其它生理过程而改变胁迫因子对生长的效应。本研究中, 低氮条件下, 虽然盐度对坛紫菜的光合固碳没有产生影响, 但生长速率却随着盐度增加而降低, 这与丁兰平等(2013)对红藻刺枝鱼栖苔(Acanthophora spicifera)的研究结果相似, 其原因可能是盐度通过影响氮的吸收(钱鲁闽等, 2006)来间接影响藻体的生长。本研究中重要氮同化产物藻胆蛋白的含量随着盐度增加而降低, 这与坛紫菜生长受盐度影响的趋势基本一致, 也恰恰验证了这一点。本研究中, 在高氮条件下, 不仅较高盐度下藻体的光合速率较高, 同时藻胆蛋白的含量和藻胆蛋白/Chla比值在盐度30时达到最大, 而坛紫菜的最大生长速率也出现在盐度 30的培养条件。藻胆蛋白是红藻门海藻体内的重要氮库,当海藻在氮源充足条件下生长时会把所吸收的多余氮以藻胆蛋白的形式储存(Kursaret al, 1983)。徐智广等(2008)在对龙须菜的研究中发现, 在不同氮和 CO2浓度培养下的龙须菜, 其生长速率与藻胆蛋白的含量呈现了较好的正相关关系, 本研究中对坛紫菜的研究结果也验证了这一现象, 这可能是海藻氮同化与光合固碳过程互相平衡后在生长上的综合体现。
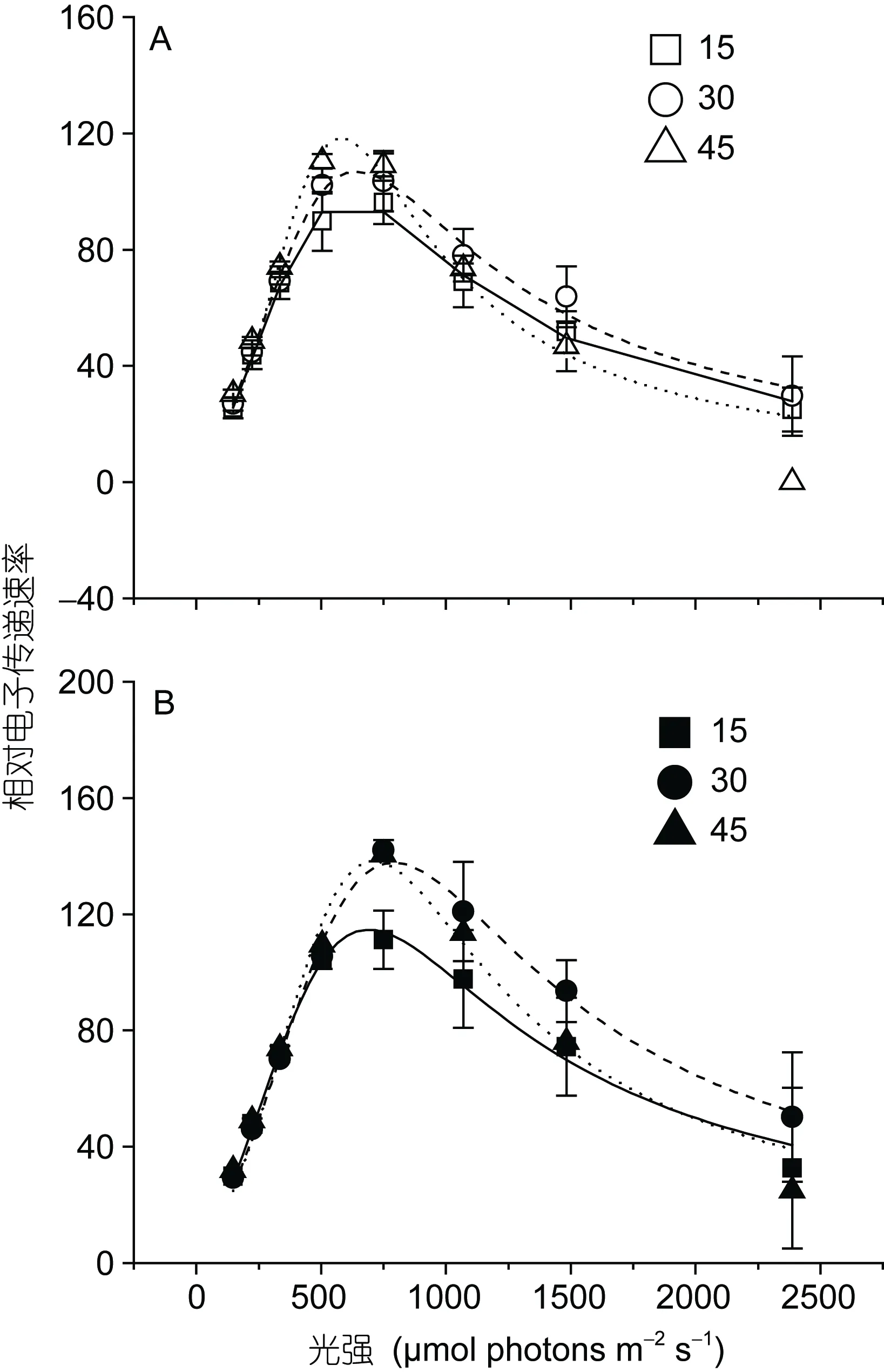
图5 不同培养条件下坛紫菜的快速光反应曲线Fig.5 Rapid light response curve of P. haitanensis cultured under different conditions A. 低氮条件; B. 高氮条件
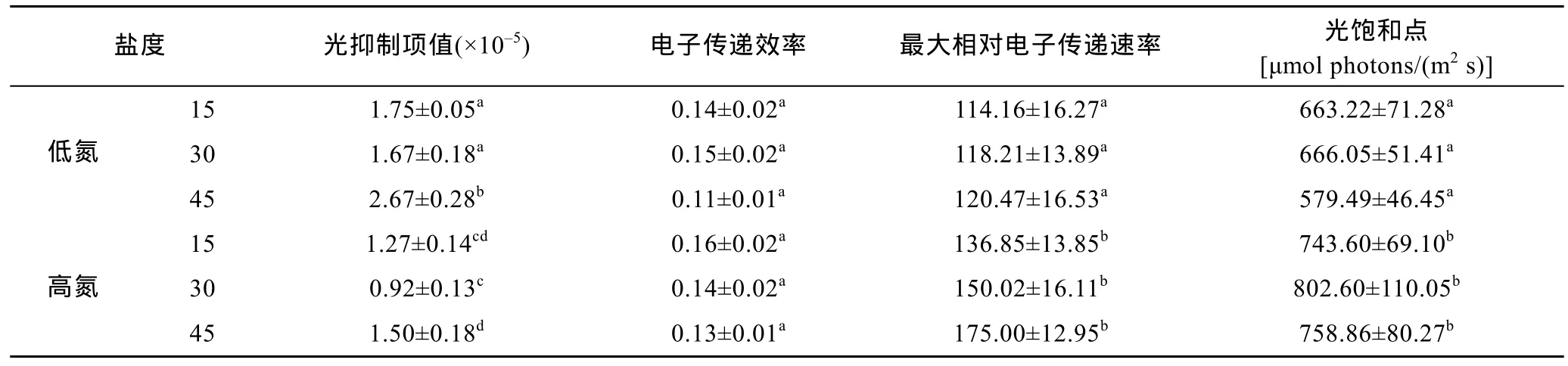
表1 快速光反应曲线相关参数Tab.1 Parameters of rapid light response curve of P. haitanensis cultured under different conditions
本研究中, 在低氮条件下, 高盐条件下坛紫菜的Chla、Car和藻胆蛋白的含量较低。盐度胁迫能够破坏植物叶绿体膜结构, 从而降低叶绿素在植物体内的含量(张娟等, 2008), 这种对叶绿素含量的降低作用在其它海藻种类中也得到了验证(Dhiabet al, 2007;丁兰平等, 2013)。藻胆蛋白PE和PC的含量随盐度升高而降低, 可能由于高盐胁迫能够抑制其合成或促进其分解(Chenet al, 2012)。Car是海藻中一类重要的光保护色素, 能够作为抗氧化剂清除活性氧, 在环境胁迫时起到保护其它光合器官的作用(韩博平等,2003)。盐度胁迫时 Car可能在抗氧化作用中伴随自身的降解而导致其含量下降。与低氮条件下不同, 本研究高氮条件下, 盐度对Chla和Car含量的影响被氮加富的效果所掩盖, 而藻胆蛋白PE和PC的含量在30盐度最大。这可能是由于在低盐和高盐胁迫中, 藻体的抗氧化及损伤修复等过程耗费了多余的氮, 而30盐度为坛紫菜生长的较适宜盐度, 多余的氮可以在体内储存或用于生长。
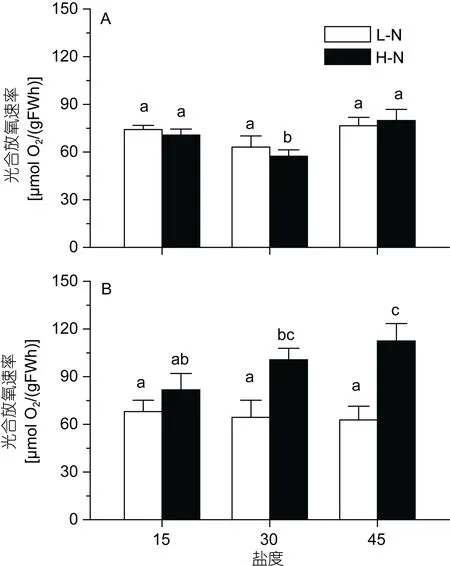
图6 不同培养条件下坛紫菜的光合放氧速率Fig.6 Photosynthetic O2 evolution rate in P. haitanensis cultured under different conditions不同的小写字母代表处理间具有显著性差异(P<0.05)。A. 单位湿重的光合放氧速率; B. 单位叶绿素a的光合放氧速率
快速光反应曲线是藻类光系统Ⅱ(PSII)电子传递速率对光强变化的快速响应曲线, 而电子传递速率与海藻细胞的固碳、放氧过程密切相关(Figueroaet al,2003), 因而, 快速光反应曲线是用来反映藻类光合作用变化的快速、有效的指标。在本研究中, 两种氮条件下高盐胁迫都使得坛紫菜快速光反应曲线的光抑制项值显著升高, 说明高盐胁迫导致了海藻对光照的敏感性增强, 其光合作用光反应过程更容易受到光抑制。Xia等(2004)在对石莼(Ulva lactuca)的研究中也发现高盐胁迫导致 PSII反应中心的失活和电子传递是受阻。事实上, 很多研究已经证实PSII是高盐胁迫的主要作用位点, 高浓度的 Na+通过降解反应中心的 D1蛋白或改变水氧复合体的结构来实现对PSII的损伤(Sudhiret al, 2004)。值得一提的是, 本研究中盐度胁迫对坛紫菜电子传递的影响与对光合放氧的影响并不一致, 这可能由于藻类光合作用的光反应过程对胁迫因子的响应更加敏感, 而暗反应则是电子传递后固碳、放氧的综合过程, 在受到环境胁迫时由于自身的调节作用而显得相对稳定(Figueroaet al, 2003)。
4 结论
坛紫菜是中国特有的人工栽培海藻品种, 在南方沿海广泛栽培, 也因此成为了缓解近海富营养化的重要养殖品种之一(Fei, 2004)。我国南方的河口资源非常丰富, 但由于淡水注入常使得河口区处于氮富营养化状态, 同时河口区的盐度通常维持在 20—22左右(陈昌生等, 2009), 因此, 氮营养盐水平和盐度成为河口区与其它坛紫菜养殖区主要的两个差别因子。本研究立足于此, 通过对两个环境因子的耦合效应研究, 发现高盐度对坛紫菜的生长和光合作用具有明显的抑制作用, 而氮的加富对这种抑制没有显著的减轻; 低盐度对该藻的生长和光合作用没有抑制, 甚至在低氮条件下表现出对生长的促进作用。这些研究结果不仅为坛紫菜栽培及其富营养化修复功能提供了一定参考, 而且从理论上支持了坛紫菜在河口区栽培的可行性。
丁兰平, 孙国栋, 黄冰心等, 2013. 温度和盐度对刺枝鱼栖苔(Acanthophora spicifera)(红藻门, 松节藻科)生长及其几种光合色素的影响. 海洋与湖沼, 44(4): 913—918
马兴宇, 刘福利, 梁洲瑞等, 2014. pH与盐度胁迫对鼠尾藻光合作用及抗氧化系统的影响. 上海海洋大学学报, 23(2):208—214
王淑刚, 杨 锐, 周新倩等, 2013. 高温胁迫下坛紫菜(Pyropia haitanensis)对无机碳的利用. 海洋与湖沼, 44(5):1378—1385
张 娟, 姜闯道, 平吉成, 2008. 盐胁迫对植物光合作用影响的研究进展. 农业科学研究, 29(3): 74—80
陈昌生, 纪德华, 谢潮添等, 2009. 坛紫菜耐低盐品系的选育及经济性状的比较. 集美大学学报(自然科学版), 14(1):1—7
周亚维, 焉婷婷, 李朋富等, 2010. 盐度胁迫下盐生隐杆藻抗氧化防御系统的变化. 海洋科学, 34(9): 30—35
柳佩娟, 纪德华, 谢潮添等, 2009. 坛紫菜耐低氮磷品系选育的研究. 集美大学学报(自然科学版), 14(2): 109—114
姜红霞, 高坤山, 2009. 干出和紫外辐射对坛紫菜光合作用的影响. 自然科学进展, 19(8): 835—840
秦 梅, 陈斌斌, 邹定辉, 2014. 大气 CO2浓度升高缓解高浓度NH4+对坛紫菜(Porphyra haitanensis)生理特性的胁迫作用. 生态科学, 33(5): 832—838
钱鲁闽, 徐永健, 焦念志, 2006. 环境因子对龙须菜和菊花心江蓠 N、P 吸收速率的影响. 中国水产科学, 13(2):257—262
徐军田, 高坤山, 2013. CO2升高和阳光紫外辐射对坛紫菜生长和光合特性的耦合效应. 海洋学报, 35(5): 184—190
徐智广, 邹定辉, 张 鑫等, 2008. CO2和硝氮加富对龙须菜(Gracilaria lemaneiformis)生长、生化组分和营养盐吸收的影响. 生态学报, 28(8): 3752—3759
黄 园, 刘建国, 庞 通等, 2010. 盐度降低对长心卡帕藻原初光化学反应的影响. 海洋学报, 32(3): 146—152
梁洲瑞, 王飞久, 孙修涛等, 2011. 利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响. 海洋科学, 35(12):21—27
韩博平, 韩志国, 付 翔, 2003. 藻类光合作用机理与模型.北京: 科学出版社, 114—115
檀应华, 黄林彬, 严兴洪, 2014. 坛紫菜耐低盐品系的选育与特性分析. 海洋与湖沼, 45(3): 504—512
Chen M, Tang Y L, 2012. Investigation on the detrimental effects of salt stress on photosynthesis ofSpirulina platensis.Agricultural Science & Technology, 13(8): 1625—1627,1770
Dhiab R B, Ouada H B, Boussetta Het al, 2007. Growth,fluorescence, photosynthetic O2production and pigment content of salt adapted cultures ofArthrospira(Spirulina)platensis. Journal of Applied Phycology, 19(4): 293—301
Eilers P H C, Peeters J C H, 1988. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton. Ecological Modelling, 42(3—4): 199—215
Fei X G, 2004. Solving the coastal eutrophication problem by large scale seaweed cultivation. Hydrobiologia, 512(1—3):145—151
Figueroa F L, Conde-Álvarez R, Gómez I, 2003. Relations between electron transport rates determined by pulse amplitude modulated chlorophyll fluorescence and oxygen evolution in macroalgae under different light conditions.Photosynthesis Research, 75(3): 259—275
Gessner F, Schramm W, 1971. Salinity: Plants. In: Kinne O ed.Marine Ecology. London: Wiley, 705—802
Jensen A, 1978. Chlorophylls and carotenoids. In: Hellebust J A,Craigie J S eds. Handbook of Phycological Methods:Physiological and Biochemical Methods. London, New York,Melbourne: Cambridge University Press: 61—69
Kursar T A, Alberte R S, 1983. Photosynthetic unit organization in a red alga: relationships between light-harvesting pigments and reaction centers. Plant Physiology, 72(2):409—414
Liu W H, Au D W T, Anderson D Met al, 2007. Effects of nutrients, salinity, pH and light: dark cycle on the production of reactive oxygen species in the algaChattonella marina.Journal of Experimental Marine Biology and Ecology,346(1—2): 76—86
Provasoli L, 1968. Media and prospects for the cultivation of marine algae. In: Watanabe A, Hattori A eds. Cultures and Collections of Algae, Proceedings of United States and Japan Conference, Hakone. Tokyo, Japan: Japan Society of Plant Physiology, 63—75
Siegelman H W, Kycia J H, 1978. Algal biliproteins. In:Hellebust J A, Craigie J S eds. Handbook of Phycological Methods: Physiological and Biochemical Methods. London:Cambridge University Press: 71—79
Sudhir P, Murthy S D S, 2004. Effects of salt stress on basic processes of photosynthesis. Photosynthetica, 42(2):481—486
Xia J R, Li Y J, Zou D H, 2004. Effects of salinity stress on PSII inUlva lactucaas probed by chlorophyll fluorescence measurements. Aquatic Botany, 80(2): 129—137
Xu Z G, Gao K S, 2009. Impacts of UV radiation on growth and photosynthetic carbon acquisition inGracilaria lemaneiformis(Rhodophyta) under phosphorus-limited and replete conditions. Functional Plant Biology, 36(12): 1057—1064
Xu Z G, Zou D H, Gao K S, 2010. Effects of elevated CO2and phosphorus supply on growth, photosynthesis and nutrient uptake in the marine macroalgaGracilaria lemaneiformis(Rhodophyta). Botanica Marina, 53(2): 123—129
Zheng Y Q, Gao K S, 2009. Impacts of solar UV radiation on the photosynthesis, growth, and UV-absorbing compounds inGracilaria lemaneiformis(Rhodophyta) grown at different nitrate concentrations. Journal of Phycology, 45(2): 314—323

