细胞穿膜肽转导大型海藻及对其光合作用的影响*
韦一凡 郇 丽 牛建峰 何林文 黄爱优张宝玉 林阿朋 王广策①
(1. 实验海洋生物学重点实验室 中国科学院海洋研究所 青岛 266071; 2. 中国科学院大学 北京 100049)
细胞穿膜肽(cell penetrating peptides, CPPs), 也称为蛋白转导域, 是一种可以自发跨膜进入细胞的多肽(Lindgrenet al, 2000)。这种蛋白跨膜转导现象最初是在研究 HIV-1病毒上的 Tat蛋白时被发现的(Frankelet al, 1988)。CPPs能够介导荧光素、GFP、DNA、siRNA以及质粒等进入细胞, 该方法已经被广泛应用在动物细胞的研究方面(Guptaet al, 2005;Turneret al, 2005; Crombezet al, 2008)。目前CPPs关于植物细胞的应用较少(Parket al, 2000; Mäeet al,2005; Chughet al, 2009)。在藻类方面, 现有的CPPs研究主要集中在微藻(Liuet al, 2008; Hymanet al,2012; Sureshet al, 2013)。Hyman 等(2012)应用细胞穿膜肽八聚精氨酸和九聚精氨酸, 成功地将小分子、蛋白质以及酶转导入野生型的莱茵衣藻。与传统的外源物质转导方法(如基因枪法)相比, 应用细胞穿膜肽不仅能够避免制备原生质体, 而且还具有操作简易、可规模化、不会造成细胞物理损伤等优点。然而, 如今尚不清楚已成功应用于微藻的CPPs是否能够同样应用于大型海藻。大型海藻与微藻的结构有很大区别,前者具有更厚的细胞壁, 多糖等成分含量更加丰富,细胞壁结构也更复杂(Popperet al, 2011)。有些大型海藻如海带(Laminaria japonica)富含胶质, 对外源物质的转入有更强的阻碍作用。目前还未见CPPs应用于大型海藻的相关报道。
作者选取三种具有代表性的大型海藻, 分别是浒苔(Ulva prolifera)、紫菜(Porphyra yezoensis)和海带(Laminaria japonica), 应用细胞穿膜肽九聚精氨酸(R9)对其进行细胞穿膜实验。结果显示九聚精氨酸可以高效的共价连接荧光素导入三种大型海藻细胞。与此同时, 对细胞穿膜肽处理后的三种大型海藻进行光合作用效率的检测, 结果表明细胞穿膜肽 R9对三种大型海藻的光合效率均无影响。因此, 对于大型海藻来说, 细胞穿膜肽是一种安全高效的分子手段。
1 材料与方法
1.1 材料
本实验中的大型海藻材料(浒苔、条斑紫菜叶状体、条斑紫菜丝状体、海带孢子体、海带雌雄配子体)均来自于实验室培养。培养温度为18°C, 光照为60 μmol photons/(m2·s), 光暗周期设为 12h︰12h。
细胞穿膜肽九聚精氨酸(RRRRRRRRR, R9)及异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的九聚精氨酸(FITC-R9)合成于吉尔生化有限公司(GL Biochem, China), 采用ABI433自动多肽合成仪,依据Fmoc标准固相合成法, 并用HATU作为肽偶联试剂(Athertonet al, 1989)。单独的异硫氰酸荧光素(FITC)购于Sigma-Aldrich有限公司。
1.2 方法
1.2.1 细胞穿膜肽R9导入大型海藻 选取健康的藻体, 用吸水纸将表面海水吸干, 称取两份等重的藻丝, 分别为实验组和对照组, 备用; 取两只1.5 mL的Eppendorf离心管, 将两组藻体分别转移至两只离心管中; 加入500 μL的PBS溶液, 5000 r/min离心1 min,倾去上清; 在避光室温条件下, 在实验组中加入500 μL浓度为50 μmol/L的FITC-R9溶液, 同时, 在对照组中加入500 μL浓度为50 μmol/L的FITC溶液; 室温避光条件下处理10 min; 10 min后, 实验组和对照组均5000 r/min离心1 min, 倾去上清; 两组均加入500 μL的PBS, 5000 r/min离心1 min, 倾去上清, 重复三次, 得到处理完成的藻体, 备用。
1.2.2 激光共聚焦显微镜观察拍照 将处理后藻体置于载玻片上, 加入适量 PBS溶液, 盖上盖玻片,对盖玻片周边进行封片; 将已制成片的玻片倒置放在激光共聚焦显微镜的载物台上; 设置参数, 选取双通道, 分别应用488 nm和663 nm的激发光波长。对于实验组和对照组, 所有的设置保持一致, 选取合适的视野, 观察拍照。
1.2.3 CPPs导入大型海藻后光合效率变化的测定选取状态良好的浒苔、紫菜和海带, 每种藻取三等份;配制等量的PBS溶液, 50 μmol/L的R9溶液, 50 μmol/L的FITC-R9溶液, 对藻体进行处理, 处理时间为10 min;藻体暗适应 5—10 min, 将 Dual-PAM-100荧光仪与装有相应配置软件的电脑相连, 在室温下测量 PSII的叶绿素荧光(Chl fluorescence of PSII)和P700的氧化还原状态(the redox state of P700)。具体的设置参数为: 测量光来自620 nm波长的发光二极管(LED); 光化光来自 460 nm的 LED, 光强设置为 100 mmol photons/(m2·s), 持续时间为 5 min; 饱和光脉冲光强为 10000 mmol photons/(m2·s), 持续时间为 300 ms。将暗适应后的藻体夹在Dual-PAM的测量探头上, 平衡后, 开始测量; 测得一系列参数后由Dual-PAM软件推导得出最大量子产率Fv/Fm、光系统I的电子传递速率 ETR(I)以及光系统 II的电子传递速率ETR(II)。浒苔、紫菜和海带每一组均有三个平行样品, 所有样品测量时的设置参数均一致。测量后的样品, 等待3 h后, 按照上述步骤, 重新测量一遍。
2 结果与分析
2.1 CPPs导入大型海藻
如图1所示, 荧光标记的R9能够进入三种大型海藻细胞。其中图中红色部分代表藻体的叶绿体自发荧光, 绿色部分则是细胞穿膜肽上的荧光标记在488 nm激光激发下所显示的颜色。由图中可以看出, 紫菜的叶状体(图1a)和海带的雌配子体(图1b)的细胞穿膜肽作用效率最高, 部分 CPPs被细胞壁阻碍在细胞外,大部分的 CPPs进入藻细胞内, 定位在叶绿体周围。经CPPs处理后的浒苔藻体(图1e)显示出明显的绿色荧光, 仔细观察后发现大部分绿色荧光位于细胞壁上, 也就是说在作用于浒苔时, 小部分的 CPPs进入了细胞内部, 大部分被阻隔在外。对照组单独的FITC处理三种大型海藻, 没有显示绿色荧光, 说明单独的FITC不能进入大藻细胞。
考虑到大型海藻不同生活史状态下细胞壁的结构可能有所不同, 作者对不同生活史状态下的紫菜和海带进行了细胞穿膜肽导入。在紫菜方面, 虽然其叶状体(图1a)的细胞内部可观察到明显绿色荧光, 但是其丝状体的细胞穿膜肽作用效率偏低。如图1d所示, 大部分的丝状体细胞是被绿色荧光所包围着的,真正进入细胞内部的比例较少, 这间接说明紫菜叶状体和丝状体的细胞壁结构可能存在一定差异。在海带方面, 考虑到不同性别的细胞可能会存在细胞壁的差异或者存在不同的内在转运机制, 作者对海带的雌、雄配子体的CPPs转导效率进行了对比。结果显示, 与雌配子体(图 1b)相比, 海带雄配子体(图 1c)的 CPPs转导效率要低的多, 绿色荧光绝大多数分布在雄配子体的外围, 几乎没能进入细胞。这种现象可能是由于海带雌配子体的细胞壁渗透性比精子细胞的更大, 或者可能是卵细胞存在更为高效的内部运输机制。与此同时, 海带的孢子体也被检测(图 1f),图中显示海带孢子体的表皮细胞有着少量的CPPs摄入, 这可能是由于海带的孢子体含有大量的胶质, 从而形成了更加强大的屏障, 阻碍外源物质的进入。
细胞穿膜肽进入动物细胞后有向细胞核移动的趋势(Frankelet al, 1988), 这在大型海藻中也有所体现。CPPs处理紫菜的叶状体后, 细胞内的绿色荧光趋向集中于一点(图1a), 这一点有可能就是紫菜细胞核的位置。在海带的雌配子体中也能够观察到类似的现象(图 1b)。
2.2 CPPs处理大藻后的光合作用效率测定
Fv/Fm代表着光系统II的最大量子产率, 它是用来评价植物体光合作用表现的一个敏感参数, 当植物体受到外界胁迫时,Fv/Fm的值会急剧下降(Maxwellet al, 2000)。ETR(I)和 ETR(II)分别代表光系统I和II的电子传递速率, 反映了两个光系统的活性。
由图 2可知, 浒苔经细胞穿膜肽 R9和FITC-R9处理10 min后, 实验组与对照组的Fv/Fm相比没有太大差别(图 2a); R9处理后的 ETR(I)有略微的下降, 但与对照组相比没有显著性差异;FITC-R9处理后的 ETR(I)有略微上升, 分析原因可能是由于荧光素在 Dual-PAM 测量过程中被激发显示出荧光, 该部分光被藻体吸收后, 增强了光系统 I的电子传递速率。ETR(II)则一直保持恒定, 无论是 R9处理还是 FITC-R9处理, ETR(II)的值都没有变化(图2b)。
为了验明较长处理时间后细胞穿膜肽是否对大型海藻光合作用有影响, 作者在3 h后对已用R9以及FITC-R9处理后的浒苔再次进行光合效率测量。实验结果如图 2c以及图 2d所示, 实验组和对照组的Fv/Fm值基本保持一致, ETR(I)和 ETR(II)也都相对恒定。这说明一定浓度的R9对浒苔的光合作用效率基本没有负面影响。
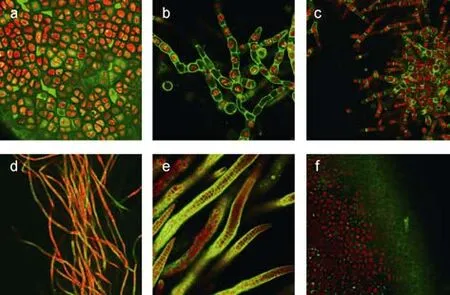
图1 荧光标记的九聚精氨酸转导大型海藻细胞Fig.1 Translocations of fluorescent labeled nona-arginine on macroalgaea. 紫菜叶状体; b. 海带雌配子体; c. 海带雄配子体; d. 紫菜丝状体; e. 浒苔; f. 海带孢子体
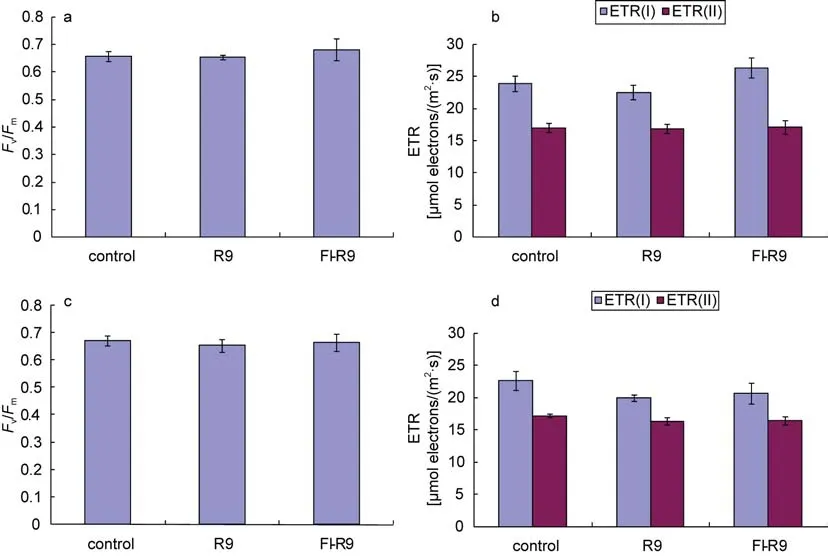
图2 浒苔经细胞穿膜肽R9以及FITC-R9导入后光合效率的变化Fig.2 Changes in photosynthetic efficiency of U. prolifera after being treated with R9 and FITC-R9a. 处理后10 min浒苔的Fv/Fm变化; b. 处理后10 min浒苔ETR(I)和ETR(II)的变化; c. 处理后3 h浒苔的Fv/Fm变化; d. 处理后3 h浒苔ETR(I)和 ETR(II)的变化
如图3a所示, 经由R9和FITC-R9处理10 min后的紫菜Fv/Fm与对照组相比没有显著性变化, 有略微的上升。ETR(I)同样有略微上升的趋势, 而ETR(II)则保持恒定(图3b)。3 h后重新测量的结果表明, R9处理的紫菜Fv/Fm与对照组相比仍然是略微偏高, 而FITC-R9处理的紫菜与对照组相比则略有下降的趋势, 可能是由于3 h后荧光素已发生部分淬灭。除此之外, 无论是 R9处理还是 FITC-R9处理, 与对照组相比, ETR(I)和ETR(II)基本上都没有发生变化。

图3 细胞穿膜肽R9以及FITC-R9导入紫菜后的光合作用效率变化Fig.3 Changes of photosynthetic efficiency of P. yezoensis after being treated with R9 and FITC-R9a. 处理后10 min 紫菜的Fv/Fm变化; b. 处理后10 min紫菜ETR(I)和ETR(II)的变化; c. 处理后3 h紫菜的Fv/Fm变化; d. 处理后3 h紫菜ETR(I)和ETR(II)的变化
海带的结果基本上与浒苔和紫菜保持一致(图4),无论是处理10 min还是3 h, 与对照组相比, R9处理以及FITC-R9处理后海带的Fv/Fm都没有下降(图4a,图4c), ETR(I)和ETR(II)的值也没有受到太大影响。不过, 与处理10 min的相比, 海带的ETR(I)和ETR(II)在3 h后整体有显著下降, 这可能是因为海带本身的抗逆性较弱, 时间较长后其本身的光合作用活性就会有下降, 而不是由于CPPs引发的光系统活性降低。因此, 与对照组相比, 实验组的 ETR(I)和 ETR(II)仍没有显著性变化。
总的来说, 细胞穿膜肽 R9不会对这三种大型海藻产生胁迫效应, 经R9处理后的Fv/Fm不会下降。同时, R9对其光系统的活性也不会有负面影响。这间接证明了细胞穿膜肽R9对大型海藻没有毒害作用。
3 讨论
细胞穿膜肽具有极强的穿透能力, 目前该特性已被广泛的应用在医学领域(Polyakovet al, 2000;Rothbardet al, 2000; Wadiaet al, 2005)。有些人为设计的 CPPs甚至可以穿透渗透性极低的血脑屏障, 从而将药物输送到特殊的靶位点(Costantinoet al,2005)。对于高等植物或者藻类, CPPs则需要穿过细胞壁和细胞膜这两层屏障。因此, CPPs的穿膜效率与藻体细胞壁的结构有密切的关系, 细胞壁越厚, 对于CPPs的阻碍效果越强。比如说, 与丝状体相比, 紫菜的叶状体的细胞壁更薄。作者的实验结果也表明紫菜叶状体相对于丝状体能够摄入更多的CPPs。另外, 海带的雌配子体比雄配子体的 CPPs转导效率要高, 可能说明雌配子体细胞壁的渗透性比雄配子体要大。由此看来, 细胞穿膜肽有助于研究比较大型海藻不同世代的细胞壁的结构, 主要着重于研究其渗透性。

图4 细胞穿膜肽R9以及FITC-R9导入海带后的光合作用效率变化Fig.4 Changes of photosynthetic efficiency of L. japonica after being treated with R9 and FITC-R9a. 处理后10 min海带的Fv/Fm变化; b. 处理后10 min海带ETR(I)和ETR(II)的变化; c. 处理后3 h海带的Fv/Fm变化; d. 处理后3 h海带ETR(I)和ETR(II)的变化
已有的研究表明, CPPs对动物细胞和植物细胞基本上无毒性(Vivèset al, 1997; Unnamalaiet al, 2004;Changet al, 2005)。本文作者测量了CPPs处理后大型海藻的光合作用效率的变化, Dual-PAM 的结果表明CPPs对大型海藻的光合作用效率没有负面影响, 也就是说 CPPs对大型海藻基本无毒性, 从而能够安全高效的应用于大型海藻的研究。后续的研究可以利用CPPs携带各类生物小分子或大分子进入大型海藻,将原本无法渗透进入藻细胞的物质转导进入大型海藻, 发挥其生物学功能。
目前关于 CPPs的转导机制仍存争议, 然而现有研究表明无论是动物细胞还是高等植物细胞, CPPs都能够适用, 具有普适性。CPPs在藻类特别是大型海藻方面的研究较为匮乏, 其介导外源物质转导进入大型海藻的特性, 将来应该有更为广阔的应用前景。
Atherton E, Sheppard R C, 1989. Solid Phase Peptide Synthesis:A Practical Approach. Oxford, England New York: IRL Press at Oxford University Press
Chang M, Chou J-C, Lee H-J, 2005. Cellular internalization of fluorescent proteins via arginine-rich intracellular delivery peptide in plant cells. Plant & Cell Physiology, 46(3):482—488
Chugh A, Amundsen E, Eudes F, 2009. Translocation of cell-penetrating peptides and delivery of their cargoes in triticale microspores. Plant Cell Reports, 28(5): 801—810
Costantino L, Gandolfi F, Tosi Get al, 2005. Peptide-derivatized biodegradable nanoparticles able to cross the blood-brain barrier. Journal of Controlled Release, 108(1): 84—96
Crombez L, Aldrian-Herrada G, Konate Ket al, 2008. A new potent secondary amphipathic cell-penetrating peptide for siRNA delivery into mammalian cells. Molecular Therapy,17(1): 95—103
Frankel A D, Pabo C O, 1988. Cellular uptake of the tat protein from human immunodeficiency virus. Cell, 55(6):1189—1193
Gupta B, Levchenko T S, Torchilin V P, 2005. Intracellular delivery of large molecules and small particles by cell-penetrating proteins and peptides. Advanced Drug Delivery Reviews 57(4): 637—651
Hyman J M, Geihe E I, Trantow B Met al, 2012. A molecular method for the delivery of small molecules and proteins across the cell wall of algae using molecular transporters.Proceedings of the National Academy of Sciences of the United States of America, 109(33): 13225—13230
Lindgren M, Hällbrink M, Prochiantz Aet al, 2000.Cell-penetrating peptides. Trends in Pharmacological Sciences, 21(3): 99—103
Liu B R, Chou J-C, Lee H-J, 2008. Cell membrane diversity in noncovalent protein transduction. Journal of Membrane Biology, 222(1): 1—15
Mäe M, Myrberg H, Jiang Yet al, 2005. Internalisation of cell-penetrating peptides into tobacco protoplasts.Biochimica et Biophysica Acta (BBA)-Biomembranes,1669(2): 101—107
Maxwell K, Johnson G N, 2000. Chlorophyll fluorescence——a practical guide. Journal of Experimental Botany, 51(345):659—668
Park C B, Yi K -S, Matsuzaki Ket al, 2000. Structure–activity analysis of buforin II, a histone H2A-derived antimicrobial peptide: the proline hinge is responsible for the cell-penetrating ability of buforin II. Proceedings of the National Academy of Sciences of the United States of America, 97(15): 8245—8250
Polyakov V, Sharma V, Dahlheimer J Let al, 2000. Novel Tat-peptide chelates for direct transduction of technetium-99m and rhenium into human cells for imaging and radiotherapy. Bioconjugate Chemistry, 11(6): 762—771
Popper Z A, Michel G, Hervé Cet al, 2011. Evolution and diversity of plant cell walls: from algae to flowering plants.Annual Review of Plant Biology, 62: 567—590
Rothbard J B, Garlington S, Lin Qet al, 2000. Conjugation of arginine oligomers to cyclosporin A facilitates topical delivery and inhibition of inflammation. Nature Medicine,6(11): 1253—1257
Suresh A, Kim Y-C, 2013. Translocation of Cell Penetrating Peptides onChlamydomonas reinhardtii. Biotechnology and Bioengineering, 110(10): 2795—2801
Turner J J, Ivanova G D, Verbeure Bet al, 2005. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells.Nucleic Acids Research, 33(21): 6837—6849
Unnamalai N, Kang B G, Lee W S, 2004. Cationic oligopeptide-mediated delivery of dsRNA for post-transcriptional gene silencing in plant cells. FEBS Letters, 566(1—3): 307—310
Vivès E, Brodin P, Lebleu B, 1997. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus. Journal of Biological Chemistry, 272(25): 16010—16017
Wadia J S, Dowdy S F, 2005. Transmembrane delivery of protein and peptide drugs by TAT-mediated transduction in the treatment of cancer. Advanced Drug Delivery Reviews,57(4): 579—596

