采用Mextral54-100从Zn(Ⅱ)-NH4Cl-NH3配合物溶液中萃取锌
朱如龙,李兴彬,魏 昶,黄 卉,李存兄,邓志敢,樊 刚
(昆明理工大学 冶金与能源工程学院,昆明 650093)
随着高品位硫化锌矿资源的日益枯竭以及对锌的高消费需求,低品位氧化锌矿及含锌烟尘(如高炉冶炼过程中产生的瓦斯泥、瓦斯灰、电弧炉含锌烟尘等)等非传统的含锌资源中锌的提取利用受到广泛的关注[1-5]。如云南兰坪低品位氧化锌矿中锌的保有储量大于1000万t,但该矿石钙镁含量高、氧化程度深、含泥质高、矿物组成复杂、褐铁矿化严重,采用常规的选矿-酸浸-电积工艺,锌的选矿回收率低(约50%);采用氧化锌矿直接酸浸-萃取-电积工艺,锌的直收率可望提高20%,但由于矿物中钙镁含量高,酸耗太大,且矿物中的硅、铁等有害杂质溶出加大了浸出液的净化难度,影响工艺的正常运行[6-7]。对于高碱性脉石型低品位氧化锌矿中锌的湿法提取,氨浸-萃取-电积工艺由于具有选择性浸出、试剂消耗少、工艺简单等特点,是一种具有发展前景的提锌工艺[8-9]。乐卫和等[7]、凌江华等[1]、刘三军等[10]系统地研究了低品位氧化锌矿在 NH4Cl-NH3、(NH4)2SO4-NH3、(NH4)2CO3-NH3体系中的浸出行为,并获得较好的锌浸出指标。然而,如何从氧化锌氨浸液中萃取分离锌及其相关的基础研究相对缺乏。
酸性溶液中萃取锌使用的萃取剂,如P204、Cyanex272和Aliquat336[11-13]等在氨性体系下并不适用,由于这类萃取剂在氨性溶液中几乎都会生成铵皂,导致其溶解性增加,且容易产生乳化分相困难等问题。羟肟类萃取剂在氨性环境中对锌有一定的萃取能力,但由于该类萃取剂本身结构特性导致其在氨性体系中的共萃氨量大,应用受到一定的限制[14-15]。HOH等[16]的研究表明:活性成分主要为8-(烷基磺酰胺)喹啉的Lix34萃取锌的最佳的萃取pH=7.8,pH>7.8后,由于氨与锌的配位能力大于Lix34与锌的配位能力,导致锌的萃取率下降。对于氨性溶液中锌的萃取,最为理想的萃取剂是β-二酮类萃取剂[17]。由于该类萃取剂具有较高的pKa值、萃取速度快、反萃容易、共萃氨量低等特点,目前研究得较多的该类萃取剂主要是Lix54[17-19]和 Hostarex DK-16[20],溶液体系大多为Zn(Ⅱ)-(NH4)2SO4-NH3,萃取过程受水相pH和总氨浓度的影响很大,锌氨络合物的生成降低了锌的萃取率。何静等[21]采用含有β-二酮结构的新型萃取剂2-乙酰基-3-氧代-二硫代丁酸-十四烷基酯(YORS)萃取Zn(Ⅱ)-(NH4)2SO4-NH3体系中的锌,最优条件下锌的萃取率达到97% 以上,NH3不会被萃取到有机相中;HU等[22]选择高位阻的β-二酮萃取氨性溶液中的 锌,并以Cyanex923和Lix84I为协萃剂考察其协萃效应,结果表明Cyanex923的协萃效果优于Lix84I的;FU等[23]研究了高位阻β-二酮萃取剂(1-苯基-4-乙基-1,3辛二酮)和TOPO对Zn(Ⅱ)-NH4Cl-NH3体系中锌的萃取行为,结果表明:二者的混合有明显的协萃效应;采用离子液体和高位阻β-二酮组成的萃取体系萃取Zn(Ⅱ)-(NH4)2SO4-NH3溶液中的锌也具有一定的应用前景,萃取锌的能力主要取决于萃合物的水合程度和溶剂的极性[24]。
低品位氧化锌矿采用NH4Cl-NH3体系浸出时,由于氯和氨都与锌配位,使氧化锌矿溶解度较大,金属离子与氯离子发生配位降低还原电势,增大了浸出反应的速度,且氨-氯化铵形成的缓冲体系增加了锌的溶解[25-26]。Mextral54-100是一种含有β-二酮结构的萃取剂,活性成分主要是1-苯甲酰-2-壬酮,关于该萃取剂从Zn(Ⅱ)-NH4Cl-NH3体系中萃取锌还未见报道。因此,为了分析Zn(Ⅱ)-NH4Cl-NH3体系中β-二酮类萃取剂萃取锌的行为和规律,本文作者采用Mextral54-100和正庚烷组成的萃取体系为萃取有机相,考察从Zn(Ⅱ)-NH4Cl-NH3溶液中萃取锌过程中水相pH、萃取剂浓度、温度、总氨浓度和氯离子浓度等因素对锌萃取行为的影响规律,并在此基础上分析萃取锌的机理。
1 实验
1.1 原料及试剂
Zn(Ⅱ)-NH4Cl-NH3配合物的水溶液由分析纯的氧化锌、氯化铵和氨水配制而成,其中n(NH3)/n(NH4Cl)=1/2,水溶液中锌离子浓度为6 g/L,总氨浓度([NH3]T=[NH3+NH4+])为3 mol/L,所用萃取剂Mextral54-100(HA)是一种亮黄色的液体,活性成分为1-苯甲酰-2壬酮,化学结构式具有β-二酮结构,由重庆浩康医药化工有限公司提供,稀释剂为分析纯的正庚烷。
1.2 实验方法
量取15mL由Zn(Ⅱ)-NH4Cl-NH3组成的水相,用NaOH或H2SO4调节水相的初始pH达到实验要求,按照O:A=1:1的相比,将其与Mextral54-100和正庚烷组成的有机相一起加入分液漏斗,在恒温水浴条件下振荡10 min,前期实验结果表明振荡5min就可达到萃取平衡。振荡结束后,静置分相10 min,分相结束后,得到负载有机相和萃余液。采用PHSJ-5型实验室pH计测定萃余液的pH;采用EDTA滴定法测定溶液中的锌浓度,有机相中的锌浓度根据质量守恒计算得到,负载有机相和萃取剂的红外图谱采用FTIR光谱仪进行测定。锌萃取率(E)和分配比(D)计算公式如下:

式中:c0、corg和caq分别表示初始水相中的锌浓度、平衡时有机相中的锌浓度和萃余液中的锌浓度。
2 结果与讨论
2.1 萃取剂浓度的影响
在水相中锌离子浓度[Zn2+]=6 g/L、[NH3+N]=3 mol/L、初始pH=8.1、相比O/A=1、萃取时间10 min、温度25℃的条件下,考察萃取剂浓度对锌分配比的影响,其结果如图1所示。

图1 萃取剂浓度对锌分配比的影响Fig.1 Effect of HA concentration on distribution ratio of zinc
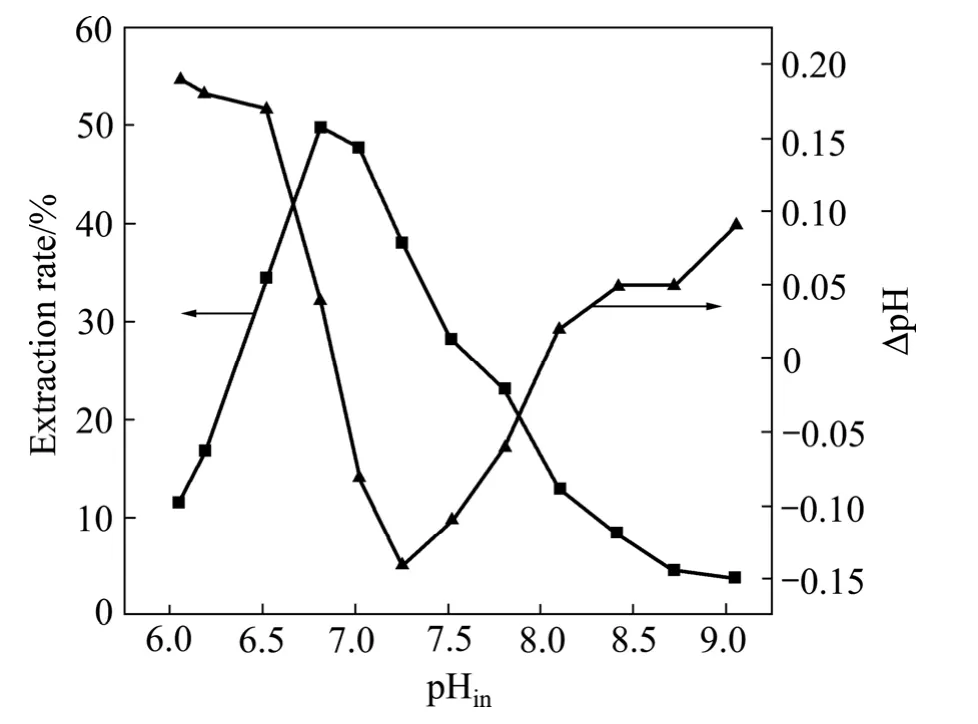
图2 水相初始pH对锌萃取的影响Fig.2 Effect of initial pH in aqueous phase on zinc extraction
从图1可看出,锌的分配比随着萃取剂浓度的增加而增大,萃取剂浓度的增大使得萃取剂负载容量随之增加,导致锌的萃取率增大。所得直线斜率为1.891,接近2,说明形成的萃合物中锌离子与萃取剂分子的的化学计量比为2,即在该体系中每个锌离子与两个萃取剂分子结合,形成了ZnA2型的萃合物。另外,由萃合物呈电中性可知,氯离子不会参与萃合物的组成。
2.2 水相pH的影响
在萃取剂浓度[HA]=0.4 mol/L、水相中锌离子浓度[Zn2+]=6 g/L、[NH3+]=3 mol/L、相比O/A=1、萃取时间10 min、温度25℃的条件下,考察水相pH值对锌萃取的影响,其结果如图2所示。
从图2可以看出,锌的萃取受水相pH的影响较大,当水相初始pH<6.81时,锌的萃取率逐渐增大;当pH>6.81时,萃取率随着pH的增加呈递减趋势。当总氨浓度为3 mol/L时,最佳的萃取pH范围为6.8~7.0。由于Mextral54-100是一种弱酸性螯合萃取剂,从理论上说,锌的萃取率会随着溶液pH的升高而增大,但随着pH的增大,溶液中铵根离子的离解产生自由氨将促进锌氨络合反应的进行,溶液中将产生大量Zn(NH3)m2+(m=1,2,3,4)络合物,这种络合物不能被萃取到有机相中[17],加之锌氯络合物的生成也会使溶液中自由锌离子的含量减少,导致锌的萃取率降低。另外,图中显示,萃取过程中ΔpH呈现一定的变化规律,ΔpH为初始pH(pHin)与平衡pH(pHeq)之差,即

理论上来讲,锌的萃取过程是释放氢离子的过程,ΔpH应随着锌萃取率的增加而增大,在萃取率最大时,ΔpH也最大。但是,初始pH<7.25时,ΔpH随初始pH的增加而减小,主要源于pH的增加促进了溶液中铵根离子的解离,解离产生的氨的中和作用使平衡pH逐渐升高,同时,萃取反应产生氢离子,使平衡pH降低,两者的竞争作用使平衡pH升高;当初始pH>7.25时,锌的萃取率已经明显降低。此时,ΔpH的增加可能是由于水相的pH接近萃取剂本身的pKa值,萃取剂解离产生的氢离子使平衡pH降低。且当pH>7时,四配位的Zn(N已逐渐成为锌的优势物种[25]。因此,初始pH的增加和萃取过程的进行,影响了水相中锌物种的不同分布,水相中锌物种从Zn(H2O)n(NH3)4到Zn(N的变化是引起ΔpH的变化的主要原因。
2.3 总氨浓度的影响
在萃取剂浓度[HA]=0.4 mol/L、水相中锌离子浓度[Zn2+]=6 g/L、初始pH=8.1、相比O/A=1、萃取时间10 min、温度25℃的条件下,考察总氨浓度对锌分配比的影响,其结果如图3所示。

图3 总氨浓度对锌分配比的影响Fig.3 Effect of total ammonia concentration on distribution ratio of zinc
从图3可看出,总氨浓度的增大降低了锌的分配比。主要是由于总氨浓度的增大,溶液中游离氨的浓度也将增大,导致溶液中锌氨络合物量增多。另外,溶液中还存在着一定量的锌氯络合物,而锌氨络合物和锌氯络合物是不能被萃取到有机相中的,两种络合物的形成使自由锌离子浓度降低,对萃取行为产生较大的影响。有研究表明,在氨-氯化铵体系中的酸性区域内,Zn2+和ZnCl42-是锌的优势物种;在接近中性区域,有少量的Zn(NH3)2+和Zn(NH3)32+的含锌配合物;当总氨浓度大于0.64 mol/kg时,Zn(NH3)42+成为锌的优势物种。因此,总氨浓度对锌物种的影响很大,影响萃取剂对锌的萃取[25]。
2.4 温度的影响
在萃取剂浓度[HA]=0.4mol/L、水相中锌离子浓度[Zn2+]=6 g/L、[NH3+NH4+]=3 mol/L、初始pHin=8.1、相比O/A=1、萃取时间10 min的条件下,考察温度浓度对锌分配比的影响,其结果如图4所示。
从图4可以看出,随着温度的升高,分配比呈递减的趋势,但变化幅度不大。说明锌的萃取是一个放热的过程,升高温度不利于萃取反应的进行。可能是由于温度的变化会对锌氨配合物、锌氯配合物、萃合物油溶性及构型等产生影响,导致萃取剂分子与锌的配位竞争能力小于锌氨络合能力。忽略ΔH随温度的变化,lgKex正比于lgD,根据范特霍夫方程式,即
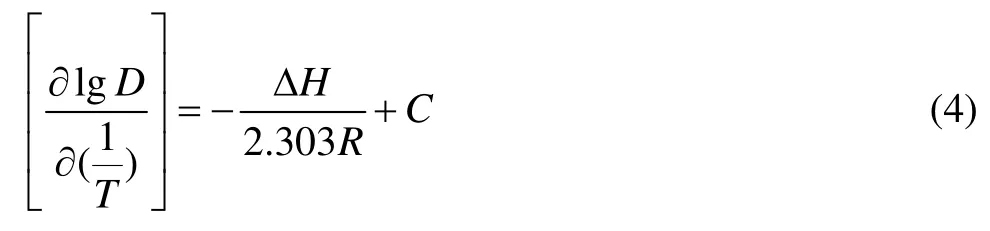

图4 温度对锌分配比的影响Fig.4 Effect of temperature on distribution ratio of zinc
通过计算得到反应的焓变ΔH、熵变ΔS和吉布斯自由能变化ΔG如表1所列。ORGEL等[27]研究得出关于络合物lgK-1/T图呈线性关系,说明络合物中只含有单一物种,这也说明只有自由Zn2+被萃取。
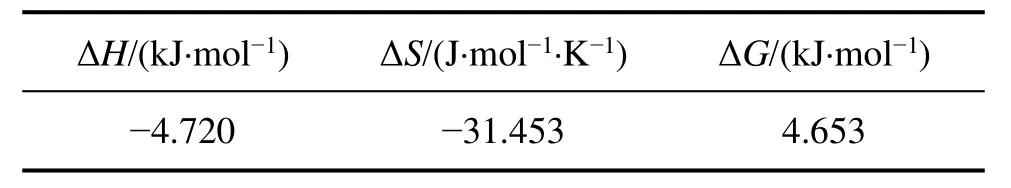
表1 298 K下的热力学参数Table 1 Thermodynamic parameters at 298 K
2.5 氯离子浓度的影响
在萃取剂浓度[HA]=0.4 mol/L、水相中锌离子浓度[Zn2+]=6 g/L、[NH3+NH4+]=3 mol/L、初始pH=8.1、相比O/A=1、萃取时间10 min和温度25℃的条件下,考察氯离子浓度对锌分配比的影响,其结果如图5所示。

图5 氯离子浓度对锌分配比的影响Fig.5 Effect of chloride ion concentration on distribution ratio of zinc
从图5可以看出,随着氯离子浓度的增加,锌的分配比降低。氯离子的加入促进了锌氯络合物的形成,尤其是在氯离子浓度较大时,这种影响更显著,导致水相中与萃取剂结合的自由锌离子含量减少,分配比下降。
2.6 萃合物的红外光谱
对萃取剂和负载有机相进行红外光谱检测,其结果如图6所示。
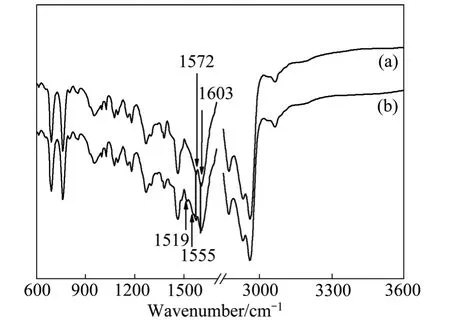
图6 萃取有机相的FT-IR谱Fig.6 FT-IR spectra of extracted organic phase:(a)Fresh organic phase;(b)Extracted organic phase
从图6可以看出,萃取反应后,负载有机相的FT-IR谱上出现明显的特征吸收峰,说明萃取剂结构在萃取前后发生了变化,而且萃合物的光谱具有β-二酮分子的酮羰基C=O和C=C双键特征吸收峰。由于β-二酮结构的特殊性,其存在酮式和烯醇式互变异构,萃取剂在1603 cm-1和1572 cm-1附近的特征吸收峰分别归属于υC=O和υC=C伸缩振动频率,萃取后,υC=O和υC=C吸收峰分别红移至1555 cm-1和1519 cm-1处。这主要是由于萃取剂分子与锌发生螯合配位后形成螯合环,共轭作用增强,致使振动频率向低频方向移动,这也证实了β-二酮的烯醇式结构参与配位键的形成。另外,如果萃合物分子中含有氨,将会在645、1145、1596和3350 cm-1处出现吸收峰,但在负载有机相的红外谱中并没有发现氨的特征吸收,说明了锌氨络合物不会被萃取到有机相中。
3 萃取机理分析
采用萃取剂Mextral54-100萃取锌的反应可以表示为

式中:下标“aq”和“org”分别代表水相和有机相。从式(5)和(6)中可以看出,萃取平衡常数与[H+]有关,萃取过程对[H+]敏感,在锌离子不发生水解的范围内,增加pH有利于萃取。另外,随着水相pH的增加,在氯化铵溶液中,铵根离子将发生离解产生自由氨,从而形成锌氨络合物,即

式中:3NHk 和mk分别表示的离解常数和锌氨络合物的累积稳定常数,忽略溶液中锌的水解,由于锌氨络合物和锌氯配合物的形成,导致自由锌离子的浓度降低,且萃取剂浓度远大于溶液中锌的总浓度。因此,锌的分配比可以表示为

另外,298 K下锌氨络合物和锌氯络合物的稳定常数如表2所示[28]。

表2 298 K下锌氨络合物和锌氯络合物的稳定常数[28]Table 2 Critical stability constants of zinc complexes at 298 K[28]
相同条件下,锌氨络合物所占比例远大于锌氯络合物,在不考虑水相中氯离子浓度的影响的情况下,分配比表示为

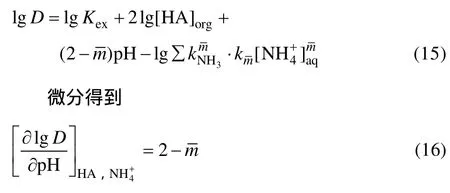
当水相pH增加时,水相中游离的氨增多,与锌离子络合的平均氨配位数增加,从式(16)可看出,该曲线斜率存在最大值为2,即水相中不存在配体氨;最小值为-2,即锌氨的平均氨配位数达到4时。因此,随着pH的增加,平均氨配位数逐渐增大,平衡pH也随之改变,lg D-pHeq图出现拐点。从图7看出,当水相平衡pH<6.81时,曲线斜率为0.9734,说明与锌络合的平均氨配位数约为1,间接说明此pH范围内,有自由氨的存在,并与锌离子络合。当平衡7.1<pH<8.96时,曲线斜率为-0.7856,此时平均氨配位数约为2.8,说明此时产生的游离氨大部分与锌发生络合,导致自由锌离子浓度降低,分配比下降。

图7 lg D与pHeq关系图Fig.7 Relationship between lg D and equilibrium pHeq
4 结论
1)水相pH和总氨浓度对锌的萃取影响较大,初始pH>6.81后,分配比随pH的增加而降低;总氨浓度的增加和锌氨络合物的形成趋势增大,导致锌的分配比下降。
2)随着萃取剂浓度增大,锌的分配比也随之增加;而随着氯离子浓度增加,分配比却呈现下降的趋势。
3)锌的萃取是一个放热的过程,298 K下反应焓变为-4.720 kJ/mol,温度升高不利于反应的进行,萃合物的红外光谱确认了萃取过程中β-二酮互变为烯醇式参与配位键的形成,锌氨络合物不被萃取,萃合物组成形式为ZnA2。
[1] 凌江华,尹周澜,胡慧萍,李珊珊,胡久刚,陈启元.兰坪低品位氧化锌矿NH3-(NH4)2SO4体系浸出[J].中南大学学报:自然科学版,2011,42(9):2577-2583.LING Jiang-hua,YIN Zhou-lan,HU Hui-ping,LI Shan-shan,HU Jiu-gang,CHEN Qi-yuan.Leaching process of low grade zinc oxide ore of Lanping in NH3-(NH4)2SO4system[J].Journal of Central South University:Science and Technology,2011,42(9):2577-2583.
[2] 王瑞祥,唐谟堂,刘 维,杨声海,张文海.NH3-NH4Cl-H2O体系浸出低品位氧化锌矿制取电锌[J].过程工程学报,2008,8(1):219-222.WANG Rui-xiang,TANG Mo-tang,LIU Wei,YANG Sheng-hai,ZHANG Wen-hai.Leachingof low grade zinc oxide in NH3-NH4Cl-H2O system for production of electrolytic zinc[J].The Chinese Journal of Process Engineering,2008,8(1):219-222.
[3] 罗 伟,徐 政,张寒霜,杨丽梅,李 岩.电弧炉烟尘湿法提锌研究[J].金属矿山,2011,40(2):153-156.LUO Wei,XU Zheng,ZHANG Han-shuang,YANG Li-mei,LI Yan.Research on zinc extraction with electric arc furnace dust[J].Metal mine,2011,40(2):153-156.
[4] 朱耀平.高炉瓦斯灰中铟锌铋的回收实践[J].有色金属:冶炼部分,2009(6):14-16.ZHU Yao-ping.Practice of recovery indium,zinc and bismuth from gasash from blastfurnace[J].NonferrousMetals:Extractive Metallurgy,2009(6):14-16.
[5] 周洪杰,李剑利,崔志刚.炼钢烟尘中回收锌的技术研究[J].资源再生,2012(10):56-57.ZHOU Hong-jie,LI Jian-li,CUI Zhi-gang.Technology study on recovering zinc from steel smelting dust[J].Resource Recycling,2012(10):56-57.
[6] 朱 云,胡 汉,苏云生,杨保民.难选氧化锌矿氨浸动力学[J].过程工程学报,2002,2(1):81-85.ZHU Yun,HU Han,SU Yun-sheng,YANG Bao-Min.Kinetics of leaching poorly-floated zinc-oxide-ore with ammonia[J].The Chinese Journal of Process Engineering,2002,2(1):81-85.
[7] 乐卫和,衷水平,王瑞祥.高碱性氧化锌矿氨性浸出研究[J].有色冶金设计与研究,2010,31(4):10-12.LE Wei-he,ZHONG Shui-ping,WANG Rui-xiang.Research on ammonia-ammonium chloride leaching of a high alkaline zinc oxide ore[J].Nonferrous Metals Engineering&Research,2010,31(4):10-12.
[8] MENG Xing-hui,HAN K N.The principles and applications of ammonia leaching of metals:A review[J].Mineral Processing and Extractive Metallurgy Review,1996,16(1):23-61.
[9] 张保平,唐谟堂.氨浸法在湿法炼锌中的优点及展望[J].江西有色金属,2001,15(4):27-28.ZHANG Bao-ping,TANG Mo-tang.Theadvantagesand prospecton ammonia leaching in the process ofzinc hydrometallurgy[J].Jiangxi Nonferrous Metals,2001,15(4):27-28.
[10] 刘三军,欧乐明,冯其明.氧化锌矿的碱法浸出研究[J].矿产保护与利用,2004(4):39-43.LIU San-jun,OU Le-ming,FENG Qi-ming.Alkaline leaching of a zinc oxide ore[J].Conservation and Utilization of Mineral Resources,2004(4):39-43.
[11] 刘淑芬,杨声海,陈永明,刘 青,胡燕青.从高炉瓦斯泥中湿法回收锌的新工艺(Ⅱ):溶剂萃取及电积[J].湿法冶金,2012,31(3):155-159.LIU Shu-fen,YANG Sheng-hai,CHEN Yong-min,LIU Qing,HU Yan-qing.A new process for recovering of zinc from blast furnace sludge(Ⅱ):Solvent extraction and electrowinning[J].Hydrometallurgy of China,2012,31(3):155-159.
[12]NATHSARMA K C,DEVI N.Separation of Zn(Ⅱ)and Mn(Ⅱ)from sulphate solutions using sodium salts of D2EHPA,PC88A and Cyanex 272[J].Hydrometallurgy,2006,84(3):149-154.
[13]WASSINK B,DREISINGER D,HOWARD J.Solvent extraction separation of zinc and cadmium from nickel and cobalt using Aliquat 336,a strong base anion exchanger,in the chloride and thiocyanate forms[J].Hydrometallurgy,2000,57(3):235-252.
[14]REDDY B R,PRIYA D N.Process development for the separation of copper(Ⅱ),nickel(Ⅱ)and zinc(Ⅱ)from sulphate solutions by solvent extraction using LIX84I[J].Separation and Purification Technology,2005,45(2):163-167.
[15] 向延鸿,尹周澜,冉 盈,胡慧萍,陈启元.高位阻β-二酮和Lix84混合萃取剂从氨性溶液中萃取铜[J].中国有色金属学报,2011,21(5):1171-1177.XIANG Yan-hong,YIN Zhou-lan,RAN Ying,HU Hui-ping,CHEN Qi-yuan.Solvent extraction of copper from ammonia solutions by sterically hindered β-diketone and Lix84[J].The Chinese Journal of Nonferrous Metals,2011,21(5):1171-1177.
[16]HOH Y C,CHOU N P,WANG W K.Extraction of Zinc by LIX 34[J].Ind Eng Chem Process Des Dev,1982,21(1):12-15.
[17]ALGUACIL F J,ALONSO M.The effect of ammonium sulphate and ammonia on theliquid-liquid extraction of zinc using LIX 54[J].Hydrometallurgy,1999,53(2):203-209.
[18]王延忠,朱 云,胡 汉.从氨浸出液中萃取锌的试验研究[J].有色金属,2004,56(1):37-39.WANG Yan-zhong,ZHU Yun,HU Han.Zinc extraction from ammonia leaching solution with Lix54[J].Nonferrous Metals,2004,56(1):37-39.
[19]陈 浩,朱 云,胡 汉.Zn-NH3-H2O体系中Hostarex DK-16萃取锌[J].有色金属,2003,55(3):50-51.CHEN Hao,ZHU Yun,HU Han.Zinc extraction with Hostarex DK-16 in Zn-NH3-H2O system[J].Nonferrous Metals,2003,55(3):50-51.
[20]RAO K S,SAHOO P K,JENA P K.Extractions of zinc from ammoniacal solutions by Hostarex DK-16[J].Hydrometallurgy,1992,31(1):91-100.
[21] 何 静,黄 玲,陈永明,唐谟堂,金胜明,冯瑞姝,吴胜男.新型萃取剂YORS萃取Zn(Ⅱ)-NH3配合物体系中的锌[J].中国有色金属学报,2011,21(3):687-693.HE Jing,HUANG Ling,CHEN Yong-ming,TANG Mo-tang,JIN Sheng-ming,FENG Rui-zhu,WU Sheng-nan.Solvent extraction of zinc from Zn(Ⅱ)-NH3complex system by new extractant YORS[J].The Chinese Journal of Nonferrous Metals,2011,21(3):687-693.
[22]HU Jiu-gang,CHEN Qi-yuan,HU Hui-ping,YIN Zhou-lan.Synergistic extraction of zinc from ammoniacal solutions using β-diketone mixed with Cyanex923 or Lix84I[J].Transactions of Nonferrous Metals Society of China,2012,22(5):1217-1223.
[23]FU Weng,CHEN Qi-yuan,WU Qian,HU Hui-ping,BAI Lan.Solvent extraction of zinc from ammoniacal/ammonium chloride solutions by a sterically hindered β-diketone and its mixture with tri-n-octylphosphine oxide[J].Hydrometallurgy,2010,100(3):116-121.
[24] 胡久刚,陈启元,胡慧萍.氨性溶液中β-二酮/离子液体萃锌研究[C]//中国稀土学报编辑部.2012年全国冶金物理化学学术会议专缉(下册).北京:中国稀土学报,2012:874-878.HU Jiu-gang,CHEN Qi-yuan,HU Hui-ping.Extraction of zinc from ammoniacal solution into hydrophobic ionic liquids with β-diketone[C]//Editorial Office of Journal of Rare Earths.The 2012 National Conference on Physical Chemistry of Metallurgy(PartⅡ).Beijing:Journal of Rare Earths,2012:874-878.
[25]DING Zhi-ying,CHEN Qi-yuan,YIN Zhou-lan,LIU Kui.Predominance diagrams for Zn(Ⅱ)-NH3-Cl-H2O system[J].Transactions of Nonferrous Metals Society of China,2013,23(3):832-840.
[26]WINAND R.Chloride hydrometallurgy[J].Hydrometallurgy,1991,27(3):285-316.
[27]ORGEL L E,MULLLIKEN R S.Molecular complexes and their spectra.Ⅶ.The study of molecular complexes in solution;contact charge-transfer spectra[J].J Amer Chem Soc,1957,79(18):4839-4846.
[28] 唐谟堂,杨天足.配合物冶金理论与技术[M].长沙:中南大学出版社,2011:40.TANG Mo-tang,YANG Tian-zu.Fundamental and technology of complex metallurgy[M].Changsha:Central South University Press,2011:40.

