草莓水培根的诱导及其显微结构变化的探讨
胡 真,汪 天
(1.安徽农业大学 林学与园林学院,安徽 合肥 230036;2.安徽农业大学 园艺学院,安徽 合肥 230036)
植物水培是继20 世纪60 年代世界农业的“绿色革命”之后兴起的一场新的“种植革命”[1]。它是利用现代物理、化学、生物等综合技术措施,对植物进行去根、催根、再生等生化诱变,使植物长出新根适应水中生长的过程[2]。我国目前的水培技术研究已广泛涉及花卉[3-6]、林木[7]、蔬菜[8]、粮食作物[9]等方面。草莓作为一种即可鲜食又可观赏的水果,一直以来都深受大众喜爱。水培草莓不仅管理方便、养护简单、干净卫生,更具有极强的观赏性,更能满足大众的需求。本试验采用同一营养液、不同的通氧时间、不同浓度的3-IBA( 吲哚丁酸)处理对草莓进行水培根诱导,筛选出草莓水培根诱导的最佳条件。并通过对其土培和水培显微结构的比较来探讨水培根的生根机理,为草莓水培的大规模生产提供一定的理论依据。
1 材料与方法
1.1 试验材料及器具
供试材料:草莓( Fragaria ananassa Duch.),品种,“丰香”。蔷薇科,草莓属多年生草本。
供试药品: 四水硝酸钙( Ca( NO3)2·4H2O)、硝酸钾( KNO3)、磷酸一铵( NH4H2PO4)、七水硫酸镁( MgSO4· 7H2O)、乙二胺四乙酸二钠铁(Na2FeEDTA)、硼酸(H3BO3)、四水硫酸锰( MnSO4·4H2O)、五水硫酸铜( CuSO4·5H2O)、七水硫酸锌(ZnSO4·7H2O)、钼酸钠(Na2MoO4·2H2O)。
试验仪器:EPSON EU-88 型根系扫描仪
Olympus BX51 型显微镜
LEECOM AU-314 型增氧泵,出气量2.2 L/min×2。
ODBJ-350 便携式电导率仪
1.2 试验方法
1.2.1 营养液的配制
参考有关资料[10,11]分别配制大量元素的100倍浓 缩 液 A ( Ca ( NO3)2· 4H2O、KNO3)、B(NH4H2PO4、MgSO4.7H2O),微量元素的1 000 倍浓缩液。添加时稀释到1.0 倍标准浓度的山崎草莓营养液。营养液的pH 调整为5.5-6.0[12]。营养液配方如下表:
1.2.2 供试材料的选取及处理
选生长健壮、无病虫害、长势基本一致的草莓植株,去除老根、烂根、病根,在流水下冲洗干净。所有植株均用0.05%的KMnO4溶液浸泡15 min,冲洗、晾干。再分别在200 mg/L、400 mg/L、600 mg/L 的3-IBA 速蘸5 s,晾干。放入水培槽中进行培养。
1.2.3 试验设计
试验于2014 年3-5 月在安浓农庄的景观大棚及安徽农业大学园艺学院实验室进行。试验用清水的EC =0.362 mS/cm,添加营养液后水中的EC=0.585 mS/cm。通氧时间及3-IBA 浓度分别设3个水平、1 个对照,另设一个完全对照,共17 个处理(具体处理见表2)。其中对照分别是CK-200 mg/L、CK-400 mg/L、CK-600 mg/L、2 h-CK、4 h-CK、6 h-CK,完全对照是CK。每种处理3 个重复,每周换水一次。其中通氧采用间歇通氧的方式,以增加氧气利用率。即2 h—每隔5. 4 h 通氧30 min,4 h—每隔2.5 h 通氧30 min,6 h—每隔1.5 h通氧30 min。每次换水时仍要进行洗根操作,及时去除不适应水培环境的土培根以及洗去根部黏液。水培50 d 后用根际分析仪测定草莓水培根的根长、表面积、投影面积、体积、平均直径。制作水培根、土培根的徒手切片,对其初生根根尖部位的显微结构进行比较。并拍照保存好照片。
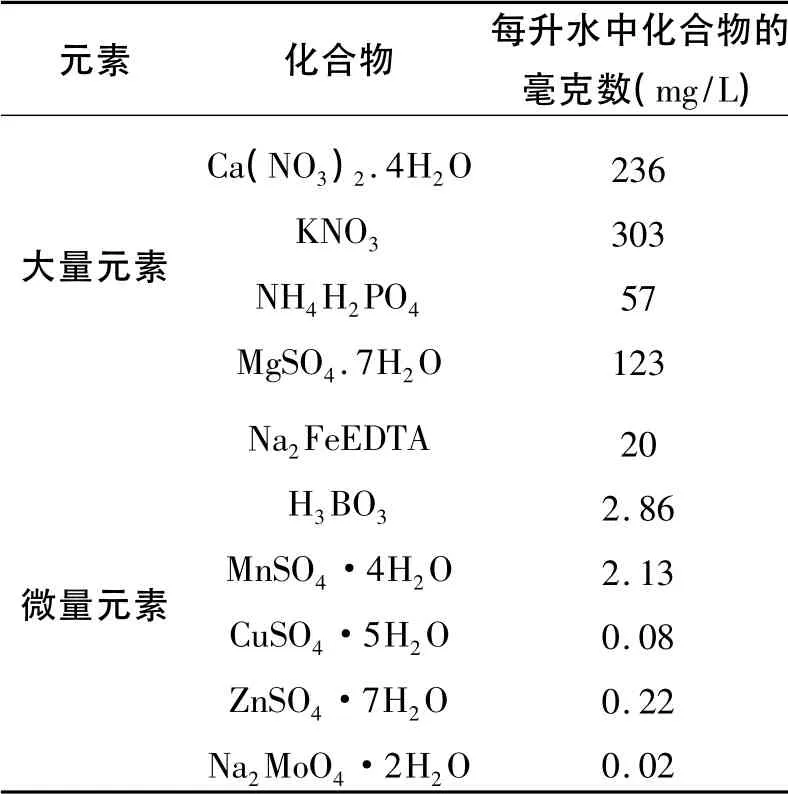
表1 山崎草莓营养液配方
1.2.4 数据处理
本试验中,采用Win RHIZO 2010 年8 月版根系扫描分析系统对扫描的根系进行分析,得出草莓水培根系的各指标值; 用Microsoft Excel( WPS) 软件完成原始数据的整理; 采用SPSS 专业版软件对各指标平均值进行多重比较。
2 结果与分析
2.1 草莓水培与土培根系外观形态的比较
水培草莓的根系总体生长旺盛,呈现出2 种形态,一种是纤长洁白的主根系,一种是在老根上直接长出的须根系。但两者均是组织脆嫩,在表皮周围覆有排列整齐的根毛。这是因为水培环境中的营养元素分布较为均匀,故根毛所发挥的吸收作用大致相当。因此,根毛无长短之分,但水培根的根毛相对土培要退化。土培草莓的根系生长旺盛,呈红褐色。主侧根明显,具多级分枝,在土壤中,草莓根系需要扩大根系面积来吸收水分和养料,因此,侧根较多。但因为与土壤颗粒的摩擦阻力,受到的机械损伤较多,所以根毛数量相对较少,因土壤中养分分布不均,导致土培根毛长短大小不一。
2.2 不同通氧时间及3-IBA 浓度对草莓水培根系生长的影响
通过对草莓植株进行水培根的诱导,培养50 d后,测得各处理草莓水培根系的总根长、表面积、投影、体积、平均直径,并进行多重比较分析( 见表2)。从表2中可以看出,草莓根系在各项处理中均可生长。
充足的氧气有利于植物的生长[13]。从表2中可以看出,在相同3-IBA 浓度下,水培草莓的总根长、根表面积、根体积随通氧时间的增长而增大。其中通氧6 h 与对照及通氧2 h 产生了显著性差异。除600 mg/L 3-IBA 处理外,根系的投影面积随通氧时间的增长呈增长规律。这可能跟过高浓度的激素处理造成根系损伤或是扫描时根系的摆放方式有关。因此,本试验中,相同3-IBA 处理、通氧时间6 h 最适宜草莓水培根系的诱导及生长。
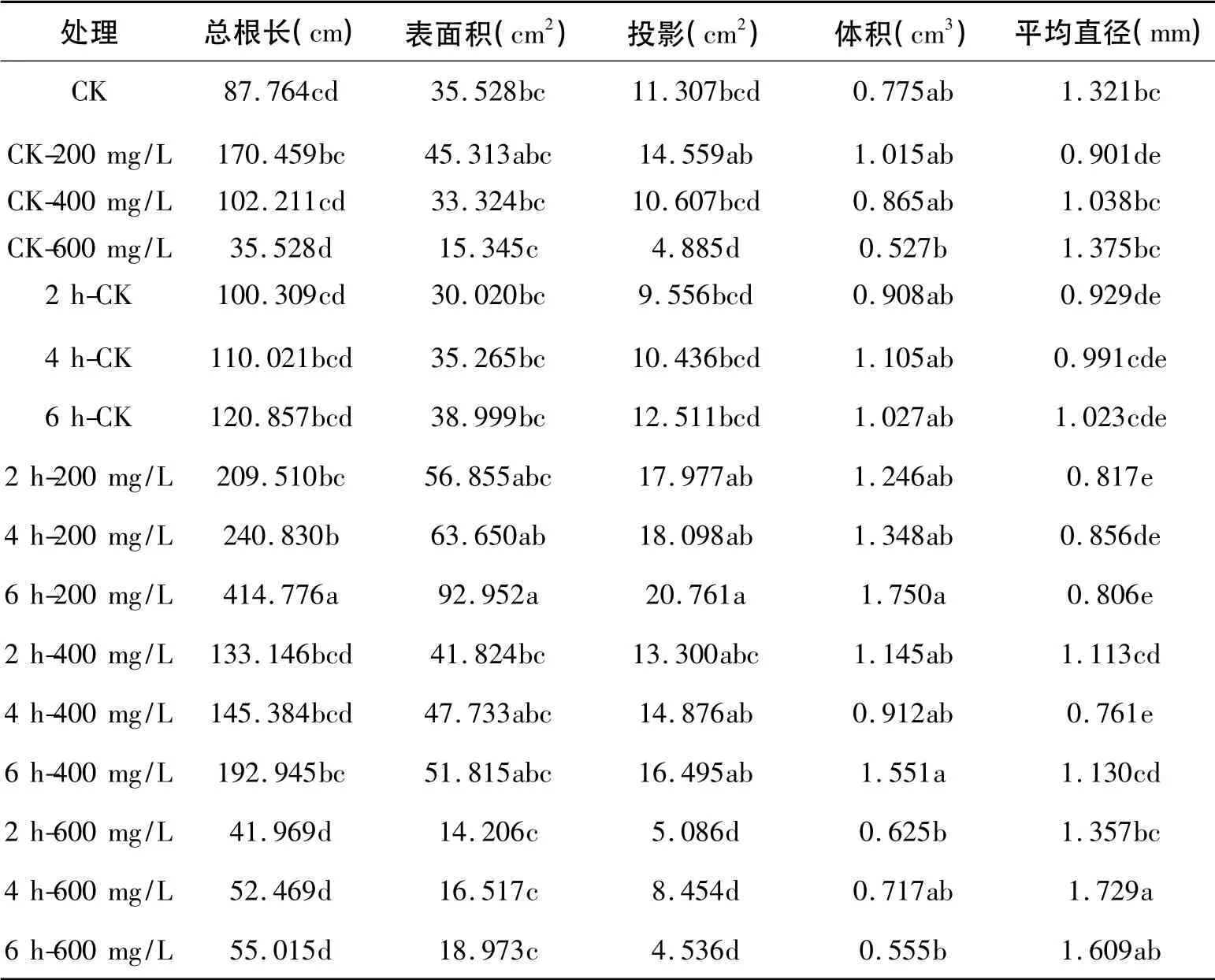
表2 不同通氧时间及浓度的3-IBA 对草莓根系生长的影响
从表2中可以看出,在相同的通氧时间下,除平均直径外,草莓水培根系的其它指标均随3-IBA浓度上升而呈现下降趋势。草莓水培根系的平均直径随3-IBA 浓度升高而增加,是因为草莓的水培根系以须根居多,而平均直径随草莓根数的增加而降低。其中经200 mg/L 与400 mg/L 3-IBA 处理的草莓植株,其水培根系各项指标的均值均高于对照组;经600 mg/L 3-IBA 处理的草莓植株,其水培根系各项指标的均值均低于对照组。其中,经200 mg/L 3-IBA 处理的草莓水培根的总根长、表面积、投影面积及平均直径均与600 mg/L 及对照组产生了显著差异,与400 mg/L 差异不显著。在相同通氧条件下,以200 mg/L 3-IBA 效果最佳。
由表2可以看出,在通氧和激素结合的处理中,通氧6 h、200 mg/L 3-IBA 处理的各项指标均显著优于其它处理。这说明充足的养分条件和适宜的激素处理更有利于草莓水培根的诱导和根系的生长。
2.3 草莓水培根显微结构的变化
2.3.1 草莓水培根与土培根显微结构的比较
草莓的水培根系,经过水培环境的诱导,产生了适应水培环境生长的结构。由二者的显微结构可知(见图1,2),草莓的土培和水培根的表皮都是由一层圆柱形的表皮细胞构成。但由图1可知,草莓的土培根系表皮有一层深色物质,即角质层。而水培根系没有。这与根系的生活环境有关,角质层是为了保护根系,减少土壤阻力的摩擦而生。由图1,2 可知,草莓的水培和土培根系的皮层均由数层皮层细胞组成,但相比较而言,水培根的皮层细胞层数较多,排列疏松,且细胞体积较大。这种结构更利于水培根系对水环境氧气的吸收,保证植物在低氧条件下的呼吸作用。水培根的整个皮层占根系横切面的比例比土培根要大。与土培根相比,水培根的维管柱占整个根系横切面的比例相对较小,木质部和韧皮部结构不太明显。

图1 土培草莓根系显微图片100 ×

图2 水培草莓根系显微图片(6 h,200 mg/L)100 ×
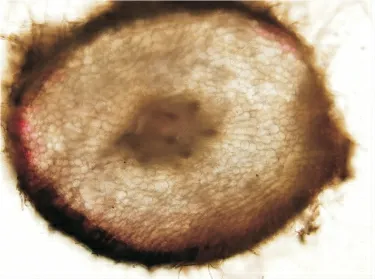
图3 水培草莓根系显微图片(CK,200 mg/L)100 ×
2.3.2 不同通氧处理草莓水培根显微结构的比较
根据以上试验结果,分别选取CK-200 mg/L、2 h-200 mg/L、4 h-200 mg/L、6 h-200 mg/L 这4 个处理的草莓植株进行水培根显微结构的比较。只选择不同通氧处理作显微结构比较的原因是,激素处理的主要作用是促进新根的萌发。本试验中,对已长出水培根结构产生影响的应该是通氧条件。由图2,3,4,5 对比可知,相比通氧2 h、4 h、6 h,CK 的外皮层细胞与内皮层细胞的体积相差不大,即皮层细胞大小差异不大;而通氧的三组处理外皮层细胞与内皮层相比,体积相对较小,这可能是因为CK组溶氧量不高导致的。其它结构无明显差异。

图4 水培草莓根系显微图片(2 h,200 mg/L)100 ×

图5 水培草莓根系显微图片(4 h,200 mg/L)100 ×
3 结论与讨论
诱导植物生根的方法有很多[13-18]。充足的氧气有利于植物的生长,如果根际表面氧气浓度极低时,则氧气有可能被外层细胞所耗尽,其内层的组织则处于缺氧状态[19],这样会抑制根系生长和功能发挥。因此,提高水中的溶氧量是水培根诱导的关键。在实际生产及试验中,为了能更好更快地诱导出水生根,一般都采用激素预处理。本试验采用3-IBA 对草莓根系进行预处理,并置于不同的通氧条件下进行培养。结果表明,通氧6 h、200 mg/L 3-IBA 处理的各项指标均显著优于其它处理,最适宜草莓水培根系的诱导。但是由于本试验选用的激素浓度值相差较大,故无法确定最适宜草莓水培的3-IBA 浓度;因此,可多设几组激素处理,进行进一步的研究试验,以确定最佳浓度。
水培植物的生根机理与植物的生态适应性机理密切相关,植物的根系具有极强的生态适应性与发育上的可塑性。在高湿条件下,一些陆生植物在去根后,会因补偿生长与维持平衡需要,激发受伤部位或切口重新长出新的具有发达的薄壁组织的不定根,这些不定根初次进入水中时。在环境( 氧气)胁迫诱发体内生理生化变化,形成大量的纤维素酶,促发薄壁组织细胞发生细胞壁的分解,串联成通气管束或贮气腔,也就是溶生性通气组织,进而形成水生根[13]。本试验结果正是证明了这一点,本试验结果表明,与土培根系相比,草莓水培根系皮层细胞层数较多,排列疏松,且细胞体积较大;水培根的整个皮层占根系横切面的比例较大,维管柱占整个根系横切面的比例相对较小,木质部和韧皮部退化、结构不明显。不同通氧处理的水培根系之间显微结构差异不明显。
[1]张鲁归.室内水栽花卉[M].上海:同济大学出版社,1998:3-10.
[2]邱亚芬,李元梅,朱家骝,等.水培花卉水生根生长速度研究[J].上海农业科技,2006(3):109-110.
[3]孙 廷,辛向阳,张建芳. 广东万年青水培试验研究[J].安徽农业科学,2011,39(6):3220-3221.
[4]沃建香,栾惠芳,王国夫. 吊兰水培根诱导技术研究[J].安徽农业科学,2012,40(10):5746-5747.
[5]马德良,王 斐,琚淑明. 室内观赏花卉水培移栽技术研究[J].安徽农业科学,2010,38(23):12418-12419,12431.
[6]孙 叶,陈秀兰,包建忠,等.花卉植物水培根系生长研究[J].江苏农业科学,2009(1):194-195.
[7]赵兰枝,刘振威,张允伟,等.木槿水培繁殖研究[J].安徽农业科学,2006,34(10):2100-2107.
[8]王 瑞. 不同浓度营养液对水培莴苣的影响[J]. 黑龙江农业科学,2012(5):83-85.
[9]万洪深,李 俊,陈华华,等.不同N,P,K 营养水平下“川麦42”苗期生物学特性初步分析[J].西南农业学报,2007,20(2):281-285.
[10]魏晓明,张晓军.无土栽培营养液的配制及调控[J].农业与技术,1996(4):10-12.
[11]李富恒,王 艳.草莓无土栽培营养液的配制及管理[J].农业系统科学与综合研究,2001,17(3): 210-211,214.
[12]Dai S F,Yan Z H,Liu D C,et al. Evaluation on Chinese bread wheat landraces for low pH and Aluminum tolerance using hydroponic screening[J]. Agricultural Sciences in China,2009,8(3): 285-292.
[13]徐伟忠,朱丽霞,赵 根.植物生态适应性在植物水生诱导上的运用[J].分子植物育种,2006,4( S1):143-150.
[14]韩 鹰,朱旭东,耿晓东,等.光照对水培风信子根系生长的影响[J]. 扬州大学学报( 农业与生命科学版),2005,26(4):79-82.
[15]赵兰枝,冯玉红,郑树景,等.磁铁对两种植物水培驯化效果的研究[J].现代园艺,2011(15):5-6.
[16]蔡祖国,李鹏鹤,赵兰枝.植物生长调节剂对苏铁水培生根诱导的影响[J].北方园艺,2012(21):60-62.
[17]李维强,樊 磊.袖珍椰子水培试验研究[J].郑州牧业工程高等专科学校学报,2010,30(3):10-11.
[18]傅雨露,刘柏炎.植物生长调节剂对容器水培吊兰生长的影响研究[J].安徽农学通报( 下半月刊),2009,15(10):28-29.
[19]Drew M C. Plant injury and adaptation to Oxygen deficiency in the root environment: A review[J]. Plant and Soil,1983,75(2): 179-199.

