类风湿关节炎患者外周血B细胞FcγR IIb表达
黄林芳,梁 迪,莫文秀,周 晨,李 菁,张 烜,廖湘平,郑文洁
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,北京 100730)
类风湿关节炎(rheumatoid arthritis,RA)是一种原因不明的自身免疫性疾病,主要表现为慢性、对称性、进行性多关节炎,影响关节滑膜功能,导致关节进展性的破坏、疼痛及功能障碍。其致病机制涉及多种免疫细胞,越来越多的研究证明,B细胞在RA发病机制中起着重要作用[1]。研究显示,RA外周循环及滑膜等组织中定位的B细胞可通过参与RA自身抗体的产生[2]、作为抗原呈递细胞活化T细胞[3-4]、分泌炎性细胞因子[5]等参与RA的炎性反应和骨破坏。抑制性受体FcγR IIb(Fc gamma receptor IIb)是在B细胞表面表达的抑制性受体,能反馈性抑制B细胞受体(B cell receptor,BCR)识别抗原产生的活化信号,在防止B细胞过度激活、维持体液免疫耐受中起重要作用[6-7]。其在单核巨噬细胞及中性粒细胞的活化方面也起着重要作用[8]。国外研究表明,FcγR IIb表达异常和基因多肽性与自身免疫性疾病发病、易感性和炎性反应的强度密切相关[7]。目前,国内针对FcγR IIb的研究较少,相关研究主要针对原发性干燥综合征[9]和系统性红斑狼疮[10-11]等。本研究探讨RA患者外周血B细胞表面FcγR IIb的表达及临床意义。
对象和方法
病例选择
2014年10月至2015年8月北京协和医院就诊的RA患者,诊断均符合1987年美国风湿病学会分类标准诊断或欧洲抗风湿联盟与美国风湿病学会联合制定的2010年成人RA分类标准。入组前6个月未用激素及免疫抑制剂治疗。排除感染、肿瘤及其他自身免疫性疾病。健康对照来自年龄、性别匹配的健康志愿者,无风湿病史和风湿病家族史,并排除恶性肿瘤或其他慢性、活动性病毒感染等。本研究得到北京协和医院伦理委员会的批准,患者及健康对照者均签署了知情同意书。
资料收集和指标判断
收集患者的病程、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP)、类风湿因子、抗环瓜氨酸肽抗体(抗cyclic citrullinated peptide抗体,抗CCP抗体)、血清IgG、IgM、IgA水平等临床信息。疾病活动度采用病情活动度评分(disease activity score 28,DAS28)系统进行评估,DAS28≤2.6定义为低度活动期,3.2
主要试剂与仪器
流式细胞仪检测所用单克隆抗体;异藻蓝蛋白(APC)-CD19、叶绿素蛋白偶联物(PerCP-Cy5.5)-CD27、藻红蛋白(PE)-CD32,皆购于美国BD公司;人全血细胞裂红液购自美国BD公司;FACSAriaⅡ流式细胞仪购自美国BD公司。
实验方法
标本处理:采集肝素钠抗凝外周血1 ml,加入裂红液室温裂解10 min,1 200 r/min,离心6 min,弃上清,加入磷酸盐缓冲液,再离心1次终止裂红反应,磷酸盐缓冲液重悬细胞并计数。
B细胞亚群表面FcγR IIb检测:磷酸盐缓冲液调整细胞浓度为4×105/100 μl,加入CD19-APC、CD27-PerCP-Cy5.5、CD32-PE,对照管加入相应的同型对照。4℃冰箱避光孵育30 min,磷酸盐缓冲液洗涤,加1%甲醛固定液固定细胞,流式上机检测。根据前向角FSC(forward scatter)和侧向角SSC(side scatter)参数在全血细胞中圈定淋巴细胞门,后根据CD19+圈选B细胞,再用CD19、CD27将B细胞分成以下3个亚群,初始B细胞(naive B cell,CD19+CD27-),记忆B细胞(memory B cell,CD19+CD27+),浆母细胞(plasmablasts,CD19+CD27high)。检测B细胞各亚群表面FcγR IIb的阳性细胞百分比和平均荧光强度(mean fluorescence intensity,MFI)。
统计学分析
采用SPSS18.0软件进行数据统计分析。流式细胞仪分析应用flowjo 7.6软件进行数据处理。经过Kolmogorov-Smirnov检验为正态分布数据用均值±标准差表示;非正态分布数据采用中位数表示。所有正态分布、方差齐数据,两组间比较采用独立样本t检验。相关性分析采用Pearson相关检验。P<0.05为差异有统计学意义。
结 果
人口统计学及临床特点
本研究共纳入初治RA患者20例,其中男3例,女17例,平均(45.75±11.34)岁;病程为2个月~20年,中位数为5年;入组时DAS28为1.46~7.47分,平均为(5.25±1.95)分,其中低度活动者4例,中度活动者4例,高度活动者12例。健康志愿者共15名,其中男3名,女12名;平均年龄(40.47±11.87)岁。各组年龄、性别比较差异无统计学意义(P>0.05)。
外周血B细胞亚群
20例RA患者CD19+CD27-初始B细胞占CD19+B细胞的百分率为(78.11±9.00)%,显著高于健康对照组(64.24±13.24)%,差异有统计学意义(t=-3.691,P<0.05)。RA患者CD19+CD27+记忆性B细胞占CD19+B细胞的(18.30±8.94)%,显著低于健康对照组的(32.31±13.67)%,差异有统计学意义(t=3.665,P=0.001)。RA患者与健康对照组浆母细胞占B细胞的百分率比较差异无统计学意义(P>0.05)(图1)。
B细胞亚群FcγR IIb表达差异
20例RA患者外周血CD19+CD27+记忆性B细胞表面FcγR IIb的MFI[(7 571.95±4 494.53)%]显著低于健康对照组[(13 304.87±6 568.19)%],差异有统计学意义(t=3.068,P=0.004);初始B细胞CD19+CD27-、浆母细胞CD19+CD27high表面FcγR IIb的MFI与健康对照组比较,差异无统计学意义(P>0.05)(图2)。
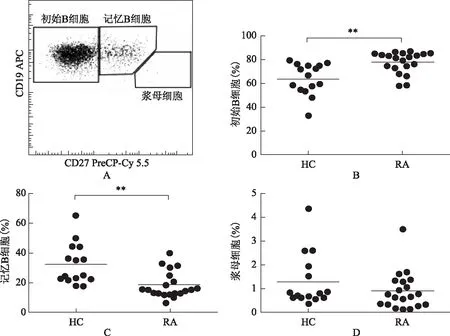
图1类风湿关节炎组与健康对照组外周血B细胞亚群比较
Fig1Comparison of peripheral B cell subgroup between the rheumatoid arthritis and healthy controls
A:根据CD19、CD27将B细胞分成3个亚群,即初始B细胞(CD19+CD27-)、记忆性B细胞(CD19+CD27+)、浆母细胞(CD19+CD27high);B:初始B细胞比较;C:记忆性B细胞比较;D:浆母细胞的比较;APC:异藻蓝蛋白;PreCP-Cy 5.5:叶绿素蛋白偶联物;HC:健康对照组;RA:类风湿关节炎组;**P<0.01

图2类风湿关节炎患者和健康对照者记忆性B细胞表面FcγR IIb表达比较
Fig2Comparison of expression of FcγR IIb on surface of memory B cell between the rheumatoid arthritis and healthy controls
FcγR IIb比较采用平均荧光强度;A:初始B细胞;B:记忆B细胞;C:浆母细胞;MFI:平均荧光强度;HC:健康对照组;RA:类风湿关节炎组;**P<0.01
外周血记忆性B细胞FcγRIIb表达与疾病活动相关性分析
RA患者IgG分泌水平与CD19+CD27+记忆性B细胞表面FcγR IIb的MFI呈负相关(r=-0.732,P=0.007),而与IgM、IgA的分泌无明显相关性。RA患者ESR、CRP、DAS28、类风湿因子、抗CCP的水平与CD19+CD27+记忆B细胞表面FcγR IIb的MFI无明显相关性(图3)。
讨 论
FcγR IIb是一类位于染色体1q23上、相对分子质量约为40 000的跨膜糖蛋白[13],是唯一的抑制性受体,主要表达于B细胞,单核巨噬细胞、树突状细胞、嗜碱性粒细胞和中性粒细胞中也有表达,而在T细胞和自然杀伤细胞中没有发现表达[6]。FcγR IIb可介导对多种免疫细胞的负反馈调节反应,其可通过依赖或不依赖胞浆区免疫受体酪氨酸抑制基序的方式起到抑制细胞激活的作用,参与调节细胞的增殖、抗体的分泌、淋巴因子的释放等多种生物学效应[5]。FcγR IIb表达异常与多种自身免疫病发病、易感性和炎性反应的强度密切相关,如FcγR IIb敲除的C57BL/6小鼠会产生自身抗体及出现免疫复合物介导的狼疮样自身免疫病的表型[14];系统性红斑狼疮SLE和PSS患者记忆性B细胞和浆细胞表面FcγR IIb的表达下降,并与病情活动相关[8-13]。系统性红斑狼疮患者纯合子FcγR IIb-I232T突变体的原代B细胞,不能阻止BCR与CD19的突触共定位,导致下游信号传导分子对PI3K的异常调节,促使了B淋巴细胞的异常活化[15]。
对RA的研究显示,FcγR IIb表达缺失的小鼠更容易诱导出胶原诱导的关节炎模型[16]。且日本学者发现在一种129种系来源的位于sle16位点远端携带FcγR IIb基因无效突变的C57BL/6小鼠将自发产生RA的一些临床关节炎症状,如滑膜的增生及严重的多发关节的骨及软骨的破坏[17]。临床研究报道FcγR IIb启动子及跨膜区的等位基因变异与RA存在一定关系,并且与RA患者抗CCP抗体水平及血清IL-6等细胞因子水平相关[18]。RA患者B细胞表面该受体表达较健康对照显著下降[19]。另有研究显示,FcγR IIb在RA记忆性B细胞及浆细胞均显著下降,且与高滴度抗MCV抗体具有相关性[20]。本研究首次在国内研究了初治RA患者外周血B细胞分布及其FcγR IIb的表达水平,结果发现RA患者外周血记忆性B细胞占总B细胞的百分率低于健康对照,且进一步发现RA患者外周血记忆性B细胞FcγR IIb的表达亦显著下降,与国外报道一致。

图3类风湿关节炎患者记忆性B细胞表面FcγR IIb表达与临床指标的相关性
Fig3Relationship of expression of FcγR IIb on surface of memory B cell in the patients with rheumatoid arthritis and clinical index
当免疫复合物与BCR共交联,通过BCR下游Lyn激酶对免疫受体酪氨酸抑制基序的磷酸化,促使FcγR IIb受体活化并募集磷酸酶SHIP1及SHIP2,进而对BCR的下游信号通路产生抑制作用,阻断钙信号通路,防止B细胞产生过量的自身抗体[21-22]。FcγR IIb还可通过抑制B细胞类别转换及分化为浆细胞而抑制抗体分泌[23]。本结果显示,RA患者外周血中记忆性B细胞表面的FcγR IIb表达水平显著下降,并与血清IgG水平呈负相关,提示FcγR IIb可能在RA的体液免疫中发挥了一定的作用。
有研究发现,XmAb5871是针对FcγR IIb的靶向治疗药物,通过交联B细胞表面BCR及FcγR IIb,以达到抑制B细胞异常活化及功能的作用,通过利用RA患者外周血单个核细胞进行XmAb5871刺激体内及体外试验,发现可以抑制B细胞产生的体液免疫反应,提示其可能成为抑制RA自身反应性B细胞活性的新治疗策略[24]。
综上所述,RA患者外周血记忆性B细胞占总B细胞的百分率显著下降且其FcγR IIb表达水平显著下降,并与血清IgG水平呈负相关,提示FcγR IIb可能在RA的体液免疫中发挥了一定的作用。进一步对其功能的研究有助于更好地揭示RA发病机制,同时为寻找治疗新靶点提供新线索。
[1]Bugatti S,Vitolo B,Caporali R,et al.B cells in rheumatoid arthritis:from pathogenic players to disease biomarkers[J].BioMed Res Int,2014,2014:681678.
[2]Kleyer A,Finzel S,Rech J,et al.Bone loss before the clinical onset of rheumatoid arthritis in subjects with anticitrullinated protein antibodies[J].Ann Rheum Dis,2014,73:854-860.
[3]Yeo L,Toellner KM,Salmon M,et al.Cytokine mRNA profiling identifies B cells as a major source of RANKL in rheumatoid arthritis[J].Ann Rheum Dis,2011,70:2022-2028.
[4]Sun JB,Xiang Z,Smith KGC,et al.Important role for FcγRIIB on B lymphocytes for mucosal antigen-induced tolerance and Foxp3+ regulatory T cells[J].J Immunol,2013,191:4412-4422.
[5]Takemura S,Klimiuk PA,Braun A,et al.T cell activation in rheumatoid synovium is B cell dependent[J].J Immunol,2001,167:4710-4718.
[6]Nimmerjahn F,Ravetch JV.Fcγ receptors as regulators of immune responses[J].Nat Rev Immunol,2008,8:34-47.
[7]Smith KGC,Clatworthy MR.FcγRIIB in autoimmunity and infection:evolutionary and therapeutic implications[J].Nat Rev Immunol,2010,10:328-343.
[8]Santegoets KC,Wenink MH,van den Berg WB,et al.Fc Gamma Receptor IIb on GM-CSF Macrophages Controls Immune Complex Mediated Inhibition of Inflammatory Signals[J].PLoS One,2014,9:e110966.
[9]周士亮,车楠,陆智敏,等.原发性干燥综合征患者外周血 B 细胞FcγR IIb的表达及临床意义[J].中华风湿病学杂志,2012,16:292-295.
[10] 聂英坤,张凤山,李露露,等.系统性红斑狼疮FcγR IIb和 C1q 抗体的表达及其意义[J].中华风湿病学杂志,2004,8:27-29.
[11] Su K,Yang H,Li X,et al.Expression profile of FcγRIIb on leukocytes and its dysregulation in systemic lupus erythematosus[J].J Immunol,2007,178:3272-3280.
[12] Saag KG,Teng GG,Patkar NM,et al.American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis[J].Arthritis Rheum,2008,59:762-784.
[13] 姚忻,闻玉梅.抑制性IgG受体 (FcγRIIB) 的免疫调节作用及意义[J].Chin Bull Life Sci,2009,21:49-52.
[14] Tarasenko T,Dean J A,Bolland S.FcγRIIB as a modulator of autoimmune disease susceptibility[J].Autoimmunity,2007,40:409-417.
[15] Xu L,Li G,Wang J,et al.Through an ITIM-Independent Mechanism the FcγRIIB Blocks B Cell Activation by Disrupting the ColocalizedMicroclustering of the B Cell Receptor and CD19[J].J Immunol,2014,192:5179-5191.
[16] Yuasa T,Kubo S,Yoshino T,et al.Deletion of Fcγ receptor IIB renders H-2b mice susceptible to collagen-induced arthritis[J].J Exper Medicine,1999,189:187-194.
[17] Sato-Hayashizaki A,Ohtsuji M,Lin Q,et al.Presumptive role of 129 strain-derived Sle16 locus in rheumatoid arthritis in a new mouse model with Fcγ receptor type IIb-deficient C57BL6 genetic background[J].Arthritis Rheum,2011,63:2930-2938.
[18] Meister S,Engelmann R,Kneitz C,et al.The presence of FCGR2B promoter or transmembrane region variant alleles leads to reduced serum IL-6 levels in rheumatoid arthritis[J].Rheumatol Int,2015,35:1311-1318.
[19] Prokopec KE,Rhodiner M,Matt P,et al.Down regulation of Fc and complement receptors on B cells in rheumatoid arthritis[J].Clin Immunol,2010,137:322-329.
[20] Catalán D,Aravena O,Sabugo F,et al.B cells from rheumatoid arthritis patients show important alterations in the expression of CD86 and FcgRIIb,which are modulated by anti-tumor necrosis factor therapy[J].Arthritis Res Ther,2010,12:R68.
[21] Nishizumi H,Horikawa K,Mlinaric-Rascan I,et al.A double-edged kinase Lyn:a positive and negative regulator for antigen receptor-mediated signals[J].J Exper Med,1998,187:1343-1348.
[22] Bolland S,Pearse RN,Kurosaki T,et al.SHIP modulates immune receptor responses by regulating membrane association of Btk[J].Immunity,1998,8:509-516.
[23] McGaha TL,Karlsson MCI,Ravetch JV.FcγRIIB deficiency leads to autoimmunity and a defective response to apoptosis in Mrl-MpJ mice[J].J Immunol,2008,180:5670-5679.
[24] Chu SY,Yeter K,Kotha R,et al.Suppression of Rheumatoid Arthritis B Cells by XmAb5871,an Anti-CD19 Antibody That Coengages B Cell Antigen Receptor Complex and Fcγ Receptor IIb Inhibitory Receptor[J].Arthritis Rheumatol,2014,66:1153-1164.

