微小RNA差异表达谱在原发性干燥综合征的应用
王笑颜,王友庆,沈翠芬,金文君,王 翔,邵圣文,邹伟华,顾金华
(湖州市中心医院检验科,浙江湖州 313000)
原发性干燥综合征(primary Sjögren’s syndrome,pSS)是一种主要累及外分泌腺的慢性炎性自身免疫系统疾病,尤其以泪腺和唾液腺受累为主要特征,造成口干、眼干、皮肤干燥等症状,女性占90%以上。目前,尚缺乏特异的单一的检查项目,导致国际上有不同的分类诊断标准,临床也缺乏敏感性高、特异性强的诊断方法,给临床诊断带来很大的困难。实验室检查项目中抗核抗体(anti-nuclear antibody,ANA)、抗SSA抗体和抗SSB抗体对pSS诊断有重要临床意义。有报道称,抗SSA抗体和抗SSB抗体的出现与pSS系统性损害密切相关,抗SSA抗体和抗SSB抗体阳性率分别是60%和40%,约50%患者为阴性,其敏感性不足[1-2]。微小RNA(microRNA,miRNA)是一类内源性非蛋白质编码的RNA分子,长约22核苷酸[3]。miRNA是近年来广受关注的参与基因表达调控的重要分子,大量证据表明其在固有免疫、适应性免疫及炎性因子的信号转导过程中起着重要的调节作用[4]。本文旨在探讨pSS的miRNA谱是否存在差异表达,为进一步探讨miRNA在干燥综合征发病机制中的作用提供依据。
对象和方法
对象和分组
pSS患者组:选取2012年11月至2013年8月湖州中心医院门诊及住院的pSS患者6例,诊断均符合2002年干燥综合征国际分类(诊断)标准。6例pSS患者均为女性,年龄17~68岁,平均(46±17)岁。治疗前患者为首诊,未服用激素和免疫抑制剂等药物。
健康对照组:6名健康志愿者,均为女性,年龄32~52岁,平均(43±13)岁。
两组研究对象在年龄、性别构成上差异无统计学意义,均排除药物、糖尿病、高血压、感染等疾病,并根据伦理委员会要求签署知情同意书。
材料
Platinum SYBR Green qPCR SuperMix-UDG (Invitrogen,11733- 038),dNTP(Takara,D4030RA),RNase Inhibitor (Takara,2313A),M-MLV (Takara,D2639A),50 bp DNA Ladder Marker(LC-Bio,DL-1004B),总RNA提取试剂盒购自Norgen Biotek公司,miRNA芯片购自LC Sciences公司,TurboFectTM siRNA转染试剂购自Fer-mentas公司,逆转录试剂盒ReverTra Ace Qpcr RT Kit、购自Takara公司,SYBR Green Mix Plus荧光染料购自TOYOBO公司。在ABI PRISM®7900HT型荧光定量聚合酶链反应仪上完成。
总RNA提取及质量控制
抽取治疗前、后受试者清晨空腹静脉血清标本,留取1ml血清于-70℃保存,利用总RNA提取试剂盒(Norgen,Cat.42800)提取总RNA。由于血清样本中RNA含量极低,通过微量紫外分光光度计很难进行定量分析及判断RNA是否存在降解。因此,提取过程中通过等血清起始量进行定量,提取的总RNA通过荧光定量聚合酶链反应判断RNA是否存在降解。结合文献报道[5],选取2条miRNA,即hsa-miR-16与hsa-miR-192,以2条miRNA表达为依据判断。其中miR-16为中丰度表达miRNA,表达量在16~22 Ct左右;miR-192为低丰度表达miRNA,表达量在25~30 Ct左右。如果检测样本的Ct值超过以上标准,则认为样本存在降解,不进行下游芯片杂交实验。
miRNA芯片检测及数据分析
芯片由美国LC Sciences公司制作。采用激光扫描仪采集杂交图像、Array-Pro软件对杂交图像进行数字化转换。数据处理和分析首先扣除背景,计算重复点值和标准偏差,然后通过LOWESS算法进行原始芯片数据的标准化处理。经标准化分析后的芯片数据进行卡方检验,为减少卡方检验的误差,同时采用Boferroni对卡方检验结果进行错误率校正,最终以FDR<0.05为差异标准进行差异表达筛选。
荧光定量聚合酶链反应检测miRNA表达
选取miRNA芯片分析中差异倍数及信号值较高的3个miRNA(miRNA-4484、miRNA-4687、miRNA-146a-5p)进行荧光定量聚合酶链反应分析。取健康对照组和pSS治疗前患者组与PSS治疗前患者组和PSS治疗后患者组总RNA进行逆转录,以U6作为内参照。每个逆转录反应取样品量为5 μl,以上述指标的逆转录引物做逆转录反应,总反应体系为10 μl,以1 μl/孔的cDNA为模板,进行荧光定量聚合酶链反应,反应体系为20 μl,复孔为3个。荧光定量聚合酶链反应反应程序进行40个循环:95℃ 10 s,60℃ 20 s,70℃ 10 s。荧光定量聚合酶链反应反应体系:荧光染料9 μl、逆转录产物2 μl、正链引物2 μl、反链引物2 μl、加水至总体积为20 μl。ABI 7500RT-PCR仪检测,数据采用2-ΔΔCt法分析。
差异表达miRNA靶基因预测及miRNA靶基因的基因本体与信号转导通路富集分析
从检测出的差异表达miRNA中选取变化较明显的22个miRNA,使用TargetScan、miRanda以及PicTar这3款软件分别进行靶基因预测。对3款软件预测出的靶基因分别按照评分标准进行筛选。TargetScan算法中去除context score percentile(评分)<50的靶基因,miRanda算法中去除最大自由能(Max_Energy)>-20的靶基因,PicTar算法中去除ddG>-5的靶基因。最后取此3款软件的交集作为差异miRNA的最终靶基因。应用DAVID在线分析网站进行靶基因信号转导通路富集分析(KEGG Pathway analysis)。
结 果
标本RNA纯度及质量检测
所有标本Ct值均在选取的2个miRNA的Ct范围内,表明总RNA具有良好的质量,可以满足后续芯片杂交及荧光定量聚合酶链反应验证实验。
miRNA芯片结果
共发现53条miRNA表达差异有统计学意义,其中pSS患者组表达上调24条,表达下调29条,选取差异倍数>1.5倍的miRNA 22条,miR-3960差异倍数最大,pSS患者组比健康对照组高27.09倍;其次是miR-4687-3p,pSS患者组比健康对照组高5.77倍;miR-4484在pSS患者组为下调miRNA,比健康对照组下调3.7倍(表1)。
荧光定量聚合酶链反应验证芯片结果
健康对照组和pSS治疗前组比较,miR-146a-5p、miR-4484和miR-4687-5p表达均上调,差异有统计学意义(P<0.05),miR-146a-5p和miR-4687-5p验证结果与芯片一致。治疗前组和治疗后组比较,miR-146a-5p和miR-4484表达均下调,差异有统计学意义(P<0.05),而miR-4687-5p表达依然上调(图1)。
差异表达miRNA靶基因预测及miRNA靶基因的基因本体与信号转导通路富集分析
选取出变化较明显的22个miRNA中,上调17个,下调5个。3款预测miRNA作用靶基因的软件共同预测结果显示,miR-146a-5p共有799个可能的靶基因,miR-4484共有282个可能的靶基因,miR-4687-5p共有957个可能的靶基因。基因本体功能富集分析显示,这些miRNA调控的靶基因主要涵盖生物过程,细胞组成和分子功能三大类生物功能,部分分子功能预测见图2。
健康对照组和pSS治疗前组以及pSS治疗后组比较发现,与pSS相关并存在统计学差异(P<0.05)的GO主要富集在葡萄糖与氨基酸代谢、细胞因子受体相互作用、花生四烯酸代谢和碳水化合物生成等。信号通路显著富集结果显示与趋化因子信号通路、Notch信号通路、钙信号通路、NOD样受体信号通路等密切相关。表明pSS患者miRNA可能通过上述几条通路调控疾病发生发展。
讨 论
miRNA是一类非编码的小RNA分子,研究表明其在免疫稳态中发挥重要作用,其主要作用于基因转录后水平,miRNA调控的免疫细胞发育和功能异常与自身免疫病相关[6]。miRNA与免疫调节机制的作用受到越来越多的关注[7-9],在自身免疫性疾病的发生发展中也起到了重要的作用。近些年,干燥综合征的发病率明显上升,其发病机制不清。本研究分析健康人群和pSS患者血液检测到的差异miRNA,miRNA已经成为研究pSS发生发展机制的一个新领域。
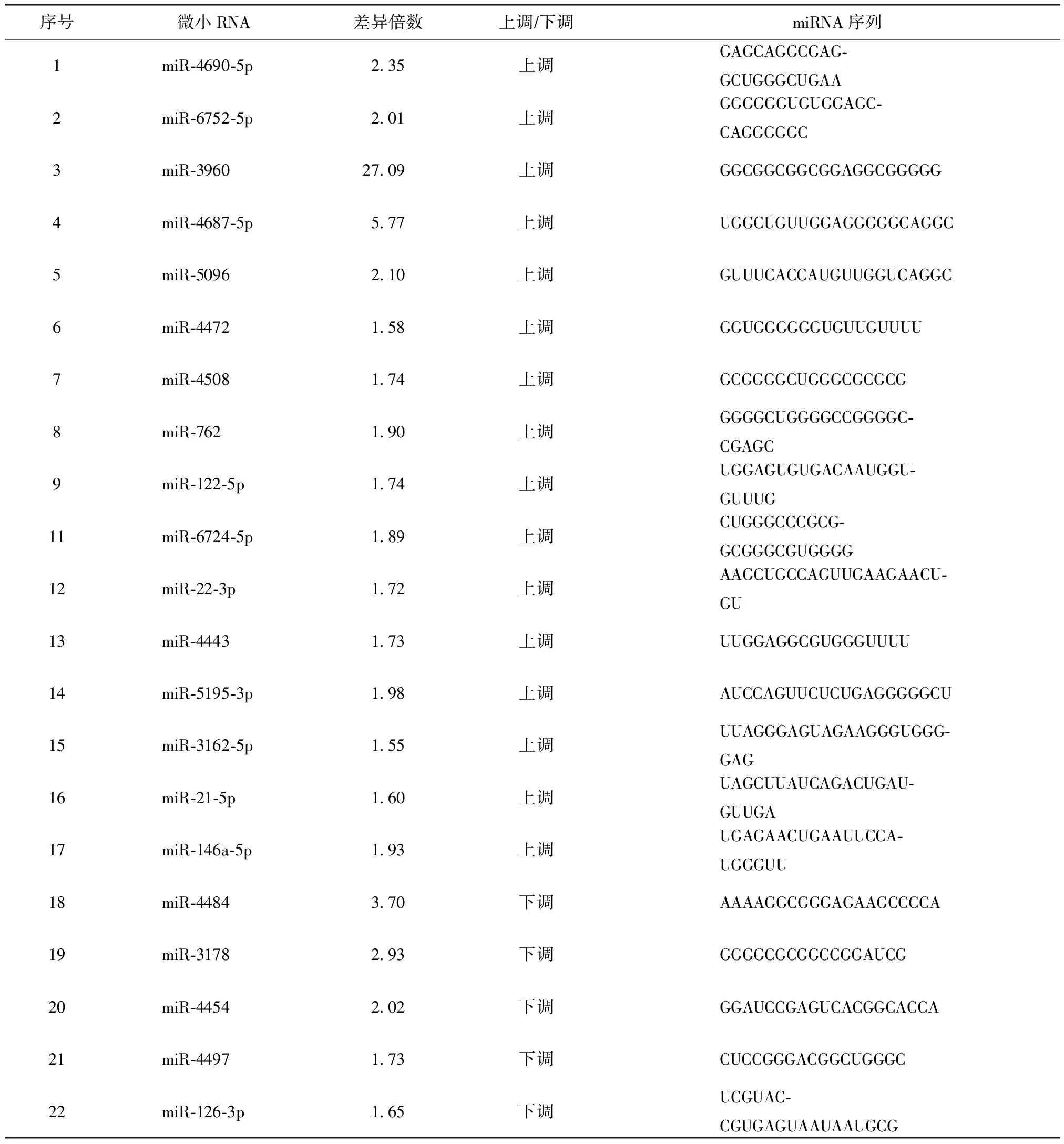
表1 原发性干燥综合征患者与健康受试者微小RNA血清差异表达
原发性干燥综合征患者与健康受试者微小RNA比较,差异均有统计学意义(P<0.01)
本研究首先通过微阵列芯片技术初步研究了pSS的miRNA谱,发现在健康人与pSS患者之间存在53条差异表达的miRNA,在pSS患者中有24个miRNA上调,29个miRNA表达下调。该结果提示,外周血清miRNA可能作为诊断pSS的分子生物标志物。通过既往基因库筛选和研究报道,选取两组比差异倍数在1.5倍以上的miRNA进行RT-PCR验证,结果发现,健康对照组和pSS治疗前组比较,miR-146a-5p、miR-4484和miR-4687-5p表达均上调,表达差异有统计学意义(P<0.05),说明在pSS患者中存在高表达的miRNA,且均参与了pSS疾病的发生与发展。治疗前组和治疗后组比较,miR-146-5p和miR-4484表达均下调,而miR-4687-5p表达依然上调,表明前两种miRNA经过药物治疗后明显降低,而miR-4687-5p表达治疗前后没有变化,提示部分miRNA可能参与了pSS发生发展的机制。PSS患者由于其外分泌腺长期存在慢性炎性反应,导致口、眼干燥为主要症状,同时合并出现关节痛、血管炎、血细胞减少、肾损害、肺间质病变等。经过糖皮质激素和免疫抑制剂等药物治疗后,随着miRNA的下降,患者病情得到控制达到缓解。
miR-146a对炎性反应有负反馈调节作用,这已成为类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病诊断和治疗研究中的热点之一[10]。Zilahi等[11]研究发现,与健康对照组相比,干燥综合征患者的外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中,miR-146a及TRAF6基因显著过表达,但是白细胞介素受体相关激酶(interleukin receptor-associated kinase,IRAK)-1水平却显著降低。Pauley等[12]对干燥综合征的研究结果与Zilahi等[11]相似,并发现在有干燥综合征倾向的小鼠中miR-146a表达也升高。本研究结果也与上述研究结果一致。可见miR-146a可以作为一种新型的生物学标志物,可以用来监测自身免疫性疾病病情的活动性。但miR-146a是否可作为pSS的特异性指标,还需要更多的研究和大量的临床试验确定。
miRNA通过对靶基因的表达调控而发挥作用,因此本研究通过TargetScan、miRanda及PicTar这3款软件预测了52个差异miRNA的靶基因,3款软件预测结果显示,miR-146a-5p共有799个可能的靶基因,miR-4484共有282个可能的靶基因,miR-4687-5p共有957个可能的靶基因。这些miRNAs作用靶点广泛,涉及细胞代谢、干细胞增殖和生长因子反应的相关基因。本实验中miR-146a-5p的靶基因有肿瘤坏死因子受体相关(tumor necrosis factor receptor-associated factor,TRAF)6、IRAK1、免疫球蛋白超家族成员(immunoglobulin superfamily member,IGSF)1、T细胞受体γ交替阅读框蛋白(T cell receptor gamma alternate reading frame protein,TARP)、红细胞膜相关蛋白(erythroid membrane associated protein,ERMAP)等,均与pSS关系密切的基因,由2种蛋白Toll样受体(Toll-like receptors,TLR)7和TLR9介导的炎性反应中重要的信号分子TRAF6和IRAK1是miR-146a的靶目标,这2种蛋白都是TLR和细胞因子信号通路中重要的信号蛋白,miR-146a通过抑制2种靶蛋白表达,实现对TLR信号通路的负反馈调节,从而防止炎性反应过激。另外,TLR4、TLR2、TLR5通路的激活及肿瘤坏死因子的刺激,同样会通过肿瘤坏死因子α、白细胞介素-1β等细胞因子的刺激,同样会通过核转录因子Kappa B诱导miR-146a的表达[13]。miR-146a可能作为一种新型的标志物替代具有创伤性的唇腺活检早期诊断干燥综合征。通过miRNA靶基因的基因本体与信号转导通路富集结果分析表明,Notch信号通路参与了pSS疾病的发生发展,研究表明对自身免疫疾病建模的小鼠进行Notch信号通路的干扰,发现其自身免疫性疾病会有所改善或恶化,提示Notch可能可以作为药物靶点治疗炎性疾病和自身免疫性疾病[14]。miRNA的靶基因预测和通路的富集分析为深入研究miRNA在早期pSS发生中的机制提供了重要的线索。
(本文图1、2见插页Ⅲ)
[1]Meqevand P,Chizzolini C,Chofflon M,et al.Cerebrospinal fluid Anti-SSA autoantibodies in primary Sjogrencs syndrome with central nervous system lnvolvement[J].Eur Neurol,2007,57:166.
[2]Kocijancic K,Kocijsncic I.Primary Sjogrencs syndrome asso- ciated with no Hodgkincs lymphoma of salivary gland andcystic lung disease[J].Coll Antropol,2006,30:925.
[3]Lee RC,Feinbaum RL,Ambros V.The C.elegans heterochronic gene lin-4 encodes smallRNAswith antisense complementarity to lin-14[J].Cell,1993,75:843-854.
[4]Sonkoly E,Pivarcsi A.Advances in microRNAs:implica-tions for immunity and inflammatory diseases[J].J Cell Mol Med,2009,13:24-38.
[5]Song J,Bai Z,Han W,et al.Identification of suitable reference genes for qPCR analysis of serum microRNA in gastric cancer patients[J].Dig Dis Sci,2012,57:897-904.
[6]Luo X,Tsai LM,Shen N,et al.Evidence for microRNA-mediated regulation in rheumatic diseases[J].Ann Rheum Dis,2010,69:i30-i36.
[7]Banales JM,Sáez E,Uriz M,et al.Up-regulation ofmicroRNA 506 leads to decreased Cl-HCO3-anion ex-changer 2 expression in biliary epithelium of patients with primary biliary cirrhosis[J].Hepatology,2012,56:687-697.
[8]Ninomiya M,Kondo Y,Funayama R,et al.Distinct microRNAs expression profile in primary biliary cirrhosis and evaluation of miR505-3p and miR197-3p as novel biomarkers[J].PLoS One,2013,8:e66086.
[9]Gu Y,Li M,Wang T,et al.Lactation-related microRNA expression profiles of porcine breast milk exosomes[J].PLos One,2012,7:e43691.
[10] 贾婷婷,王露楠.miR-146a在自身免疫性疾病发病机制及临床诊疗研究中的进展[J].中华检验医学杂志,2012,35:202-206.
[11] Zilahi E,Tarr T,Papp G,et al.Increased microRNA-146ab,TRAF6 gene and decreased IRAKI gene expressions in the peripheral mononuclear cells of patients with Sjögren’s syndrome[J].Immunol Lett,2012,141:165-168.
[12] Pauley KM,Stewart CM,Gauna AE,et al.Altered miR-146a expression in Sjögren’s syndrome and its functional role in innate immunity[J].Eur J Immunol,2011,41:2029-2039.
[13] Taganov KD,Boldin MP,Chang KJ,et al.NF-kappaB dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103:12481-12486.
[14] Palaga T,Minter LM.Notch signaling and its emerging role in autoimmunity[J].Front Biol,2012,5:1-16.

