性类固醇激素E2、MT对尼罗罗非鱼(Oreochromis niloticus)雌、雄生长差异的影响*
马细兰 张 勇 陈勇智 周立斌
(1.惠州学院生命科学系 生物技术研究所 惠州 516007;2.中山大学生命科学学院 水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室 广州 510275)
脊椎动物的繁殖和生长活动不但密切联系而且相互作用,生长激素受体(Growth hormone receptor,GHR)基因的mRNA表达在动物性腺中可普遍检测到,雌激素应答元件在哺乳动物GHR基因的5’调控区也有发现(Goodyer et al,2001)。性类固醇激素调节脊椎动物生长轴相关基因的表达存在一定物种的差异性。用雌二醇(17β-estradiol,E2)处理可降低兔肝脏 GHR mRNA 水平(Domené et al,1994),但提高大鼠肝脏GHR mRNA水平(Gabrielsson et al,1995)。雄激素对GHR的表达同样有影响,向垂体切除大鼠注射睾酮(Testosterone,T)可诱导其肝脏GHR mRNA水平上升(Zung et al,1999),说明T会促进生长激素GH介导的生理作用。雄激素和雌激素在调节动物的生长时可能起不同的作用,双氢睾酮(Dihydrotestosterone,DHT)促进生长,与此相反,E2抑制生长(Borski et al,1996)。
许多动物的雌雄个体存在较大差异,雌雄生长速度也存在差异,并且这种差异在动物性腺发育成熟时更为明显,这可能与性类固醇激素的不同分泌水平有关(Mandiki et al,2004,2005)。哺乳动物生长的性别二态性通过血液循环中的性类固醇激素、GH和IGF-I的相互作用来调节(Wehrenberg et al,1992)。许多鱼类有明显的生长性别二态性,尼罗罗非鱼是其中一种。尼罗罗非鱼雄鱼比雌鱼的生长明显要快,而且这种生长差异在性腺成熟时更加显著。
性类固醇激素对动物的生长有一定的影响,但其对鱼类雌雄生长差异的影响机理尚不清楚。为了进一步了解动物雌雄生长差异的内在原因,作者通过在体注射实验,比较了两种性类固醇激素(E2、MT)对雌、雄尼罗罗非鱼生长及生长轴相关基因(垂体GH、肝脏GHR1、IGF-I)mRNA表达的影响。
1 材料与方法
1.1 材料
尼罗罗非鱼采自广东省番禺国家级罗非鱼良种场,参照文献(马细兰等,2010),设计了长期注射和短期注射两个实验。实验室自配鱼用生理盐水(PS);雌二醇(17β-estradiol,E2)和甲基睾酮(17α-methyltestosterone,MT)均为美国Sigma公司产品(Sigma,America),溶于花生油后注射,浓度均为50μg/g体重。对于长期注射实验,分别在注射后第 0、2、6、10周采样,测体长、体重、肝重等,检测性类固醇激素对尼罗罗非鱼生长性能的影响;对于短期注射实验,则在注射后第 6、12、24h采样,采用Real-time PCR检测性类固醇激素E2、MT对生长轴基因(垂体GH、肝脏GHR1、IGF-I)mRNA表达的影响。实验试剂及仪器设备参照文献(马细兰等,2010)。
1.2 方法
1.2.1 生长性能分析 选用以下几种参数,计算公式如下:

1.2.2 生长轴相关基因表达分析 采用 Real-time PCR检测性类固醇激素(E2、MT)对垂体 GH、肝脏GHR、肝脏IGF-I mRNA表达的影响,各基因特异性引物参见表1。Real-time PCR方法参照文献(马细兰等,2010),略有修改。
2 结果
2.1 长期注射E2、MT对生长的影响
雄鱼在整个实验过程中的体重均大于雌鱼。从注射后42天起,E2明显促进雌鱼的生长(P<0.05),但不影响雄鱼的生长(P>0.05);MT明显增加雄鱼体重(P<0.05),但对雌鱼体重无显著影响(P>0.05)(图1)。

表1 荧光实时定量PCR分析所用引物Tab.1 Primers for real-time PCR
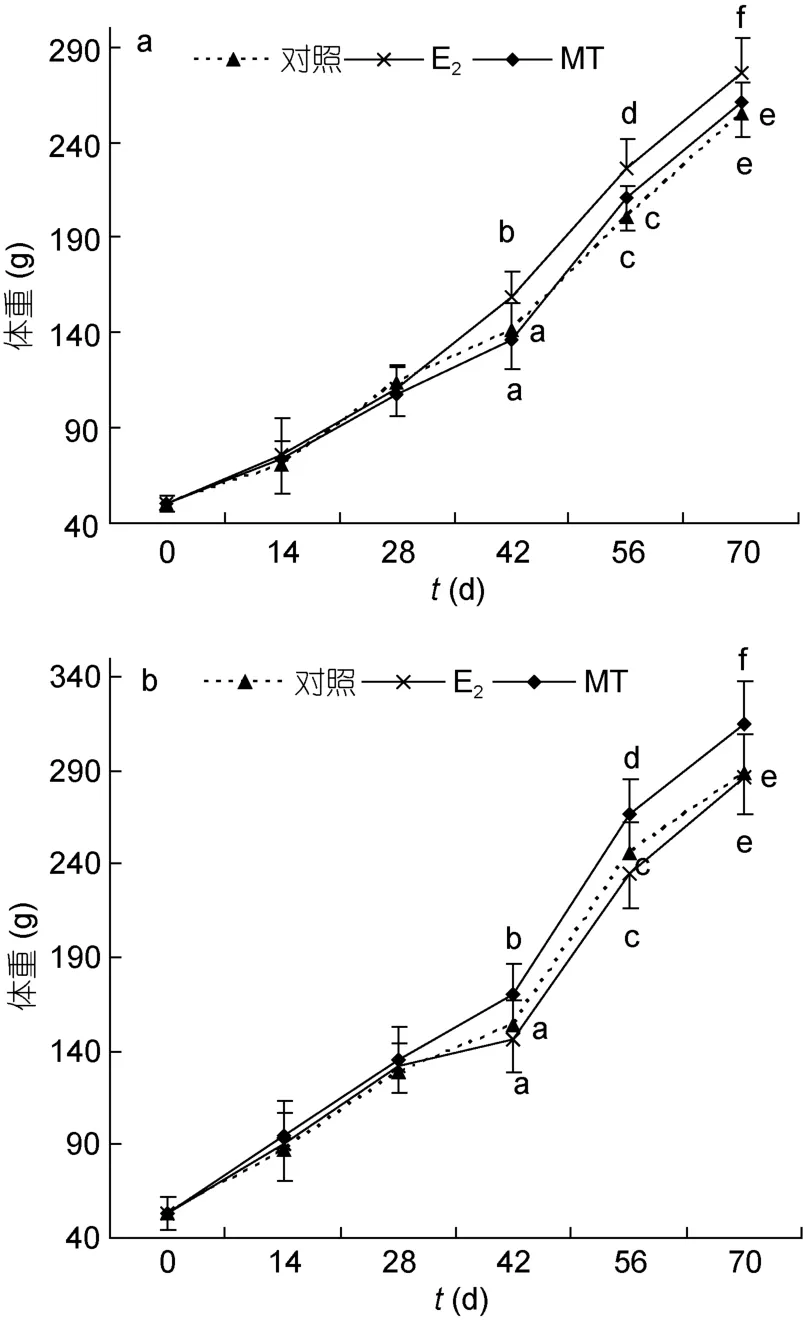
图1 性类固醇激素对尼罗罗非鱼体重的影响(a.雌鱼,b.雄鱼)Fig.1 Effects of steroid hormones on body weights of female(a)and male (b)Nile tilapia
性类固醇激素E2、MT既影响了尼罗罗非鱼体重,同时还影响了尼罗罗非鱼其它各项生长参数。由表2可以看出,性类固醇激素E2、MT对尼罗罗非鱼生长的影响存在明显的性别二态性。不同组鱼的肥满度(K)没有显著差异(P>0.05),性类固醇激素不影响尼罗罗非鱼的K(P>0.05);所有组中雌鱼的性成熟度(GSI)都显著高于雄鱼(P<0.05),但性类固醇激素对 GSI无显著影响(P>0.05);MT组雄鱼的肝体系数(HSI)显著高于其它组(P<0.05),MT显著提高雄鱼的HSI而不影响雌鱼的HSI,E2明显提高雌鱼的HSI(P<0.05),但对雄鱼的HSI无影响(P>0.05);E2显著提高雌鱼的绝对生长率(AGRW),提高了 24.16%,但不影响雄鱼的AGRW,MT显著提高雄鱼和雌鱼的 AGRW分别提高了 14.09%和 11.20%(表 2)。
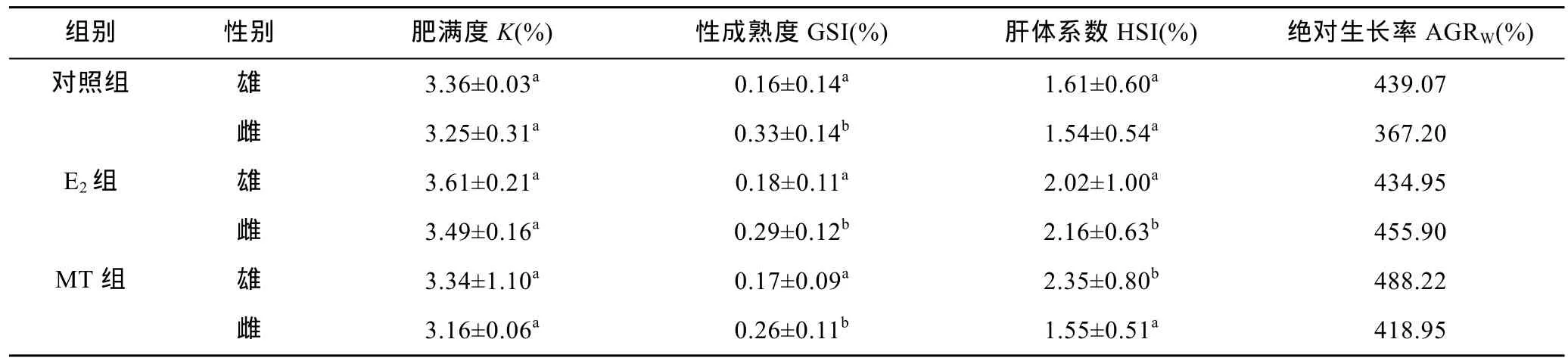
表2 生长参数(平均值±标准误,n=20)Tab.2 Growth parameters (mean values±S.D.,n=20)
2.2 长期注射E2、MT对生长轴相关基因表达的影响
2.2.1 垂体 GH mRNA 长期注射 E2可使雌鱼垂体GH mRNA水平明显升高(P<0.05),但对雄鱼垂体GH mRNA 的表达无显著影响(P>0.05);长期注射MT可显著提高雄鱼垂体 GH mRNA水平(P<0.05),但不影响雌鱼垂体GH mRNA的表达(图2)。
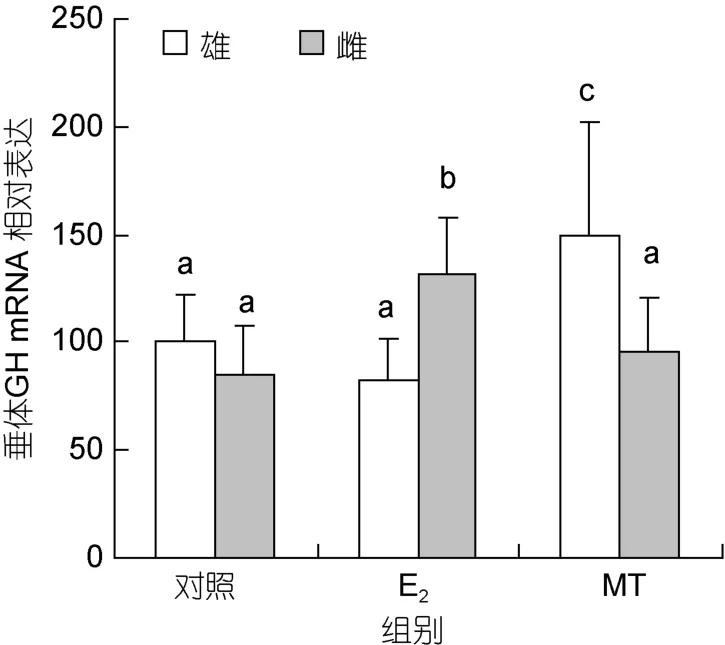
图2 性类固醇激素对尼罗罗非鱼垂体GH mRNA水平的影响Fig.2 Real-time PCR analysis on pituitary GH mRNA levels in Nile tilapia
2.2.2 肝脏 GHR1 mRNA 长期注射E2可促进雌鱼(P<0.05),但不影响雄鱼肝脏GHR1 mRNA的表达;长期注射MT,雄鱼肝脏GHR1 mRNA的表达有显著提高(P<0.05),对雌鱼无影响(图3)。

图3 性类固醇激素对尼罗罗非鱼肝脏GHR1 mRNA水平的影响Fig.3 Real-time PCR analysis on liver GHR mRNA levels in Nile tilapia
2.2.3 肝脏 IGF-I mRNA 长期注射 E2同时提高雌鱼和雄鱼肝脏IGF-I mRNA表达水平(P<0.05);长期注射MT,雄鱼肝脏IGF-I的mRNA表达显著提高(P<0.05),但对雌鱼无明显影响。E2对雌鱼肝脏IGF-I表达的促进作用低于 MT对雄鱼的促进作用(P<0.05)(图4)。
2.3 短期注射E2、MT对生长轴相关基因表达的影响
2.3.1 垂体 GH mRNA 短期注射性类固醇激素E2、MT,对尼罗罗非鱼垂体GH mRNA表达的作用显示出明显的性别二态性。注射E26h后,可快速、明显提高雌鱼垂体GH mRNA的表达,但显著降低雄鱼的表达(P<0.05);相反,注射MT 12h后,可明显提高雄鱼垂体GH mRNA的表达,但显著降低雌鱼的表达(P<0.05)(图5)。
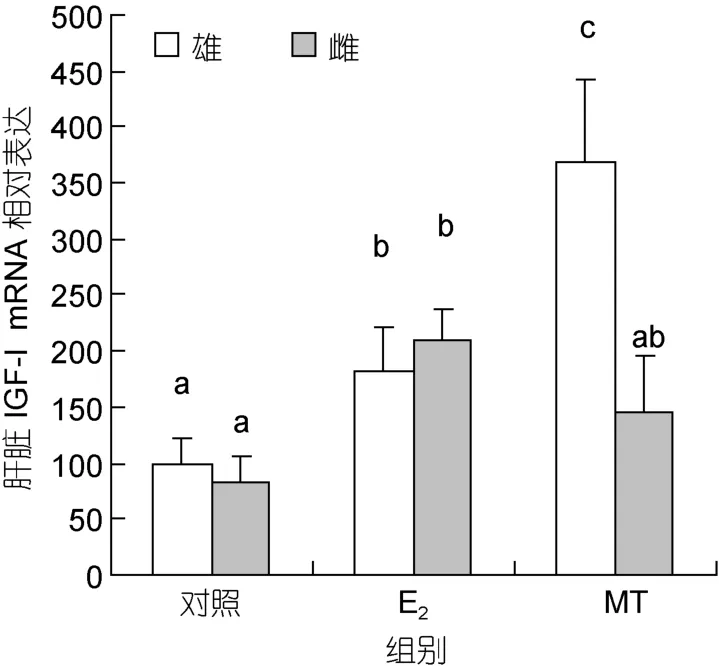
图4 性类固醇激素对尼罗罗非鱼肝脏IGF-I mRNA水平的影响Fig.4 Real-time PCR analysis on liver IGF-I mRNA levels in Nile tilapia
2.3.2 肝脏 GHR1 mRNA 性类固醇激素对尼罗罗非鱼肝脏 GHR1 mRNA表达的调节也存在性别二态性。E2作用12h后明显促进雌鱼肝脏GHR1 mRNA的表达(P<0.05),24h后小幅度下调雄鱼的表达(P<0.05);MT作用 12h后可明显提高雄鱼肝 GHR1 mRNA的表达(P<0.05),24h后可进一步提高雄鱼肝脏 GHR1的表达,24h后还可小幅度上调雌鱼肝脏GHR1 的表达(P<0.05)(图6)。
2.3.3 肝脏 IGF-I mRNA 性类固醇激素对尼罗罗非鱼肝脏IGF-I mRNA表达的调节同样存在雌雄差异性。注射E224h后,雌鱼肝脏IGF-I mRNA的表达明显升高,但雄鱼的表达受到抑制(P<0.05);MT作用 24h后显著提高雄鱼肝脏 IGF-I mRNA的表达(P<0.05),而对雌鱼肝脏IGF-I的mRNA表达则无显著影响(图7)。
3 讨论
对性类固醇激素调节哺乳动物生长的研究较多,对鱼类的研究较少。本文报道了性类固醇激素 E2、MT调节尼罗罗非鱼生长的性别二态性,即 E2、MT对尼罗罗非鱼雌、雄鱼的生长均有调节作用,并且这种调节作用存在明显的雌雄差异性。雄激素MT不但促进雄鱼还促进雌鱼的生长,并提高生长轴相关基因(垂体GH、肝脏GHR1、IGF-I)的mRNA表达水平;雌激素E2则仅促进雌鱼的生长和提高雌鱼垂体GH、肝脏GHR1、IGF-I的表达水平,对雄鱼的生长和生长轴相关基因的表达却有下调趋势。
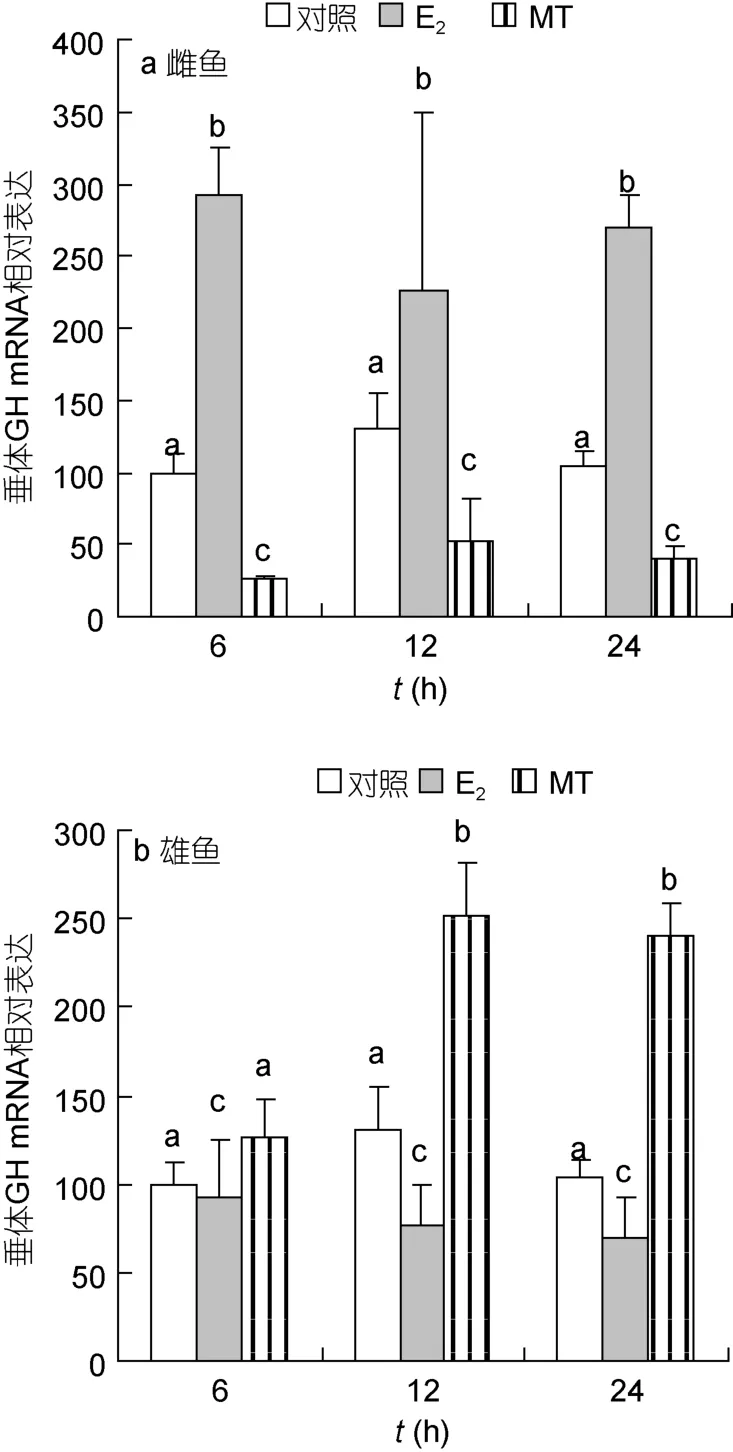
图5 性类固醇激素对尼罗罗非鱼垂体GH mRNA水平的影响Fig.5 Real-time PCR analysis on pituitary GH mRNA levels in Nile tilapia
尼罗罗非鱼雌鱼的性成熟度(GSI)显著高于雄鱼,提示雌鱼分配了更多的能量在生殖上,从而减少了在生长上的能量分配,这也是雌鱼生长比雄鱼慢的一个原因。
一方面,性类固醇激素可能通过影响鱼类的摄食、消化来影响生长,另一方面,也可能通过影响生长轴的激素水平、受体浓度、结合蛋白水平等来调节生长(Mandiki et al,2004,2005;Meinhardt et al,2006)。 对哺乳动物、鸟类、鱼类中雄性个体较雌性个体大的物种进行研究,结果表明雄激素同时也是一种代谢激素,可以促进动物的肌肉和骨骼生长。但十分有趣的是,雄激素不但不促进反而会抑制某些雌性个体较大的爬行类动物的生长(Cox et al,2005)。甲基睾酮(MT)可显著增加尼罗罗非鱼的摄食,并提其高生长速率,血清中 T的浓度雄鱼高于雌鱼,从而使雄鱼的生长速度显著高于雌鱼(Riley et al,2002)。在本研究中,甲基睾酮(MT)明显促进尼罗罗非鱼雄鱼的生长,原因可能包括以下几点: (1)MT可能增加了雄鱼的摄食,从而促进其生长;(2)MT可能提高了雄鱼肝脏GHR对GH的敏感性;(3)MT对雄鱼生长轴相关基因的mRNA表达均有促进作用,使雄鱼血清中的GH或IGF-I水平提高,从而加快雄鱼的生长。
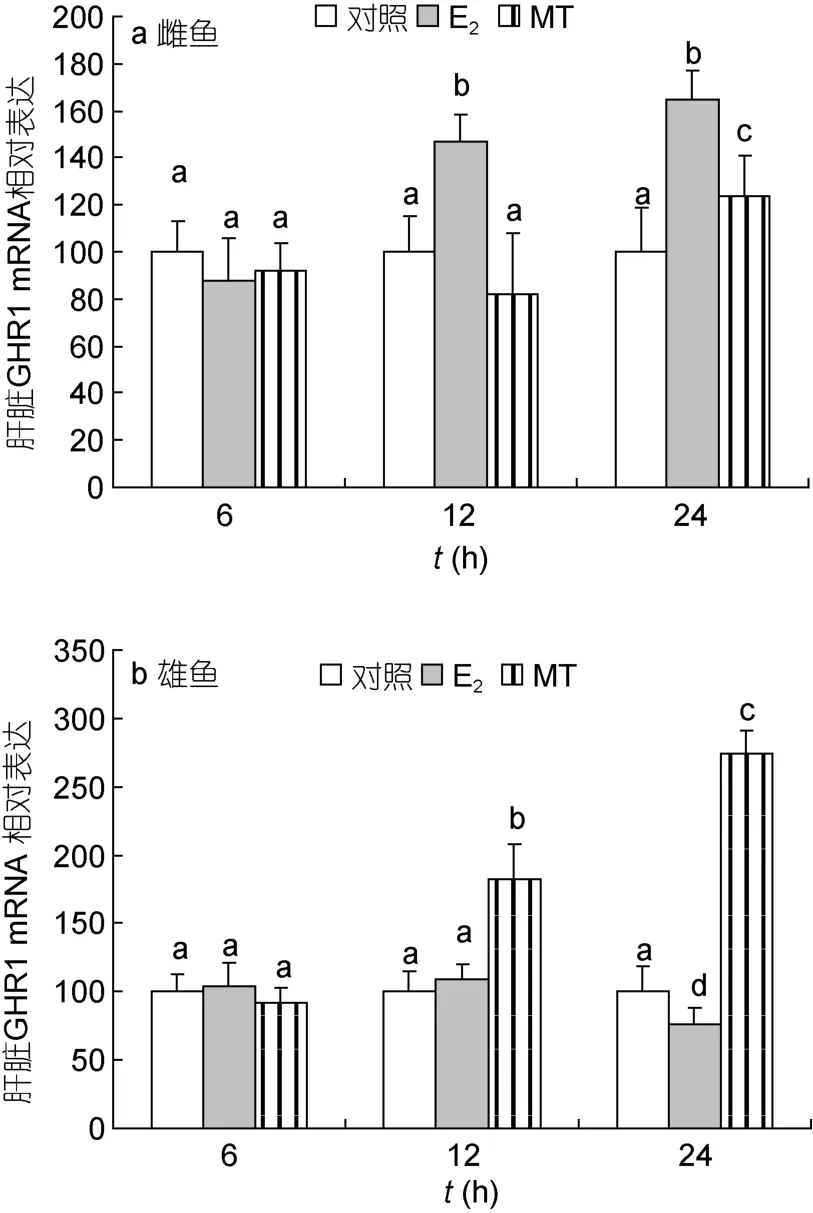
图6 性类固醇激素对尼罗罗非鱼肝脏GHR1 mRNA水平的影响Fig.6 Real-time PCR analysis on liver GHR mRNA levels in Nile tilapia
雄激素对哺乳动物生长激素受体GHR的影响表现出种间特异性。给兔注射睾酮T,可提高肝脏GHR mRNA的水平(Yu et al,1996),但不影响大鼠肝脏GHR mRNA水平(Gabrielsson et al,1995)。迄今,有关雄激素对硬骨鱼类GHR调节的研究报道不多。南方鲇在体注射MT后,肝脏GHR mRNA水平的显著升高(章力等,2006)。在本文中,给尼罗罗非鱼长期注射MT,可显著提高雄鱼肝脏GHR mRNA的水平,但对雌鱼没有显著影响,MT对尼罗罗非鱼肝脏 GHR mRNA的调节作用存在明显的性别差异性。
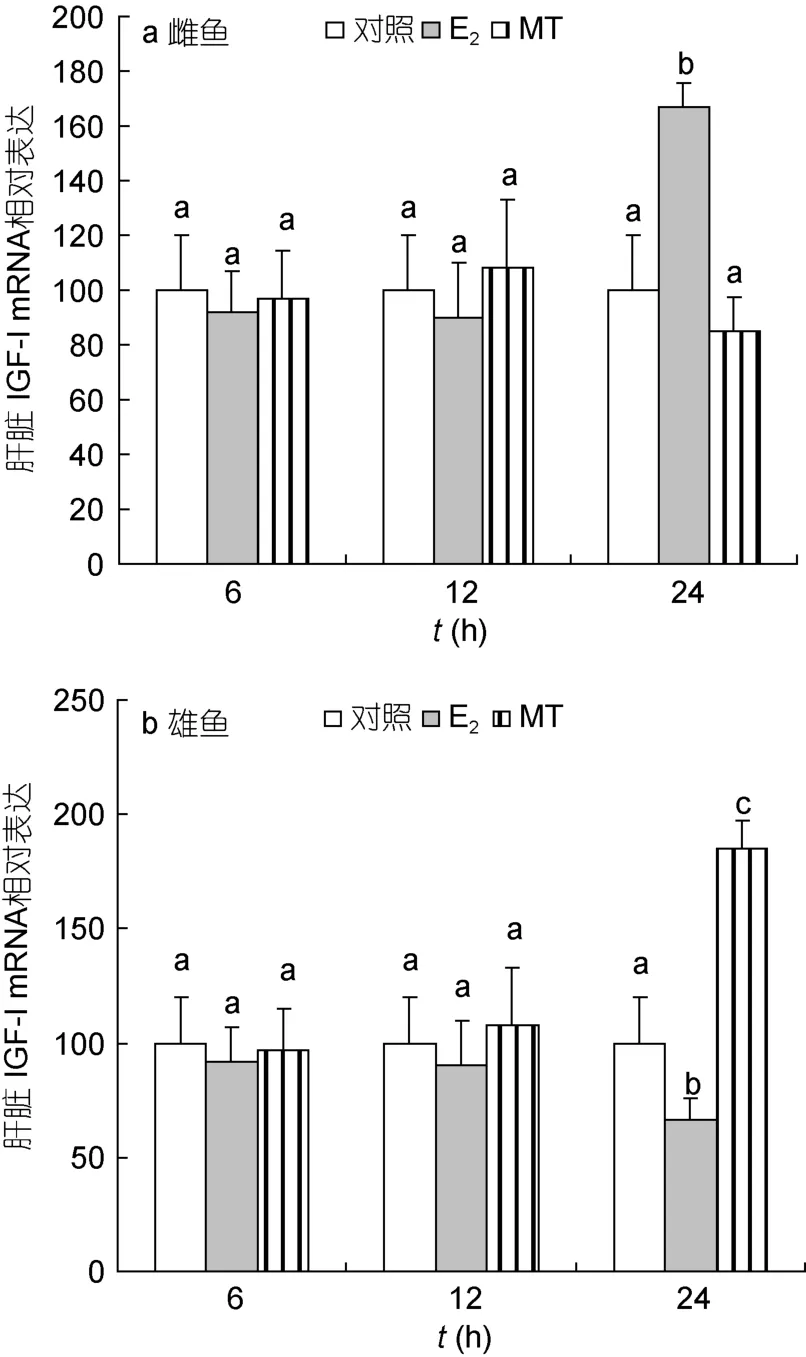
图7 性类固醇激素对尼罗罗非鱼肝脏IGF-I mRNA水平的影响Fig.7 Real-time PCR analysis on liver IGF-I mRNA levels in Nile tilapia
给尼罗罗非鱼注射雄激素 MT,雄鱼肝脏 IGF-I mRNA的表达有显著提高,该结果与前人研究报道一致。注射T、11-KT后,不影响银大麻哈鱼血清中GH水平,但显著提高血清中IGF-I、IGFBP-3的水平,提示血清中IGF-I水平的变化是性类固醇激素直接作用的结果,而非通过 GH来实现;亦或是通过提高肝脏对GH的敏感性来实现,也可能是因为提高了血清中IGFBP-3的水平(Larsen et al,2004)。
E2可提高性未成熟金鱼和虹鳟血清GH水平,一方面,E2可能通过影响下丘脑生长激素释放抑制因子(Somatotropin Release Inhibiting Factor,SRIF)及其受体来调节垂体GH的释放;另一方面,E2可能通过增大垂体中 GH细胞对下丘脑生长激素释放激素(Growth Hormone Releasing Hormone,GHRH)的敏感性来促进垂体 GH的分泌,使血清中 GH水平上升(Holloway et al,1997;Zou et al,1997)。切除成熟雌鼠的卵巢(去除了内源性 E2),鼠血清中 IGF-I的水平会上升,这时,若加入外源的 E2则会使血清中的 IGF-I水平降低,并且会抑制肝细胞的 IGF-I mRNA表达,使生长变慢(Borski et al,1996)。去势雄兔和性未成熟南方鲇经E2处理后,肝脏GHR mRNA水平都显著下降(Yu et al,1996;章力等,2006)。在本次研究中,尼罗罗非鱼注射雌激素 E2可明显提高雌鱼垂体 GH mRNA的水平,促进了垂体GH的合成。E2还促进尼罗罗非鱼雌鱼肝脏GHR1和IGF-I mRNA的表达,使生长轴上调,生长速度加快;相反,E2显著抵制雄鱼的生长和生长轴相关基因的表达,一方面,可能是E2能使雄鱼垂体的GH分泌模式雌性化,进而使其生长模式也雌性化,生长速度变慢;另一方面,可能是 E2显著降低了雄鱼肝脏GH和GHR mRNA的水平,使生长轴下调,生长速度变慢。
性类固醇激素对尼罗罗非鱼的生长及生长轴相关基因的表达有一定的影响作用,并且这种作用表现出明显的雌雄差异性,提示雄鱼和雌鱼体内的性类固醇激素水平不同有可能是引起雌鱼和雄鱼生长差异显著、个体差异明显的另一内在原因。
马细兰,张 勇,刘晓春等,2010.半胱胺盐酸盐(CSH)对尼罗罗非鱼(Oreochromis niloticus)生长及生长轴相关基因表达的影响.海洋与湖沼,41(2): 240—245
章 力,黄希贵,焦保卫等,2006.南方鲇两种生长激素受体的结构分析及其组织分布和激素调节.动物学报,52(6):1096—1106
Borski R J,Tsai W,DeMott-Friberg R et al,1996.Regulation of somatic growth and the somatotropic axis by gonadal steroids: primary effect on insulin-like growth factor I gene expression and secretion.Endocrinology,137(8): 3253—3259
Cox R M,John-Alder H B,2005.Testosterone has opposite effects on male growth in lizards (Sceloporus spp.)with opposite patterns of sexual size dimorphism.J Exp Biol,208:4679—4687
Domené H M,Marin G,Sztein J et al,1994.Estradiol inhibits growth hormone receptor gene expression in rabbit liver.Mol Cellul Endocrinol,103(1—2): 81—87
Gabrielsson B G,Carmignac D F,Flavell D M et al,1995.Steroid regulation of growth hormone (GH)receptor and GH-binding protein messenger ribonucleic acids in the rat.Endocrinology,136(1): 209—217
Goodyer C G,Zogopoulos G,Schwartzbauer G et al,2001.Organization and evolution of the human growth hormone receptor gene 5’-flanking region.Endocrinology,142(5):1923—1934
Holloway A C,Leatherland J F,1997.Effect of gonadal steroid hormones on plasma growth hormone concentrations in sexually immature rainbow trout,Oncorhynchus mykiss.Gen Comp Endocrinol,105(2): 246—254
Larsen D A,Shimizu M,Cooper K A et al,2004.Androgen effects on plasma GH,IGF-I,and 41-kDa IGFBP in coho salmon (Oncorhynchus kisutch).Gen Comp Endocrinol,139(1): 29—37
Mandiki S N M,Babiak I,Bopopi J M et al,2005.Effects of sex steroids and their inhibitors on endocrine parameters and gender growth differences in Eurasian perch (Perca fluviatilis)juveniles.Steroids,70(2): 85—94
Mandiki S N M,Houbart M,Babiak I et al,2004.Are sex steroids involved in the sexual growth Dimorphism in Eurasian perch juveniles?.Physiol Behav,80(5): 603—609
Meinhardt U J,Ho Ken K Y,2006.Modulation of growth hormone action by sex steroids.Clin Endocrinol,65(4): 413—422
Riley L G,Richman III N H,Hirano T et al,2002.Activation of the growth hormone/insulin-like growth factor axis by treatment with 17 α-methyltestosterone and seawater rearing in the tilapia,Oreochromis mossambicus.Gen Comp Endocrinol,127(3): 285—292
Wehrenberg W B,Giustina A,1992.Basic counterpoint:mechanisms and pathways of gonadal steroid modulation of growth hormone secretion.Endocr Rev,13(2): 299—308
Yu Y M,Domené H M,Stzein J et al,1996.Developmental changes and differential regulation by testosterone and estradiol of growth hormone receptor expression in the rabbit.Eur J Endocrinol,135(5): 583—590
Zou J J,Trudeau V L,Cui Z et al,1997.Estradiol stimulates growth hormone production in female goldfish.Gen Comp Endocrinol,106(1): 102—112
Zung A,Phillip M,Chalew S A et al,1999.Testosterone effect on growth and growth mediators of the GH-IGF-I axis in the liver and epiphyseal growth plate of juvenile rats.J Mol Endocrinol,23(2): 209—221

