临床T1aN0M0肺腺癌淋巴结转移预测因素分析
叶波 曹克坚 范利民 杨骏 胡定中 施建新 李志刚 方文涛 赵珩 陈海泉
临床T1aN0M0肺腺癌淋巴结转移预测因素分析
叶波 曹克坚 范利民 杨骏 胡定中 施建新 李志刚 方文涛 赵珩 陈海泉
目的 分析T1aN0M0肺腺癌患者淋巴结转移的危险因素。方法 在上海市胸科医院2011年1月至2012年12月行连续手术切除的5312例非小细胞肺癌患者中,选择273例临床分期为T1aN0M0肺腺癌的患者进行回顾性分析。根据CT检查结果分为纯磨玻璃影(GGO)、GGO带有实性成分(实性成分直径<5 mm)、部分实性结节(实性成分直径≥5 mm)及纯实性结节。对相关的临床资料及病理特征进行单因素和多因素分析,寻找淋巴结转移的高危因素。结果 入选的273例患者均行薄层CT扫描,其中103例(37.7%)为纯GGO,118例(43.2%)为GGO带有实性成分(实性成分直径<5 mm),13例(4.8%)为部分实性结节(实性成分直径≥5 mm),39例(14.3%)为纯实性结节。共有18例(6.6%)患者有淋巴结转移,N1和N2淋巴结转移者分别为11例(6.5%)和7例(4.1%)。所有纯GGO及实性成分直径<5 mm的患者术后均无淋巴结转移。多因素分析显示T1a肺腺癌患者淋巴结转移的危险因素为有症状、实性成分直径≥5 mm以及癌胚抗原(CEA)水平增高者(CEA>5 ng/ml)。多因素分析也显示纯实性结节的淋巴结转移因素为空气支气管征、肿瘤大小、有症状出现以及CEA水平增高者(95%CI:2.001~5.990,P=0.035;95%CI:1.000~3.980,P=0.021;95%CI:1.887~2.663,P=0.020;95%CI:1.514~8.498,P=0.013)。结论 临床分期为T1aN0M0的肺腺癌患者,如果影像学表现为实性成分直径<5 mm或表现为纯GGO者无淋巴结转移,应避免淋巴结清扫。但是对于临床上纯实性结节或者实性部分直径>5mm者,特别是CEA>5 ng/ml或者出现临床症状者,应该行系统性淋巴结清扫。
淋巴结; 肺腺癌; 癌,非小细胞肺; 临床分期
高分辨薄层CT能够检测到早期肺腺癌[1],提高了患者的存活率[2]。根据1995年进行的随机试验,目前采用的标准手术方式治疗临床分期ⅠA的非小细胞肺癌,是肺叶切除术与系统性淋巴结清扫[3]。自1995年以来,一些学者报道,肺腺癌表现为磨玻璃影(pure ground glass opacity,GGO)具有良好的预后:在大多数情况下,这类患者的病理特征表明肿瘤细胞的侵袭性较弱[4-8],而混合性GGO或纯实性结节更容易发生淋巴结转移。因此,对于临床分期T1aN0M0的肺腺癌患者是否需要系统性淋巴结清扫术尚有争议,未达成共识。临床分期T1aN0M0的肺腺癌可以根据其侵袭性进行分组,从而确定哪一类患者在系统性淋巴结清扫术中获益。在本回顾性研究中,我们试图确定临床T1aN0M0的肺腺癌患者淋巴结转移的危险因素。
资料与方法
一、病例来源和分组
回顾性分析上海市胸科医院2011年1月至2012年12月连续行手术切除的5 312例非小细胞肺癌患者的病史资料,该研究获得了上海市胸科医院伦理委员会的批准。所有患者术前均行增强胸部CT扫描,对于结节直径<2 cm的患者通常采用2 mm高分辨率薄层CT。其他常规术前检查包括心肺检查、脑磁共振成像或脑CT、骨扫描、腹部CT或者超声检查。根据薄层CT检查结果,患者被分为纯GGO组、混合GGO组和实性结节组。混合GGO组又被细分为GGO带有实性成分(实性成分直径<5 mm)组及部分实性组(实体成分直径≥5 mm)。GGO定义为轻微的均匀密度增加,但并不能掩盖肺内血管。混合GGO定义为GGO合并实性成分。纯实性结节定义为仅固体成分,无任何磨玻璃外观。共有 273例(5.1%)患者 CT检查结果表现为T1aN0M0,如果淋巴结短轴>1 cm则认为淋巴结转移。入选标准:(1)临床分期T1aN0M0的肺腺癌患者且肺部没有其他结节;(2)患者经历了系统性淋巴结清扫术;(3)患者行肺段或肺叶切除。排除标准:(1)CT显示淋巴结直径>1 cm考虑转移者或检查发现远处转移者;(2)曾经行新辅助化学治疗(化疗)或放射治疗(放疗)者;(3)既往有恶性肿瘤史者。
二、统计学方法
统计患者的年龄、性别、吸烟史、症状(包括咳嗽、痰血、低热、胸痛和胸闷)、肿瘤直径、GGO状态(GGO、混合性GGO和实性结节)、胸膜受累、空气支气管征、血清癌胚抗原(carcinoembryonic antigen,CEA)水平。分析以上因素和术后淋巴结转移之间的关系,以确定临床分期T1aN0M0的肺癌患者淋巴结转移的危险因素。采用χ2和Fisher检验进行单因素和多因素分析;采用单变量和多变量分析确定淋巴结转移的高危因素;采用Logistic回归分析进行多变量分析,使用IBM SPSS 2.0版统计软件。P<0.05表示差异有统计学意义。
结果
一、患者的基本资料
入选的273例肺癌患者中,男性128例,女性145例;年龄32~84岁,平均(62.4±9.8)岁。273例患者均行高分辨CT检查,其中103例(37.7%)患者表现为纯GGO,118例(43.2%)患者表现为GGO带有实性成分(实性成分直径<5 mm),13例(4.8%)患者为部分实性结节(实性成分直径≥5 mm),39例(14.3%)患者为纯实性结节。
二、淋巴结转移单因素分析
273例患者中,N1站和N2站淋巴结转移分别为11例(4.0%)和7例(2.6%)。在病理检查为N2站的7例患者中,有6例(85.7%)合并有N1站淋巴结转移,另1例(14.3%)有淋巴结跳跃式转移。单因素分析显示:诊断时患者的年龄、性别、吸烟史、肿瘤大小或充气支气管征与淋巴结转移不相关(表1)。
三、GGO状态与手术方法、淋巴结转移及病理类型的关系

表1 273例临床分期T1aN0M0肺腺癌患者的淋巴结转移单因素分析
所有纯GGO和GGO带有实性成分(实性成分直径<5 mm)的患者术后病理分期皆为N0。术后病理显示:纯实性结节的 39例患者中,16例(41.0%)有淋巴结转移(10例为N1站和6例为N2站);但在部分实性结节(实性成分直径>5 mm)的131例患者中,只有2例(1.5%)发生转移,N1站和N2站各1例。GGO状态与手术方式、淋巴结转移及病理学结果的关系见表2。标准肺叶切除为197例(72.2%),其中9例有N1站和3例有N2站淋巴结转移;段切除76例(27.8%),其中4例有N1站和2例有N2站转移。无淋巴结转移的患者中,非典型性腺瘤增生(atypical adenomatous hyperplasia,AAH)者20例(7.3%),原位腺癌(adenocarcinoma in situ,AIS)78例(28.6%),微浸润腺癌(minimally invasive adenocarcinoma,MIA)133例(76.9%)。
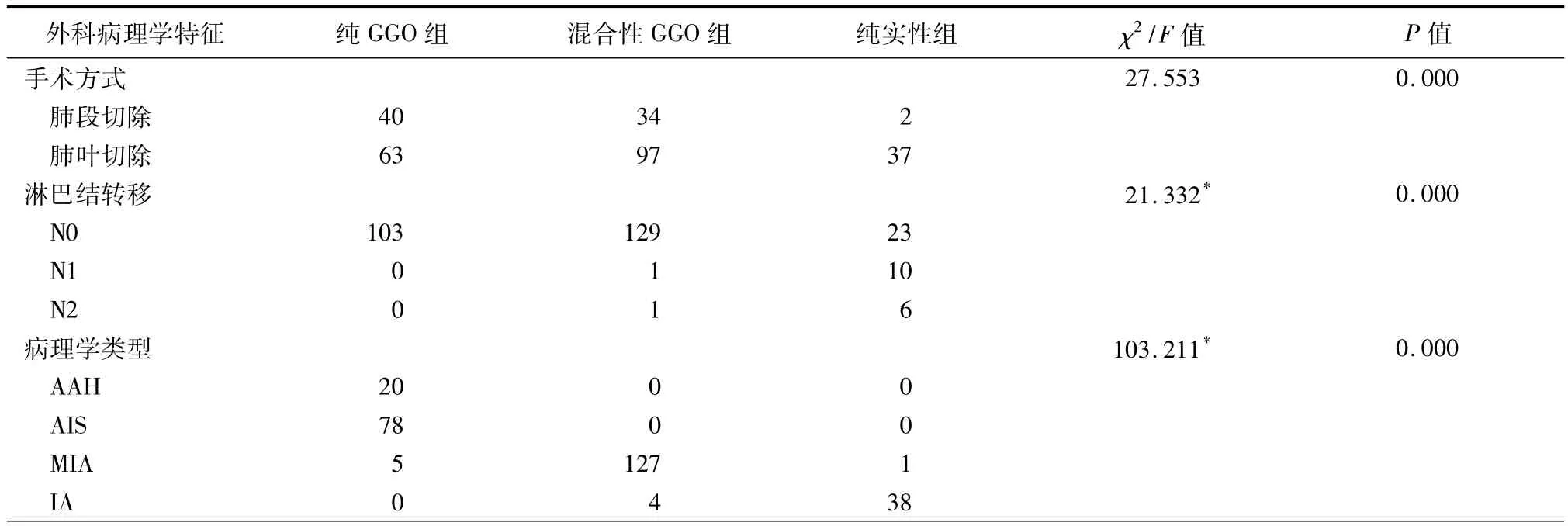
表2 肺腺癌患者CT检查GGO状态与手术方法、淋巴结转移及病理类型的关系
四、影像学结果与病理类型的相关性
影像学结果与病理类型的相关性显示:103例纯GGO组患者中,病理学检查结果显示AIS者78例(75.7%),AAH者20例(19.4%);131例混合性GGO组患者中,病理学检查结果显示MIA者127例(96.9%);39例纯实性结节患者中,病理学检查结果显示 38例(97.4%)为浸润性腺癌(invasive adenocarcinoma,IA),只有1例表现为纯实性结节的患者病理显示为黏液性腺癌。
五、临床分期T1aN0M0肺腺癌淋巴结转移的多因素分析
将以下因素,包括年龄、性别、症状、吸烟、肿瘤直径、GGO状态(GGO、混合GGO或纯实性结节)、胸膜受累、空气支气管征、血清CEA水平与淋巴结转移的关系进行多因素分析,结果显示GGO状态、症状和血中CEA水平升高可显著预测淋巴结的转移情况(P<0.05,表3)。

表3 临床分期T1aN0M0肺腺癌淋巴结转移的多因素分析
六、临床T1a期纯实体结节淋巴结转移的多因素分析
对临床分期T1a期纯实性结节进行多因素分析,包括诊断时患者的年龄、性别、症状、吸烟史、肿瘤直径、胸膜受侵、空气支气管征、CEA水平及病理类型,结果显示空气支气管征、肿瘤直径及血中CEA水平升高可显著预测淋巴结的转移情况(P<0.05,表4)。

表4 临床T1a期肺腺癌患者纯实体结节淋巴结转移的多因素分析
讨论
虽然2009年肺癌国际协会的指导中,临床ⅠA期的肺腺癌一般侵袭性较弱[9],但并不是所有临床分期为T1a期的肺腺癌都是如此。2011年新的肺腺癌分类是基于多学科方法来诊断的,结合了临床、分子学、影像学和手术方法等多个方面[10],支持了T1a期肺腺癌可以分组的概念。
如果我们能够可靠地识别与淋巴结转移的相关因素,系统性淋巴结清扫术在某些患者中可以避免[11]。尽管许多科学研究表明系统性纵隔淋巴结清扫术可有可无[5,8,12]。但本研究与以往研究不同的是:首先,本研究样本量可能是目前同类研究中最大的;其次,本研究包含了新的病理亚型及2011年新的肺腺癌分类;第三,本研究是目前唯一的对于临床分期为T1a期肺腺癌的研究。
以往研究表明,T1a期肺癌不伴纵隔淋巴结转移[12-13]。然而,在本研究中我们发现有 18例(6.6%)T1a期肺腺癌患者有淋巴结转移。因此,我们认为这些患者需要进行系统性淋巴结清扫术。
本研究还表明,临床分期T1a期肺腺癌有不同的侵犯模式。Hattori等[14]认为,肿瘤直径、纯实性结节、胸膜受累、空气支气管征、高CEA水平(>5ng/ml)和正电子发射断层扫描(positron emission tomography,PET)的最大标准摄取值(SUVmax值>5)是淋巴结转移的危险因素。
单因素分析显示:GGO状态、胸膜受累、血清CEA水平及病理类型是淋巴结转移的危险因素;而多因素分析显示:症状、GGO状态和异常CEA水平(>5 ng/ml)为淋巴结转移的重要预测指标。由于GGO状态相比肿瘤直径能更准确地预测,因此,我们认为单纯根据肿瘤大小并不能决定是否进行纵隔淋巴结清扫术。
此外,本研究还发现,103例GGO、78例AIS和5例MIA患者没有淋巴结转移。其中131例混合GGO(包括127例MIA和4例ⅠA)患者共有2例发生淋巴结转移(1例为实性结节,1例为ⅠA)。39例纯实性结节患者中,包括38例(97.4%)ⅠA和1例(2.6%)MIA,其中16例(41.0%)发生淋巴结转移。
因此,我们认为所有部分实性结节(实性成分>5 mm的GGO)或纯实性结节应进行系统淋巴结清扫术。Hattori等[14]也发现实性结节淋巴结受累的风险大,本研究也证实了这一点。Russell等[15]研究发现了Ⅰ~Ⅲ期肺腺癌亚型和临床特征之间的关系,显示 AIS、MIA、鳞屑为主型腺癌(lepidicpredominant adenocarcinoma,LPA)或浸润性黏液腺癌(invasive mucinous adenocarcinoma,IMA)等病理类型无淋巴结转移,该研究结果与我们的结果一致。同时,我们发现有AAH、AIS和MIA的患者无淋巴结转移,这意味着临床分期IA的肺腺癌中通过组织学分类有助于避免相当大比例的患者进行系统性淋巴结清扫术。本研究中,临床T1a期肺腺癌在薄层CT下表现为纯实性结节,淋巴结转移发生率很高。多因素分析表明,空气支气管征、肿瘤直径和异常CEA水平可显著预测淋巴结转移。因此,我们认为纯实性结节的患者必须进行系统淋巴结清扫。
然而,本研究毕竟是回顾性研究,且未统一使用PET扫描;此外,GGO状态与肺腺癌亚型分类之间的关系仍需进一步证实。因此,下一步应开展前瞻性随机对照试验以验证相关结果。
综上所述,本研究中的纯GGO患者均未发现淋巴结转移,因此应尽量避免系统性淋巴结清扫术。但纯实性结节或部分实性结节(实性结节直径>5 mm)患者由于淋巴结转移的可能性高,需进行淋巴结清扫,尤其是在患者CEA水平>5 ng/ml或有临床症状者。对于临床分期T1a期肺腺癌患者的手术方式,任何最终结论都应根据由JCOG0802[16]和CALGB-140503[17]进行的Ⅲ期临床试验结果验证。
1 National Lung Screening Trial Research Team,Aberle DR,Adams AM,Berg CD,et al.Reduced lung-cancer mortality with low-dose computed tomographic screening[J].N Engl J Med,2011,365 (5):395-409.
2 Rami-Porta R,Ball D,Crowley J,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the T descriptors in the forthcoming(seventh)edition of the TNM classification for lung cancer[J].J Thorac Oncol,2007,2(7):593-602.
3 Ginsberg RJ,Rubinstein LV.Randomized trial of lobectomy versus limited resection for T1N0non-small cell lung cancer.Lung Cancer Study Group[J].Ann Thorac Surg,1995,60(3):615-622.discussion 622-623.
4 NoguchiM, Morikawa A, Kawasaki M, et al. Small adenocarcinoma of the lung.Histologic characteristics and prognosis[J].Cancer,1995,75(12):2844-2852.
5 Suzuki K,Yokose T,Yoshida J,et al.Prognostic significance of the size of central fibrosis in peripheral adenocarcinoma of the lung[J].Ann Thorac Surg,2000,69(3):893-897.
6 Suzuki K,Asamura H,Kusumoto M,et al.“Early”peripheral lung cancer:prognostic significance of ground glass opacity on thinsection computed tomographic scan[J].Ann Thorac Surg,2002,74 (5):1635-1639.
7 SuzukiK, Kusumoto M, Watanabe S, etal. Radiologic classification of small adenocarcinoma of the lung:radiologicpathologic correlation and its prognostic impact[J].Ann Thorac Surg,2006,81(2):413-419.
8 Suzuki K,Koike T,Asakawa T,et al.A prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer(Japan Clinical Oncology Group 0201)[J].J Thorac Oncol,2011,6(4):751-756.
9 Detterbeck FC,Boffa DJ,Tanoue LT.The new lung cancer staging system[J].Chest,2009,136(1):260-271.
10 Travis WD, Brambilla E, NoguchiM, etal.International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J].Proc Am Thorac Soc,2011,8(5):381-385.
11 Allen MS,Darling GE,Pechet TT,et al.Morbidity and mortality of major pulmonary resections in patients with early-stage lung cancer: initial results of the randomized,prospective ACOSOG Z0030 trial[J].Ann Thorac Surg,2006,81(3):1013-1019,discussion 1019-1020.
12 Watanabe S,Oda M,Go T,et al.Should mediastinal nodal dissection be routinely undertaken in patients with peripheral smallsized(2 cm or less)lung cancer?Retrospective analysis of 225 patients[J].Eur J Cardiothorac Surg,2001,20(5):1007-1011.
13 Fukui T,Katayama T,Ito S,et al.Clinicopathological features of small-sized non-small cell lung cancer with mediastinal lymph node metastasis[J].Lung Cancer,2009,66(3):309-313.
14 Hattori A,Suzuki K,Matsunaga T,et al.Is limited resection appropriate for radiologically“solid”tumors in small lung cancers?[J]Ann Thorac Surg,2012,94(1):212-215.
15 Russell PA,Wainer Z,Wright GM,et al.Does lung adenocarcinoma subtype predict patient survival?A clinicopathologic study based on the new International Association for the Study of Lung Cancer/ American Thoracic Society/European Respiratory Society international multidisciplinary lung adenocarcinoma classification[J].J Thorac Oncol,2011,6(9):1496-1504.
16 Nakamura K,Saji H,Nakajima R,et al.A phaseⅢ randomized trial of lobectomy versus limited resection for small-sized peripheral non-small cell lung cancer(JCOG0802/WJOG4607L)[J].Jpn J Clin Oncol,2010,40(3):271-274.
17 Altorki NK,Pass HI,Miller DL,et al.Comparison of different types of surgery in treating patients with stage IA non-small cell lung cancer,ClinicalTrials.gov identifier:NCT00499330[DB/OL].Bethesda,MD:Clinical Trials Gov,2013.http://clinicaltrials.gov/ ct/show/NCT00499330.
Factors predicting lymph node metastasis in clinical stage T1aN0M0 lung adenocarcinomas
Ye Bo,Cao Kejian,Fan Limin,Yang Jun,Hu Dingzhong,Shi Jianxin,Li Zhigang,Fang Wentao,Zhao Heng,Chen Haiquan.Department of Thoracic Surgery,Shanghai Chest Hospital,Shanghai Jiao Tong University,Shanghai 200030,China
Zhao Heng,Email:h_zhao28@163.com
Objective To determine the risk factors of lymph node metastasis in clinical stage T1aN0M0 lung adenocarcinomas.Methods Among a consecutive of 5312 patients with non-small lung cancer undergoing surgical resection at Shanghai Chest Hospital between January 2011 and December 2012,the clinical records of 273 patients with clinical stage T1aN0M0 lung adenocarcinomas were retrospectively analysed.Preoperative CT categorized the tumors of 273 patients as pure ground glass opacity(GGO),GGO with minimal solid components(diameter of solid part<5mm),part-solid(diameter of solid parts≥5mm)and pure solid.Relevant clinicopathologic features were investigated to identify the risk factors of lymph node metastasis using univariate and multivariate analysis.Results Thin-section CT was performed among all the 273 patients,among whom 103(37.7%)were pure GGO,118(43.2%)GGO with minimal solid components (diameter of solid part<5 mm),13(4.8%)part-solid(diameter of solid parts≥5 mm),and the other 39 (14.3%)pure solid.There were 18(6.6%)patients with lymph node metastasis.The incidences of N1and N2nodal involvement were 6.5%(11 patients) and 4.1%(7 patients),respectively.No lymph node metastasis occurred in patients with pure GGO and GGO with minimal solid components(diameter of solid part<5mm).Multivariate analysis indicated that symptoms at presentation,diameter of solid parts≥5mm and increased carcinoembryonic antigen(CEA)titer were risk factors of lymph node metastasis of T1a lung adenocarcinomas.Multivariate analysis also revealed that air bronchogram sign,tumor size,symptoms at presentation and increased abnormal CEA titer were risk factors of lymph node metastasis of pure solid tumors(95%CI:2.001-5.990,P=0.035;95%CI:1.000-3.980,P=0.021;95%CI:1.887-2.663,P=0.020;95%CI:1.514-8.498,P=0.013).Conclusions Lymph node dissection should not be performed among patients of clinical stage T1aN0M0 lung adenocarcinomas with GGO with minimal solid components(diameter of solid part<5 mm),or among pure GGO with no lymph node metastasis.However,systematic lymph node dissection should be performed for pure solid tumors or part-solid,especially in patients with CEA >5 ng/ml or symptoms at presentation.
Lymph node; Lung adenocarcinomas; Carcinoma,non-small cell lung; Clinical stage
2014-11-02)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.01.006
上海市卫生局局级青年课题(20134y126)
200030 上海交通大学附属胸科医院胸外科
赵珩,Email:h_zhao28@163.com
叶波,曹克坚,范利民,等.临床T1aN0M0肺腺癌淋巴结转移预测因素分析[J/CD].中华胸部外科电子杂志,2015,1(1): 29-34.

