铅、镉胁迫下云南樟幼苗的生理特性变化
唐探 姜永雷 张瑛 等
摘要:选择原生长状况基本相同的云南樟半年生实生幼苗为研究材料,进行在不同浓度的铅、镉溶液浇灌下云南樟幼苗各项生理指标(丙二醛含量、叶片抗氧化酶活性、可溶性蛋白及游离脯氨酸含量)的测定。结果表明:在不同浓度的Pb2+、Cd2+胁迫下,MDA的含量略高于或显著高于对照,且总体呈上升的趋势;随着Pb2+、Cd2+处理浓度的增加,与对照组相比,SOD活性变化不显著,POD活性表现为先升高后降低的趋势;低浓度的Pb2+胁迫使得云南樟幼苗叶片内的可溶性蛋白含量明显减少,而在Cd2+胁迫下,其可溶性蛋白含量下降不明显;脯氨酸含量总体呈上升趋势;Pb2+、Cd2+对云南樟幼苗的毒害作用强度不同,在10 mmol/L的浓度下,Cd2+胁迫表现出更强的毒害作用。
关键词:云南樟;铅镉;胁迫;生理特性
中图分类号: Q945.78文献标志码: A文章编号:1002-1302(2015)01-0199-03
收稿日期:2014-02-15
基金项目:“省部级重点学科、省高校重点实验室及校实验室共享平台”资助项目;云南省应用基础面上项目(编号:2010ZC264)。
作者简介:唐探(1991—),男,江苏句容人,硕士研究生,研究方向为茶树资源。E-mail:tantan_1991@126.com。
通信作者:程小毛,博士,副教授,主要从事园林植物分子生物学研究。E-mail:30375713@qq.com。随着全球经济的发展,重金属污染已经成为一个严重的问题。在植物方面,重金属通过对植物生理生化过程的影响,如抑制叶绿素的生物合成,抑制各种参与植物生理生化过程的酶(如根系还原酶、各种氧化酶)以及影响蛋白质的生物合成等[1],导致植物生长发育不良,甚至引起死亡。
云南樟有净化有毒空气的能力,有抗癌功效,能吸烟滞尘、涵养水源、固土防沙和美化环境,过滤出清新干净的空气,具有较大的经济价值和观赏价值,因此云南樟成为南方许多城市和地区园林绿化的首选良木。但是目前关于云南樟在重金属方面的研究,尤其在铅、镉胁迫方面的研究较少。本试验通过对健康、原生长状况基本相同的2年生云南樟实生幼苗进行不同浓度的铅、镉溶液的处理,研究重金属铅、镉处理下云南樟幼苗生理特性(包括其丙二醛含量、可溶性渗透调节物质变化及抗氧化酶活性等方面)的变化,以便更好地了解云南樟幼苗对重金属胁迫的响应机制,为云南樟的扩大栽培及园林应用提供理论依据和科学指导。
1材料与方法
1.1试验材料
本试验选取云南樟(Cinnamomum glanduliferum)2年生实生苗为研究材料,选取健康并生长一致的苗木于2012年8月15日移栽到5L塑料盆中,基质为“红土 ∶珍珠岩 ∶腐殖土=3 ∶3 ∶2”的混合基质。
1.2试验设计
本试验共设5个组:对照CK,Pb2+处理A组,Pb2+处理B组,Cd2+处理A组,Cd2+处理B组。每组6盆,每盆1株。试验大棚内白天温度范围为20~30 ℃,夜间温度范围为9~18 ℃,相对湿度为35%~80%。处理时间从2012年9月10日至10月10日,共1个月时间。所有指标测定在处理结束时进行,每株选取从上到下的第三至第五片完全展开的叶作为生理生化指标的测定样品,每处理至少5株重复。
铅胁迫处理:分别用5 mmol/L Pb(NO3)2溶液(Pb2+A组)和10 mmol/L Pb(NO3)2溶液(Pb2+B组)进行处理,每处理10株,每株隔天均匀浇灌10 mL处理溶液,对照组用清水代替,再补充至水分充足。
镉胁迫处理:分别用10 mmol/L CdCl2溶液(Cd2+A组)和20 mmol/L CdCl2溶液(Cd2+B组)进行处理,每处理10株,每株隔天均匀浇灌10 mL处理溶液,对照组用清水代替,再补充至水分充足。
1.3测定项目及方法
1.3.1丙二醛含量的测定[2]叶片测定样品约0.2 g,在 6 mL 10%三氯乙酸中研磨,然后以12 000 r/min离心10 min。取上清液2mL,再加入2 mL 0.6%硫代巴比妥酸,充分反应后将装有反应液的试管置沸水浴30 min,然后在冰浴中迅速冷却。然后在10 000 r/min下离10 min,取上清液用分光光度计(Unicam UV-330,USA)测定其在440、532、600 nm处的吸光度。
1.3.2抗氧化酶活性的测定取约0.2g材料于5mL提取缓冲溶液(50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH值70,含1 mmol/L EDTA,体积分数0.05% Triton X-100,20 g/L 不溶性聚乙烯吡咯烷酮)中研磨成匀浆。经过 8 000 r/min 离心20 min,取上清液进行酶活性测定。过氧化物酶(POD):取约含100 μL的酶提取液加入3 mL酶反应液中(50 mmol/L Na2HPO4-NaH2PO4 缓冲溶液,pH值6.0,含 3 mmol/L 愈创木酚和2.5 mmol/L H2O2)中,充分混匀。于紫外-可见分光光度计上读取470 nm处吸光光度值在 2 min 内每2 s中的变化[3]。根据摩尔消光系数 39.4 mL/(mmol·cm),计算酶活性。
超氧化物歧化酶(superoxide dismutase,EC1.15.1.1,SOD):本试验依据超氧化物歧化酶抑制氮蓝思唑(NBT)在光下的还原作用来确定酶活性大小[4]。在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生氧负离子,氧负离子可将氮蓝四唑还原为蓝色的甲腙,后者在560 nm处有最大吸收。而SOD可清除氧负离子,从而抑制甲腙的形成。于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之亦然。据此可以计算出酶活性大小。
1.3.3可溶性蛋白含量的测定以50 mmol/L磷酸缓冲溶液(pH值7.8)为提取液[其中含0.1 mmol/L EDTA及 20 g/L PVP]。称取0.2 g叶片,用液氮研磨后,加入5mL提取液,进一步研磨成匀浆,离心10 min取上清液,加入G-250反应后在595 nm处测吸光值,方法参照Bradford等的方法[5]。
1.3.4游离性脯氨酸含量的测定游离脯氨酸的测定采用Bates等的方法[6]。叶片样品用3%的磺基水杨酸提取,匀浆在 8 000 r/min 离心10 min,上清液用于游离脯氨酸的测定。测定反应液包括2 mL提取液、2 mL冰醋酸和2 mL茚三酮,沸水浴60 min后在冰盒中终止反应。然后加入4 mL甲苯剧烈振荡以提取生成的有色产物,取上层有机层测定其在 520 nm 处的吸光度。标准曲线用L-脯氨酸制作。
1.4统计分析
所有的数据分析都利用SPSS11.5统计分析软件进行一元方差分析(one-way ANOVA),平均数间的多重比较采用Ducans检验方法。P<0.05时差异显著。
2结果与分析
2.1铅、镉胁迫对丙二醛(MDA)的影响
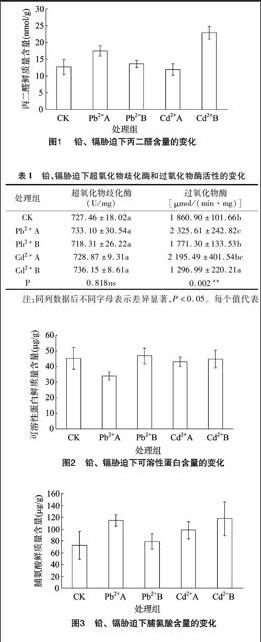
MDA是膜脂过氧化作用的最终产物,其含量是反映膜脂过氧化作用强弱和质膜受破坏程度的重要标志。试验显示(图1),与对照组相比,Pb2+处理下的MDA含量总体呈上升趋势,且Pb2+A处理组的MDA含量上升显著;Cd2+胁迫下,云南樟幼苗中MDA含量随着处理浓度的增加而呈上升的趋势,且与对照组相比,Cd2+B处理组下的MDA含量上升显著。
2.2铅、镉胁迫对叶片抗氧化酶活性的影响
试验显示(表1),铅、镉胁迫对云南樟幼苗的叶片抗氧化酶活性的影响存在差异。与对照组相比,5 mmol/L Pb2+处理下的过氧化物酶(POD)活性上升了25.0%,随着Pb2+胁迫浓度的进一步增大,POD活性呈下降趋势,10 mmol/L Pb2+处理下的POD活性相比5 mmol/L Pb2+处理下的POD活性下降显著。与对照组相比,10 mmol/L Cd2+处理下的POD活性上升显著,随着Cd2+胁迫浓度的进一步增大,POD活性显著下降,20 mmol/L Cd2+处理下的POD活性相比对照组和10 mmol/L Cd2+处理下的POD活性分别下降了30.30%和40.92%。重金属胁迫会引起超氧化物歧化酶(SOD)活性发生改变,但在本试验中Pb2+、Cd2+处理的SOD活性变化幅度较小。
表1铅、镉胁迫下超氧化物歧化酶和过氧化物酶活性的变化
处理组超氧化物歧化酶
(U/mg)过氧化物酶
[μmol/(min·mg)]CK727.46±18.02a1 860.90±101.66bPb2+A733.10±30.54a2 325.61±242.82cPb2+B718.31±26.22a1 771.30±133.53bCd2+A728.87±9.31a2 195.49±401.54bcCd2+B736.15±8.61a1 296.99±220.21aP0.818ns0.002**注:同列数据后不同字母表示差异显著,P<0.05。每个值代表5个重复的平均值±标准误;下表同。
2.3铅、镉胁迫对叶片可溶性渗透调节物质的影响
2.3.1铅、镉胁迫对叶片可溶性蛋白含量的影响可溶性蛋白含量变化可以作为检测植物叶片功能和衰老的一个指标[7]。由图2可以看出,在受到Pb2+胁迫时,云南樟幼苗叶片内的可溶性蛋白含量显著下降,且Pb2+A和Pb2+B处理组之间的可溶性蛋白含量差异显著。在受到Cd2+胁迫时,可溶性蛋白含量下降不明显。随着Pb2+、Cd2+浓度的进一步增大,云南樟幼苗可溶性蛋白含量变化不明显。
2.3.2铅、镉胁迫对叶片脯氨酸含量的影响试验显示(图3),在Pb2+胁迫下,与对照组相比,Pb2+处理的云南樟幼苗叶片中脯氨酸含量总体呈上升趋势,且Pb2+A处理组脯氨酸含量相比对照组上升明显。在Cd2+胁迫下,随着Cd2+浓度的增加,云南樟幼苗叶片中的脯氨酸含量均显著上升。表明云南樟幼苗在受到Pb2+、Cd2+胁迫时,可以通过自身脯氨酸含量的积累提高细胞的渗透势,并进行渗透调节以减少逆境胁迫下细胞组织的失水。
3结论与讨论
MDA是脂质过氧化产物之一,其含量高低可以反映植物遭受逆境伤害的程度,含量越高,植物遭受到的伤害越大[8]。本试验中,与对照组相比,不同浓度的Pb2+、Cd2+胁迫下,MDA的含量略高于或显著高于对照,且总体呈上升的趋势。这在覃勇荣等研究镉胁迫下的桑树幼苗叶片丙二醛含量动态分析中有类似报道[9]。说明在Pb2+、Cd2+胁迫下,云南樟幼苗叶片细胞内的活性氧增加,打破活性氧的代谢平衡,导致膜脂过氧化严重,膜结构遭到破坏,使细胞受到伤害。
SOD是植物体内抗氧化系统中的主要保护酶,能减少活性氧自由基对细胞膜系统的伤害[10-12]。本试验中,随着Pb2+、Cd2+处理浓度的增加,SOD活性变化不显著。这在前人研究中有过类似报道[13]。POD的主要作用是清除氧代谢中产生的H2O2,以及由此产生的有机过氧化物ROOH,在植物体内抗氧化代谢中起重要作用[14]。本试验中,在Pb2+、Cd2+胁迫下,POD活性表现为先升高后降低的趋势,这说明当POD活性随着胁迫浓度的增大而上升时,植物通过提高保护酶的活性来清除体内的自由基,当胁迫浓度达到一定值时,POD活性开始降低,这可能是由于其伤害程度超过了植株防御反应的阈值,酶的结构或合成受到破坏,从而使POD的活性丧失[15]。SOD和POD活性的差异也说明了在逆境胁迫下不同抗氧化酶所起的作用及机制并不相同,而在本试验中,云南樟幼苗主要通过提高POD的活性来清除Pb2+、Cd2+胁迫下产生的自由基及缓解其膜脂过氧化作用。
可溶性蛋白是重要的渗透调节物质。重金属毒害能够刺激蛋白酶的水解活性,使可溶性蛋白变性、降解,从而使酶参与的许多生理活动紊乱[16]。在本试验中,低浓度的Pb2+胁迫使得云南樟幼苗叶片内的可溶性蛋白含量明显减少,而在Cd2+胁迫下,其可溶性蛋白含量下降不明显,这可能是不同重金属胁迫下,可溶性蛋白含量的变化趋势不同,其原因有待于进一步研究。脯氨酸含量是反映植物受逆境胁迫的重要指标,对维持细胞水分平衡起着重要的作用,并具有清除活性氧的功能[16-18]。在本试验中,与对照组相比,Pb2+、Cd2+胁迫下的脯氨酸含量总体呈上升趋势,且Pb2+A、Cd2+A、Cd2+B处理组的脯氨酸含量显著上升,这与崔大练等的研究结果[19]一致,说明云南樟幼苗通过提高脯氨酸含量来提高细胞渗透势,维持细胞水分平衡。此外,相同浓度下,Cd2+A处理组脯氨酸含量明显高于Pb2+B处理组的含量,说明此时Cd2+对植物的伤害更加严重,植物会产生更多的脯氨酸来耐受重金属的伤害。
综上所述,云南樟幼苗在Pb2+A处理下,所测的生理指标大多数与对照差异显著,而在Pb2+B处理下,所测的所有生理指标与对照无明显差异,分析低浓度的Pb2+胁迫下,是否对云南樟幼苗的生理指标影响较大,而高浓度的Pb2+胁迫下对其生理指标无明显影响这一问题仍有待进一步研究。Cd2+胁迫下,与对照相比,Cd2+B处理组所测的生理指标相对于Cd2+A处理组的生理指标更加显著,综合各项指标看出,高浓度的Cd2+胁迫对云南樟幼苗的伤害程度更大。而同一浓度的重金属离子Pb2+、Cd2+对云南樟幼苗的胁迫程度也不同,在10 mmol/L的浓度下,Cd2+胁迫对云南樟幼苗的伤害更大。
参考文献:
[1]Ranieri A,Castagna A,Scebba F,et al. Oxidative stress and phytochelatin characterisation in bread wheat exposed to cadmium excess[J]. Plant Physiology and Biochemistry,2005,43(1):45-54.
[2]Hodges D M,Delong J M,Forney C F,et al. Improving the thiobarturic acid-reactive substances assay for estimating lipid peroxidtion tissues containing anthocyanin and other interfering compompounds[J]. Planta,1999(207):604-611.
[3]Lin J S,Wang G X. Doubled CO2 could improve the drought tolerance better in sensitive cultivars than in tolerant cultivars in spring wheat[J]. Plant Science,2002,163(3):627-637.
[4]Giannopolitis C N,Ries S K. Superoxide dismutase in higher plants[J]. Plant Physiology,1977,59:309-314.
[5]Bradford K J,Sharkey T D,Farquhar G D. Gas exchange,stomatal behavior,and δ13C values of the flacca tomato mutant in relation to abscisic acid[J]. Plant Physiology,1983,72(1):245-250.
[6]Bates L S,Waldren R P,Teare I D. Rapid determination of free proline for water-stress studies[J]. Plant and Soil,1973,39:205-207.
[7]俞慧娜,徐根娣,杨卫韵,等. 锰处理对大豆生理特性的影响[J]. 河南农业科学,2005(7):35-38.
[8]陈会,任艳芳,陈秀兰,等. 镉胁迫下不同耐性水稻植株幼苗生长和抗氧化酶的变化[J]. 江西农业大学学报,2012,34(6):1099-1104.
[9]覃勇荣,冯济梅,梁文忠,等. 镉胁迫下的桑树幼苗叶片丙二醛含量动态分析[J]. 河池学院学报,2012,32(2):17-21,59.
[10]陈倩,陶功胜,谢寅峰,等. 高氯酸钾胁迫对水稻幼苗光合作用及保护酶活性的影响[J]. 江苏农业学报,2013,29(4):715-721.
[11]周守标,王春景,杨海军,等. 菰和菖蒲对重金属的胁迫反应及其富集能力[J]. 生态学报,2007,27(1):281-287.
[12]王志颖,刘鹏. 柠檬酸抑制剂对铝胁迫下油菜抗氧化酶活性的影响[J]. 江苏农业学报,2013,29(5):957-966.
[13]李卜,吴妤,李奕松. 镉胁迫对枣树幼苗叶片生理特性的影响[J]. 北京农学院学报,2012,27(1):22-25.
[14]李文一,徐卫红,胡小凤,等. Zn胁迫对黑麦草幼苗生长、生理生化及Zn吸收的影响[J]. 农业工程学报,2007,23(5):190-194.
[15]原海燕,黄苏珍,郭智,等. 锌对镉胁迫下马蔺生长、镉积累及生理抗性的影响[J]. 应用生态学报,2007,18(9):2111-2116.
[16]袁沛果,龚玥绮,李卜,等. 镉胁迫对酸枣幼苗生长及生理特性的影响[J]. 北京农学院学报,2010,25(3):14-17.
[17]S mirnoff N. The role of active Oxygen in the response of plants to water deficit and desiccation[J]. New Photologist,1993,125(1):27-58.
[18]夏礼如,钱春桃. 复合钠盐胁迫对黄瓜幼苗生长及生理特性的影响[J]. 江苏农业学报,2013,29(1):147-150.
[19]崔大练,马玉心,俞兴伟. 重金属Zn2+·Cd2+对田菁生理生化指标的影响[J]. 安徽农业科学,2012,40(1):376-378.刘忠伟,裴占阳,陈伟,等. 倒毛鸡生物学特性、屠宰性能及肉质性状研究[J]. 江苏农业科学,2015,43(1):202-205.

