微小RNA-19a对肝细胞LO2脂肪分解代谢的影响
田晓玲, 林凤平△, 李伟民, 刘秀芬
(1咸宁市中心医院内分泌科, 湖北科技学院 2临床学院, 3药学院, 湖北 咸宁 437100)
微小RNA-19a对肝细胞LO2脂肪分解代谢的影响
田晓玲1, 林凤平1△, 李伟民2, 刘秀芬3
(1咸宁市中心医院内分泌科, 湖北科技学院2临床学院,3药学院, 湖北 咸宁 437100)
目的: 观察微小RNA-19a(microRNA-19a, miR-19a)对肝细胞LO2脂肪分解代谢的影响,并初步探索可能机制。方法: 在肝细胞LO2中转染miR-19a模拟物(mimics)或miR-19a抑制物(inhibitor),用实时荧光定量PCR检测miR-19a的水平变化,利用生物信息学网站查找miR-19a的靶点,进而用双萤光素酶报告基因实验验证miR-19a对过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)3’UTR活性的影响,通过Western blotting法检测PPARα及其下游脂肪分解代谢关键限速酶酰基辅酶A脱氢酶(acyl-coenzyme a dehydrogenase,ACADM)和肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)蛋白水平的变化,通过β-羟丁酸(beta-hydroxybutyric acid,β-OHB)试剂盒检测肝细胞LO2内酮体的生成能力。 结果: 转染miR-19a mimics可显著升高LO2细胞中的miR-19a水平(P<0.05),而转染miR-19a inhibitor可明显抑制LO2细胞中的miR-19a水平(P<0.05);生物信息学分析提示PPARα可能为miR-19a的潜在靶点,双萤光素酶报告基因实验证实了miR-19a mimics可使PPARα的3’UTR活性明显降低,miR-19a inhibitor可使PPARα的3’UTR活性显著升高,同时伴随PPARα及其下游基因ACADM和CPT1A的蛋白水平变化。此外,miR-19a mimics明显降低肝细胞LO2中β-OHB的含量(P<0.05),miR-19a inhibitor可明显上调肝细胞LO2中β-OHB的含量(P<0.05)。 结论: miR-19a可通过调控PPARα及其下游关键限速酶的表达,调节肝细胞的脂肪分解代谢能力。
微小RNA-19a; 过氧化物酶体增殖物激活受体α; 脂肪分解代谢
微小RNAs(microRNAs,miRNAs)作为一类非编码单链小RNAs,广泛存在于人体各组织脏器中,其可通过对靶基因mRNA的稳定性及翻译蛋白等过程进行调控,从而影响靶基因转录后的表达水平。近年研究发现,miRNAs在人类肿瘤、胚胎发育及代谢类等多种疾病中都扮演着重要作用[1-3]。微小RNA-19a (microRNA-19a,miR-19a)是miR-17-92 家族中的一员,miR-17-92家族在心、肺、血管及免疫系统的发育中不可或缺,也可调控多种恶性肿瘤的发生发展[4-5],但miR-19a在肝脏脂肪代谢中的作用尚不十分清楚。本文利用miR-19a模拟物(mimics)及抑制物(inhibitor)作为转染人肝细胞LO2作为模型,旨在研究miR-19a对肝细胞脂肪分解代谢的影响,并初步探索其可能的机制。
材 料 和 方 法
1 细胞与实验试剂
肝细胞LO2购自中科院上海细胞库。用含10%胎牛血清的DMEM培养基常规培养于5% CO2、37 ℃培养箱中。
胎牛血清、DMEM培养基及β-羟丁酸(β-hydroxybutyric acid,β-OHB)检测试剂盒购自南京凯基生物有限公司;转染试剂Lipofectamine 2000、逆转录试剂及荧光定量PCR试剂购自Invitrogen;抗过氧化物酶体增殖物激活受体α(peroxisome proliferators activated receptor α,PPARα)、抗酰基辅酶A脱氢酶(acyl-coenzyme a dehydrogenase, ACADM)、抗肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A, CPT1A)及抗GAPDH抗体购自CST;双萤光素酶报告基因试剂盒购自Promega。miR-19a模拟物、抑制物及miR-19a荧光定量PCR检测引物由广州锐博生物科技公司设计并合成。
2 实验方法
2.1 实验分组 将肝细胞LO2根据不同处理因素分为4组,其中转染miR-19a模拟物为过表达组(mimics组),转染miR-19a抑制物为低表达组(inhibitor组),转染无义序列的为阴性对照组(control组),未做转染的为空白对照组(blank组)。按照Lipofectamine 2000试剂说明书常规转染。将20 pmol的microRNA及6 μL脂质体分别稀释于250 μL无血清培养基,室温静置5 min后轻柔混匀,再室温静置10 min后均匀加入各组培养板中,使microRNA的终浓度为10 nmol/L,温箱培养6 h后换为完全培养基常规培养48 h行后续实验。
2.2 实时荧光定量PCR(real-time PCR) 收集各组转染48 h后的LO2细胞,Trizol一步法提取其中总RNA,常规逆转录合成cDNA,利用real-time PCR试剂盒扩增,ABI 7300检测并分析细胞中miR-19a的表达水平。
2.3 双萤光素酶报告基因实验 将LO2细胞以每孔1×105的密度接种于24孔板,第2天当细胞约融合至70%时,利用Lipofectamine 2000共转染包含有PPARα的3’UTR的萤光素酶质粒和miR-19a模拟物或抑制物,常规培养48 h后,按照双萤光素酶报告基因检测试剂盒在多功能分类光度计上测定并分析。
2.4 Western blotting实验 收集转染处理48 h后的LO2细胞,加入适量RIPA裂解液,获取细胞总蛋白液,加入适量SDS上样缓冲液100 ℃水浴解除蛋白交联。各组蛋白样品行聚丙烯酰胺凝胶电泳,PVDF 膜转膜,脱脂奶粉封闭1 h,然后依次孵育 I 抗4 ℃过夜及辣根过氧化物酶标记的 II 抗室温1 h后化学发光法显影,检测细胞中PPARα、ACADM及CPT1A的表达情况,以GAPDH作为内参照。
2.5 酮体生成实验 按照上述实验分组转染细胞,48 h后收集各组细胞,分别计数1×106个,利用-β羟丁酸检测试剂盒检测细胞内的β-OHB含量代表细胞的酮体生成能力,每组设3个复孔,实验重复3次。
3 统计学处理
用SPSS 12.0软件进行统计分析。实验数据以均数±标准差(mean±SD)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 在LO2细胞中过表达或低表达miR-19a
LO2中转染miR-19a mimics可升高LO2细胞中的miR-19a水平,mimics组显著高于阴性对照组(P<0.05);而转染miR-19a inhibitor可明显抑制LO2细胞中的miR-19a水平,inhibitor组显著低于阴性对照组(P<0.05),见图1。

Figure 1.miR-19a over-expression and low expression in LO2 cells by transfection. Mean±SD. n=3. *P<0.05 vs blank and control.
2 miR-19a对PPARα的3’UTR活性的影响
生物信息学分析提示PPARα 可能为miR-19a的潜在靶点。通过双萤光素酶报告基因实验证实miR-19a 能影响PPARα的3’UTR活性。miR-19a mimics可使PPARα的3’UTR活性降低约80%(P<0.05),而miR-19a inhibitor可使PPARα的3’UTR活性升高近6倍(P<0.05),见图2。
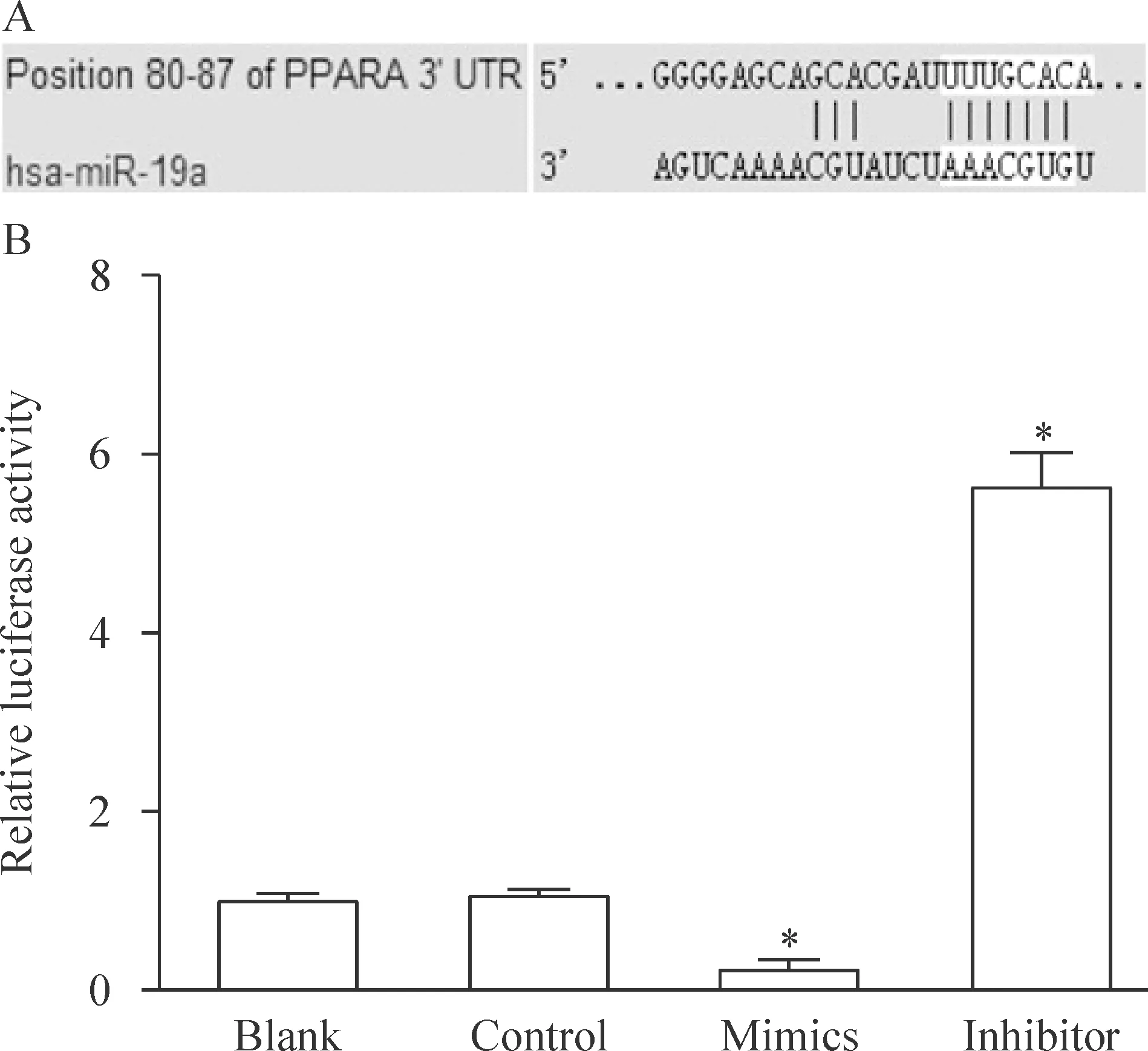
Figure 2.The effect of miR-19a on the activity of PPARα 3’UTR after transfection. A: the results of bioinformatic analysis about the interaction between PPARα 3’ UTR and miR-19α; B: the effect of miR-19a on the activity of PPARα 3’UTR in LO2 cells. Mean±SD. n=3. *P<0.05 vs blank and control.
3 miR-19a对PPARα及下游蛋白的影响
干预miR-19a后,利用Western blotting实验检测PPARα及其下游基因ACADM和CPT1A的蛋白水平变化,结果提示,与阴性对照组及空白对照组相比,miR-19a mimics可明显降低肝细胞LO2中PPARα及其下游ACADM和CPT1A的蛋白水平,提示过表达miR-19a可抑制PPARα为核心的脂肪代谢途径;而转染miR-19a inhibitor沉默miR-19a的表达后,PPARα及其下游ACADM和CPT1A的蛋白水平明显增加,提示沉默miR-19a可促进脂肪代谢,见图3。
4 miR-19a对LO2细胞酮体生成的影响
β-OHB是酮体的主要成分,代表细胞脂肪分解代谢生成酮体的能力,miR-19a mimics明显降低肝细胞LO2中β-OHB的含量(P<0.05);而miR-19a inhibitor明显上调肝细胞LO2中β-OHB的含量P<0.05),见图4。
讨 论
研究表明,miRNAs可通过结合在靶基因mRNA的3’UTR区域,促进该mRNA降解或抑制mRNA翻译形成蛋白质。miR-17-92家族具有相似的核苷酸序列及空间结构,可影响多种蛋白的转录后调控,目前认为在肿瘤的发生发展及胚胎发育器官形成等多种病理生理学进程中起重要的作用,但miR-19a作为该家族其中的一员,在细胞代谢中发挥何种功能尚不十分明确。我们通过生物信息学网站Targetscan对miR-19a进行分析,发现PPARα是在多个物种中高度符合的潜在靶点,而PPARα作为过氧化物酶体增殖物激活受体家族的重要成员,在脂代谢、糖代谢及脂蛋白合成等多个代谢信号转导通路中起核心调控作用,一般认为,PPARα是脂肪分解代谢过程中的关键蛋白,其上游可以受到氧浓度、应激、激素及糖脂水平等多种因素的调节,而PPARα可作为转录因子调控下游多个脂代谢限速酶如ACADM及CPT1A的表达[6-7]。

Figure 3.The effect of miR-19a on the protein levels of PPARα,ACADM and CPT1A in the LO2 cells after transfection. Mean±SD. n=3. *P<0.05 vs blank and control.
我们通过转染miR-19a的模拟物或抑制物,干预LO2细胞中miR-19a的水平,利用双萤光素酶报告基因检测miR-19a对PPARα的3’UTR活性的影响,证实miR-19a可以结合于PPARα的3’UTR区域,进而通过Western blotting实验在蛋白水平上证实miR-19a可以调控PPARα及其下游ACADM及CPT1A的表达。而既往研究表明ACADM及CPT1A主要参与脂肪的分解代谢,是控制脂肪酸代谢为酮体的关键限速酶[8-11],我们进而检测细胞内酮体主要成分之一的β-OHB的水平,同样也发现miR-19a可以显著影响LO2细胞中β-OHB的含量。

Figure 4.The effect of miR-19a on the generation of ketone body in LO2 cells after transfection. Mean±SD. n=3. *P<0.05 vs blank and control.
综上所述,我们的研究发现,在LO2肝细胞中干预miR-19a的表达,可以通过结合于PPARα影响肝细胞脂肪的分解代谢及酮体生成。本研究初步阐明了miR-19a调控脂肪代谢的分子生物学机制,为糖尿病、脂肪肝等糖脂代谢异常类疾病的临床治疗提供了新的药物靶点及监测指标。
[1] Liu HS, Xiao HS. MicroRNAs as potential biomarkers for gastric cancer[J]. World J Gastroenterol, 2014, 20(34):12007-12017.
[2] Neves VJ, Fernandes T, Roque FR, et al. Exercise training in hypertension: Role of microRNAs[J]. World J Cardiol, 2014, 6(8):713-727.
[3] Wegner M, Neddermann D, Piorunska-Stolzmann M, et al. Role of epigenetic mechanisms in the development of chronic complications of diabetes[J]. Diabetes Res Clin Pract, 2014, 105(2):164-175.
[4] Olive V, Li Q, He L. miR-17-92: a polycistronic oncomir with pleiotropic functions[J]. Immunol Rev, 2013, 253(1):158-166.
[5] Mogilyansky E, Rigoutsos I. The miR-17/92 cluster: a comprehensive update on its genomics, genetics, functions and increasingly important and numerous roles in health and disease[J]. Cell Death Differ, 2013, 20(12):1603-1614.
[6] Giby VG, Ajith TA. Role of adipokines and peroxisome proliferator-activated receptors in nonalcoholic fatty liver disease[J]. World J Hepatol, 2014, 6(8):570-579.
[7] Zeng L, Tang WJ, Yin JJ, et al. Signal transductions and nonalcoholic fatty liver: a mini-review[J]. Int J Clin Exp Med, 2014, 7(7):1624-1631.
[8] Leal J, Ades AE, Wordsworth S, et al. Regional differences in the frequency of the c.985A>G ACADM mutation: findings from a meta-regression of genotyping and screening studies[J]. Clin Genet, 2014, 85(3):253-259.
[9] Gagnon F, Aïssi D, Carrié A, et al. Robust validation of methylation levels association at CPT1A locus with lipid plasma levels[J]. J Lipid Res, 2014, 55(7):1189-1191.
[10]余慕雪, 沈振宇, 莫清萍, 等. 早期高蛋白饮食对SGA大鼠糖代谢的影响及脂联素-AMPK信号通路在其中的作用[J]. 中国病理生理杂志, 2012, 28(10):1812-1818.
[11]韩玲玲, 李 佳, 陈 颖, 等. 高脂环境对大鼠成肌细胞糖脂代谢的影响[J]. 中国病理生理杂志, 2011, 27(11):2156-2159.
Effect of miR-19a on lipid catabolism in hepatocyte LO2
TIAN Xiao-ling1, LIN Feng-ping1, LI Wei-min2, LIU Xiu-fen3
(1DepartmentofEndocrinology,XianningCentralHospital,2DepartmentofInternalMedicine;3DepartmentofPharmacology,HubeiUniversityofScienceandTechnology,Xianning437100,China.E-mail:lin3126@126.com)
AIM: To observe the effect of microRNA-19a (miR-19a) on the lipid catabolism of hepatocyte LO2, and to explore the potential mechanism. METHODS: miR-19a was over-expressed or silenced by transfection of miR-19a mimics or miR-19a inhibitor into LO2 cells, then the mRNA level of miR-19a was detected by real-time PCR. The potential target of miR-19a was found by the method of bioinformatics through internet website. The effect of miR-19a on the 3’ UTR of peroxisome proliferator-activated receptor α (PPARα) was measured by dual luciferase reporter assay, and the protein level of PPARα and its 2 major downstream rate-limiting enzymes involved in lipid catabolism, acyl-coenzyme a dehydrogenase (ACADM) and carnitine palmitoyltransferase 1A (CPT1A), were detected by Western blotting. Meanwhile, the effect of miR-19a on the generation of ketone body was measured by beta-hydroxybutyric acid (β-OHB) detection assay. RESULTS: The mRNA level of miR-19a was dramatically elevated by the transfection of miR-19a mimics, and sharply decreased by the transfection of miR-19a inhibitor (P<0.05). PPARα was found as a potential target of miR-19a, and dual luciferase reporter assay and Western blotting confirmed the regulatory effect of miR-19a on the expression of PPARα, with the protein level changes of ACADM and CPT1A. miR-19a mimics down-regulated, while miR-19a inhibitor up-regulated the concentration of β-OHB in LO2 cells (P<0.05). CONCLUSION: miR-19a regulates the lipid catabolism of hepatocytes by targeting the PPARα and its 2 downstream rate-limiting enzymes.
MicroRNA-19a; Peroxisome proliferator-activated receptor α; Lipid catabolism
1000- 4718(2015)03- 0481- 04
2014- 09- 28
2014- 12- 09
△通讯作者 Tel: 0715-8896219; E-mail: lin3126@126.com
R363
A
10.3969/j.issn.1000- 4718.2015.03.017

