香烟提取物通过减少HDAC2表达诱导小鼠C2C12成肌细胞衰老*
苏文燕, 刘文婷, 杨 霞, 白 晶, 何志义
(广西医科大学第一附属医院呼吸内科,广西 南宁 530021)
香烟提取物通过减少HDAC2表达诱导小鼠C2C12成肌细胞衰老*
苏文燕, 刘文婷, 杨 霞, 白 晶△, 何志义
(广西医科大学第一附属医院呼吸内科,广西 南宁 530021)
目的: 探讨香烟提取物(CSE)能否引起小鼠C2C12成肌细胞衰老,并研究成肌细胞衰老与组蛋白去乙酰化酶2(HDAC2)的关系。方法: 培养C2C12细胞株,分化为成熟成肌细胞,观察CSE干预对成肌细胞衰老和HDAC2表达的影响,采用real-time PCR和Western blot方法分别检测HDAC2 mRNA和蛋白的表达;β-半乳糖苷酶染色检测衰老细胞的百分率。结果: MTT法测定最佳CSE浓度与干预时间分别为60 mL/L和24 h。CSE干预后β-半乳糖苷酶染色阳性细胞数增加,同时伴有HDAC2 mRNA和蛋白表达的减少。四溴苯三唑(TBB)在促进HDAC2 mRNA和蛋白表达的同时,β-半乳糖苷酶染色阳性细胞数减少;用HDAC2的特异性阻滞剂丙戊酸抑制HDAC2 mRNA和蛋白的表达时,β-半乳糖苷酶染色阳性细胞数增加。结论: 香烟提取物可通过减少小鼠C2C12成肌细胞HDAC2的表达促进细胞老化。
香烟提取物; C2C12成肌细胞; 衰老; 组蛋白去乙酰化酶2
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)不仅仅是一种局限于呼吸道和肺部的疾病,还是一种可以累及肺外各器官的全身疾病,特别是骨骼肌萎缩和功能障碍,严重影响患者的生活质量及预后,导致运动耐力下降和生活质量的下降[1]。目前的治疗措施如营养支持治疗、康复训练等不能有效预防和改善COPD患者骨骼肌的变化[2-3],最根本的原因是对这一病理状态的发生机制还未完全清楚。近年研究显示[4-5],COPD是一种加速老化的肺部疾病,COPD发病机制与衰老密切相关,烟草烟雾/有害气体是联系老化肺脏与COPD的关键因素,烟草烟雾及其它污染物等环境气体可能加速了肺脏的衰老,或导致炎症清除缺陷,并在衰老过程中促进肺功能进行性恶化,肺部炎症加剧和肺气肿等结构性改变。近年来也已证实一些新型抗衰老分子可以成为COPD治疗的新靶点[6]。然而COPD的肺外表现,尤其是有关骨骼肌细胞衰老的研究目前尚少。本实验通过体外培养小鼠成肌细胞(C2C12细胞株)分化成成熟成肌细胞,观察香烟提取物干预后成肌细胞衰老和抗老化分子组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)表达的变化,探讨香烟提取物对小鼠C2C12成肌细胞衰老的影响及其相关机制,为进一步寻求COPD骨骼肌病变的发病机制和新防治策略提供实验依据。
材 料 和 方 法
1 材料
成肌细胞C2C12细胞株(中科院上海细胞库);DMEM 培养基、胎牛血清、马血清(Gibco);胰蛋白酶(碧云天公司);香烟(万宝路公司);HDAC2激动剂四溴苯三唑(4, 5, 6, 7-tetrabromobenzotriazole,TBB,Sigma);HDAC2特异性抑制剂丙戊酸(南宁生利德公司);β-半乳糖苷酶染色试剂盒(上海杰美公司);RNA逆转录试剂盒、SYBR Premix Ex TaqII染料法荧光定量试剂盒(TaKaRa);小鼠HDAC2 I抗(CST)及II抗(中杉公司); 抗小鼠抗GAPDH I抗(Proteintech)。
2 方法
2.1 C2C12细胞的培养 10%牛血清培养基培养C2C12细胞,放入5% CO2、37 ℃培育箱培养,待细胞长到80%左右,更换成分化培养基(含10%马血清的培养基)继续培养。分化4~5 d后待95%以上的细胞出现肌管[7-8]时即可用于实验。
2.2 MTT法和细胞β-半乳糖苷酶染色观察最佳CSE干预浓度和时间 收集对数期的细胞,制成浓度为1×107/L细胞悬浮液,在 96孔板中每孔加入100 μL细胞悬液,每个浓度设5个平行孔。第1列只加100 μL培养基,作为调零孔;第2列加入100 μL细胞悬液,不加CSE,作为空白对照组。待细胞完全贴壁后,其余各列分别加入CSE,使得终浓度分别为20、40、60、80、100、120 mL/L。培养0、12、24、48、72 h后每孔加入20 μL MTT(5 g/L),4 h后小心弃上清,每孔加入150 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪波长为 490 nm处测量各孔的吸光度(A)值。
收集已分化好的细胞制成细胞悬液接种于6孔板中,细胞数为每孔5×105。待细胞完全贴壁后加入不同浓度的CSE干预, CSE终浓度分别为0、20、40、60、80、100和120 mL/L。干预24 h后行β-半乳糖苷酶染色,蓝染细胞为阳性细胞。200 倍显微镜随机选取视野,计数每个视野里阳性细胞,每个浓度观察5 个视野,染色重复3次,取平均值。
2.3 Western blot检测CSE刺激下HDAC2蛋白的表达 收集已分化好的细胞制成细胞悬液接种于6孔板中,细胞数为每孔5×105。细胞分为24 h对照组、24 h CSE组、48 h对照组、48 h CSE组、72 h对照组、72 h CSE组。待细胞完全贴壁后加入终浓度为60 mL/L CSE干预,干预时间如分组时间所示。待干预结束后各组细胞用胰酶消化,用PBS清洗3遍,1 000 r/min离心10 min。弃上清,加入100 μL细胞裂解液(碧云天公司),加入1 μL PMSF后在冰上裂解30 min,每间隔10 min振荡30 s,离心后弃沉淀,吸取2 μL上清测蛋白浓度。取总蛋白50 μg上样,SDS-PAGE 分离,然后电转移至PVDF膜,50 g/L脱脂奶粉封闭1 h,封闭后的滤膜再分别与小鼠抗HDAC2抗体(稀释比为 1∶1 000)、小鼠抗GAPDH抗体(1∶10 000) 4 ℃温育过夜。HRP 偶联的 IgG 作为 II 抗(稀释比为 1∶10 000)室温温育 1 h,暗室胶片曝光显影、定影。Bio-Rad公司的全自动扫描仪扫描胶片,Quantity One软件分析结果。
2.4 观察CSE刺激下成肌细胞HDAC2与衰老的关系 取成熟的成肌细胞接种于6孔板中,分为:(1)对照组(不加任何干预,培养48 h);(2)CSE组(不加任何干预培养24 h后,加入终浓度为60 mL/L CSE继续孵育24 h);(3)TBB组(终浓度为25 μmol/L,孵育48 h);(4)TBB+CSE组(TBB终浓度为25 μmol/L,预孵育24 h后加入终浓度为60 mL/L CSE继续孵育24 h);(5)丙戊酸组(终浓度为20 μmol/L,孵育48 h);(6)丙戊酸+CSE组(丙戊酸终浓度为20 μmol/L,预孵育24 h后加入60 mL/L CSE继续孵育24 h)。干预结束后,收集各组细胞,经β-半乳糖苷酶染色;Western blot 方法检测HDAC2蛋白表达;real-time PCR检测各组细胞中HDAC2 的mRNA表达,方法如下:将上述每组细胞均加入1 mL TRIzol提取总RNA,然后按照TaKaRa逆转录试剂盒说明逆转录成cDNA,用实时荧光定量PCR仪(Roche)行逆转录反应,反应体系为20 μL。HDAC2的上游引物为5’-AGCCCATGGCGTACAGTCAA-3’,下游引物为5’-GGGATGACCCTGGCCATAATAA-3’;GAPDH的上游引物为5’-TGTGTCCGTCGTGGATCTGA-3’,下游引物为5’-TTGCTGTTGAAGTCGCAGGAG-3’。反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,扩增40个循环。扩增结束后基因的相对表达量用2-ΔΔCt法计算比较。
3 统计学处理
应用SPSS 16.0统计分析软件检测实验数据的正态性分布,正态分布的计量资料采用均数±标准差(mean±SD)表示。组间比较用方差分析,正态分布不齐的计量资料用秩和检验。以P<0.05为差异有统计学意义。
结 果
1 C2C12细胞分化为成熟成肌细胞
细胞呈成纤维状态。分化第3天出现部分肌细胞。至第4天、第5天,95%以上细胞分化为长圆柱形,每个细胞含多个细胞核,核呈扁椭圆形的成熟骨骼肌细胞,可用于实验,见图1。
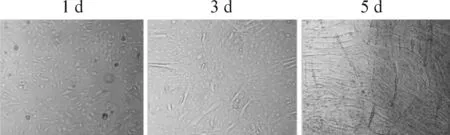
Figure 1.The different stages of C2C12 cells differentiated into skeletal muscle cells.
图1 C2C12细胞逐渐分化为成熟成肌细胞
2 不同浓度CSE对成肌细胞活性和衰老的影响
MTT法显示随着CSE浓度增加,干预时间越长,对成肌细胞活性的抑制作用越大。浓度小于60 mL/L的CSE在12 h、24 h对细胞生长并无明显抑制作用。当浓度大于80 mL/L时,细胞生长明显受到抑制,见图2、表1。

Figure 2.TheAvalues of the C2C12 myoblasts treated with different concentrations of CSE at various time points. Mean±SD.n=5.
图2 不同浓度CSE干预下C2C12成肌细胞各时点的A值
β-半乳糖苷酶定位在细胞质,是衰老细胞的特异性指标,染成蓝色为阳性细胞。CSE干预24 h内,当CSE浓度在一定浓度范围内(CSE<60 mL/L),随着CSE浓度的增加,衰老细胞数量增加,继续增加CSE浓度时,细胞出现形态缩小,核碎裂,继而死亡。故本实验将CSE干预的终浓度和时间分别设定为60 mL/L、24 h,见图3。
表1 不同浓度CSE干预下C2C12成肌细胞各时点的A值
Table 1.TheAvalues of the C2C12 skeletal muscle myocytes treated with different concentrations of CSE at various time points (Mean±SD.n=5)

CSE0h12h24h48h72h0mL/L0.94±0.070.94±0.070.95±0.020.95±0.070.98±0.0620mL/L0.94±0.060.94±0.060.93±0.050.89±0.06*0.85±0.08*40mL/L0.95±0.070.94±0.070.92±0.030.87±0.06*0.85±0.06*60mL/L0.94±0.080.93±0.040.91±0.050.84±0.07*0.80±0.07*80mL/L0.93±0.060.76±0.06*0.62±0.07*0.57±0.04*0.51±0.06*100mL/L0.94±0.040.67±0.06*0.58±0.07*0.54±0.05*0.48±0.07*120mL/L0.93±0.050.58±0.07*0.46±0.08*0.43±0.03*0.42±0.06*
*P<0.05vs0 mL/L group at the same time point.
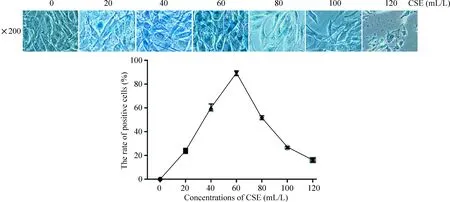
Figure 3.The positive cell rate of β-galactosidase staining in the C2C12 myoblasts treated with different concentrations of CSE.Mean±SD.n=3.
图3 不同CSE浓度干预下小鼠C2C12成肌细胞内β-半乳糖苷酶的表达
3 CSE刺激下成肌细胞HDAC2蛋白的表达
在浓度为60 mL/L的CSE作用下,24 h CSE组、48 h CSE组、72 h CSE组的HDAC2蛋白表达均较相同时点的对照组显著下降(P<0.05);随着CSE干预时间的增加,HDAC2蛋白表达呈递减趋势,见图4。
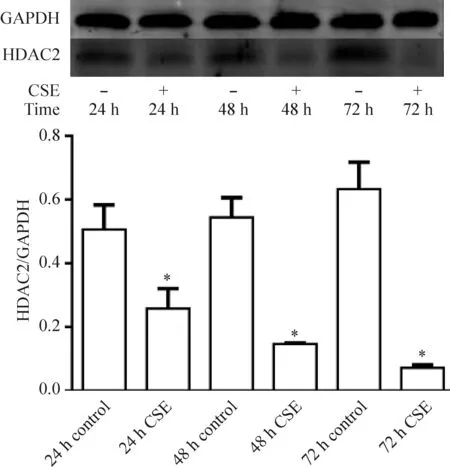
Figure 4.The protein expression of HDAC2 in the C2C12 myoblasts treated with CSE over time. Mean±SD.n=3.*P<0.05vscontrol group at the same time point.
图4 CSE干预作用下小鼠C2C12成肌细胞HDAC2蛋白表达随时间的变化
4 CSE刺激下成肌细胞HDAC2 mRNA、蛋白的表达与衰老的关系
CSE组HDAC2 mRNA表达较对照组明显降低(P<0.05)。与对照组比较,TBB组HDAC2 mRNA表达增加(P<0.05),丙戊酸(valproic acid)组HDAC2 mRNA表达明显降低(P<0.05)。与CSE组比较, TBB+CSE组HDAC2 mRNA表达明显增加,与TBB组比较,TBB+CSE组HDAC2 mRNA表达降低(P<0.05)。与CSE组比较,丙戊酸+CSE组HDAC2 mRNA表达明显降低(P<0.05)。与丙戊酸组比较,丙戊酸+CSE组HDAC2 mRNA表达降低更明显(P<0.05),见图5。
与对照组比较,CSE组干预后 HDAC2 的蛋白表达明显降低(P<0.05),TBB组的HDAC2 蛋白表达明显增加,丙戊酸组的HDAC2 蛋白表达明显减少。与CSE组比较,加入TBB联合干预组的HDAC2 蛋白表达均明显增加,但与TBB组比较,CSE+TBB组的HDAC2蛋白表达降低(P<0.05)。与CSE组比较,加入丙戊酸联合干预组的HDAC2 蛋白表达明显降低(P<0.05),见图6。

Figure 5.The mRNA expression of HDAC2 in the C2C12 myoblasts treated with CSE plus the agonist or antagonist of HDAC2. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group;△P<0.05vsTBB group;&P<0.05vsvalproic acid group.
图5 CSE对小鼠C2C12成肌细胞HDAC2的 mRNA表达的影响
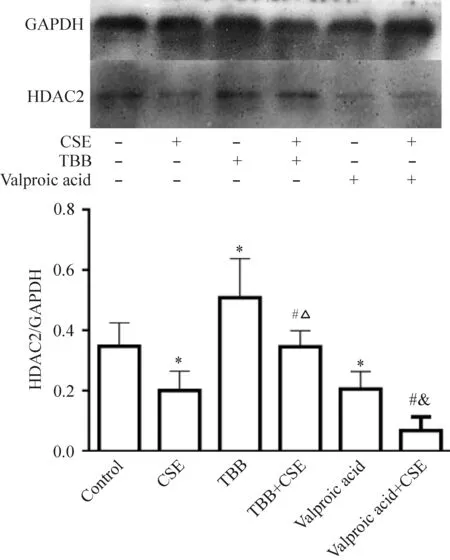
Figure 6.The protein expression of HDAC2 in the C2C12 myoblasts treated with CSE plus the agonist or antagonist of HDAC2. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group;△P<0.05vsTBB group;&P<0.05vsvalproic acid group.
图6 CSE对小鼠C2C12成肌细胞HDAC2蛋白表达的影响
与对照组比较,CSE组的β-半乳糖苷酶染色阳性细胞数较对照组增加(P<0.05),TBB组没有出现β-半乳糖苷酶染色阳性细胞,丙戊酸组的β-半乳糖苷酶染色阳性细胞数明显增加。与CSE组比较,CSE+TBB组的β-半乳糖苷酶染色阳性细胞数明显减少;与TBB组比较,CSE+TBB组的β-半乳糖苷酶染色阳性细胞数增多;与CSE组比较,CSE+丙戊酸组的β-半乳糖苷酶染色阳性细胞数明显增加;与丙戊酸组比较,CSE+丙戊酸组的β-半乳糖苷酶染色阳性细胞数增多更明显(P<0.05),见图7。
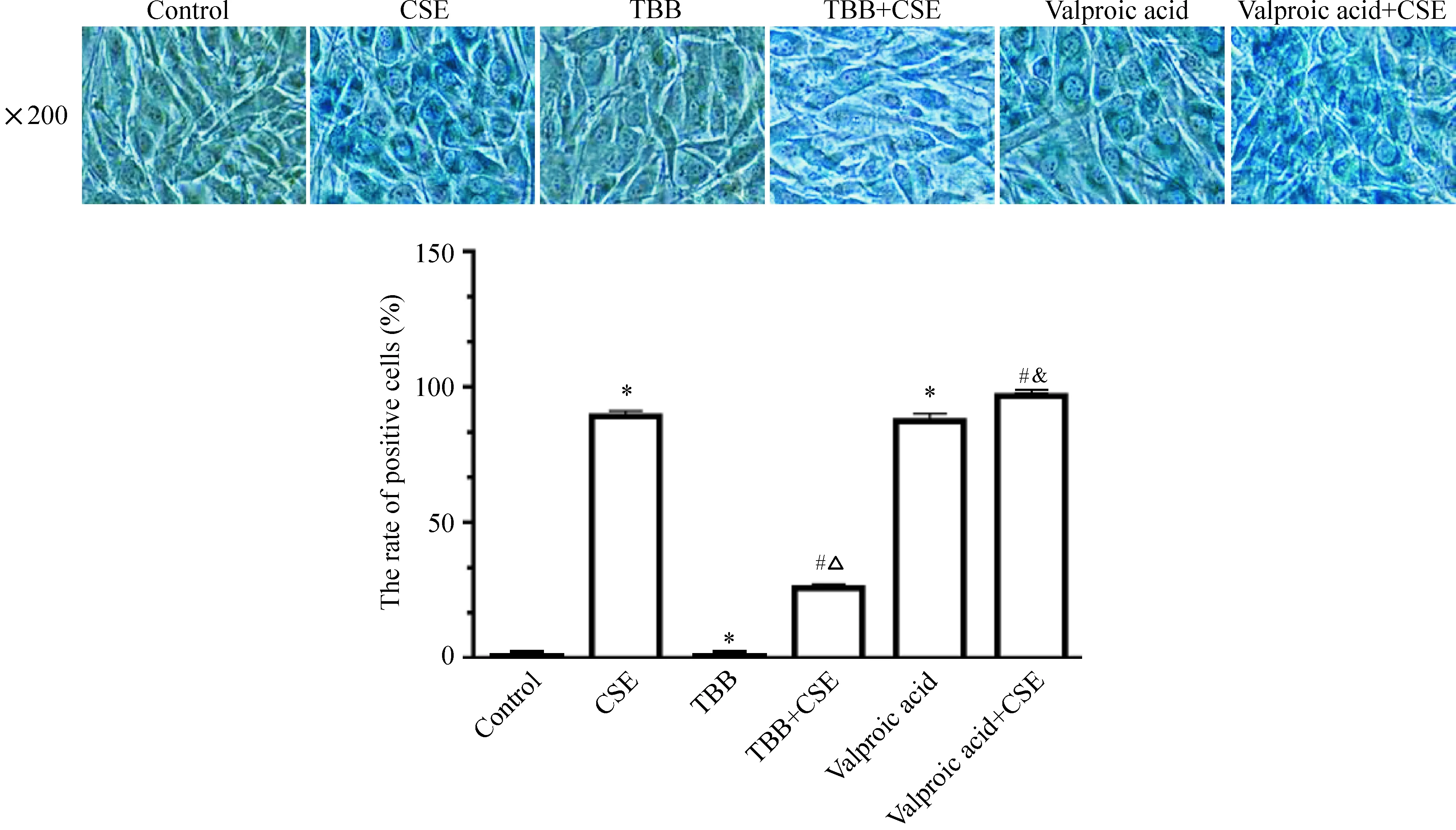
Figure 7.The positive cell rate of β-galactosidase staining in the C2C12 myoblasts treated with CSE plus the agonist or antagonist of HDAC2. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsCSE group;△P<0.05vsTBB group;&P<0.05vsvalproic acid group.
图7 各组细胞β-半乳糖苷酶染色阳性细胞率
讨 论
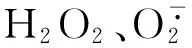
为了进一步研究吸烟能否诱导HDAC2下降促进成肌细胞衰老,我们将浓度小于60 mL/L的 CSE与成肌细胞共同培养,发现在12 h、24 h对细胞生长并无明显抑制作用。当浓度大于80 mL/L时CSE对细胞生长有明显抑制作用。故本实验将CSE干预的终浓度和时间分别设定为60 mL/L和24 h。β-半乳糖苷酶染色是特异性检测衰老的指标。我们观察到,CSE干预可诱导成肌细胞衰老,当CSE浓度≤60 mL/L时,随着CSE浓度的增加,成肌细胞衰老细胞百分率增加。同时我们观察到,60 mL/L CSE在促进成肌细胞衰老的同时伴有HDAC2蛋白表达的下降,而且HDAC2蛋白表达的下降随着CSE作用时间的延长而进一步减少。为了进一步研究HDAC2与衰老的相关性,我们以四溴苯三唑激活HDAC2[15]、HDAC2 特异性阻滞剂丙戊酸抑制HDAC2[16],发现与CSE组比较,当TBB促进HDAC2对 mRNA和蛋白表达的同时,CSE+TBB组成肌细胞衰老细胞数量减少,TBB可抑制CSE诱导的细胞衰老,丙戊酸抑制HDAC2 的mRNA和蛋白的表达,CSE+丙戊酸组成肌细胞衰老细胞数量增加,丙戊酸可加重CSE诱导的细胞衰老,提示干预HDAC2的 mRNA和蛋白表达可以影响C2C12成肌细胞的衰老,吸烟通过抑制HDAC2的表达促进成肌细胞的衰老。
对骨骼肌细胞衰老分子学机制的研究可以使我们更深入了解COPD全身反应的机制,并将进一步有助于拓宽COPD 药物治疗的新靶点。目前关于COPD骨骼肌细胞老化的研究尚少,其具体途径和机制有待于进一步研究。
[1] Gosker HR, Wouters EF, van der Vusse GJ, et al.Skeletal muscle dysfunction in chronic obstructive pulmonary disease and chronic heart failure: underlying mechanisms and therapy perspectives[J]. Am J Clin Nutrition, 2000,71(5): 1033-1047.
[2] Zainuldin R, Mackey MG, Alison JA. Optimal intensity and type of leg exercise training for people with chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev, 2011, 11:CD008008.
[3] Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev, 2012, 12:CD000998.
[4] Ito K, Barnes PJ. COPD as a disease of accelerated lung aging[J]. Chest J, 2009, 135(1):173-180.
[5] MacNee W. Accelerated lung aging: a novel pathogenic mechanism of chronic obstructive pulmonary disease (COPD) [J]. Biochem Soc Transactions, 2009, 37(Pt 4):819-823.
[6] Rahman I, Kinnula VL, Gorbunova V, et al. SIRT1 as a therapeutic target in inflammaging of the pulmonary disease[J]. Prev Med, 2012, 54 Suppl:S20-S28.
[7] Jové M, Planavila A, Sánchez RM, et al. Palmitate induces tumor necrosis factor-α expression in C2C12 skeletal muscle cells by a mechanism involving protein kinase C and nuclear factor-κB activation[J]. Endocrinol, 2006, 147(1):552-561.
[8] 何志义,梁 毅,梁秋丽,等. 香烟对小鼠C2C12成肌细胞分化的影响[J]. 中国病理生理杂志, 2010,26(5):881-884.
[9] Adenuga D, Yao H, March TH, et al. Histone deacetylase 2 is phosphorylated, ubiquitinated, and degraded by cigarette smoke[J]. Am J Respir Cell Mol Biol, 2009, 40 (4):464-473.
[10]Hongwei Y, Irfan R. Role of histone deacetylase 2 in epigenetics and cellular senescence: implications in lung inflammaging and COPD[J]. Am J Physiol: Lung Cell Mol Physiol, 2012, 303(7):L557-L566.
[11]Tsuji T, Aoshiba K, Nagai A. Alveolar cell senescence in patients with pulmonary emphysema[J]. Am J Respir Crit Care Med, 2006, 174(8):886-893.
[12]Morlá M, Busquets X, Pons J, et al. Telomere shortening in smokers with and without COPD[J]. Eur Respir J, 2006, 27(3):525-528.
[13]Müller KC, Welker L, Paasch K, et al. Lung fibroblasts from patients with emphysema show markers of senescenceinvitro[J]. Respir Res, 2006, 7:32.
[14]闫海龙,龚勇珍.氧化应激及p16和p53/p21与细胞衰老关系的研究进展[J]. 医学综述, 2011, 17(5):682-685.
[15]Adenuga D, Yao H, March TH, et al. Histone deacetylase 2 is phosphorylated, ubiquitinated, and degraded by cigarette smoke[J]. Am J Respir Cell Mol Biol, 2009, 40(4):464-473.
[16]Krämer OH, Zhu P, Ostendorff HP, et al. The histone deacetylase inhibitor valproic acid selectively induces proteasomal degradation of HDAC2[J]. EMBO J, 2003, 22(13):3411-3420.
Cigarette smoke extract promotes senescence by reducing expression of HDAC2 in C2C12 myoblasts
SU Wen-yan, LIU Wen-ting, YANG Xia, BAI Jing, HE Zhi-yi
(DepartmentofRespiratoryMedicine,FirstAffiliatedHospital,GuangxiMedicalUniversity,Nanning530021,China.E-mail:bj1312002@aliyun.com)
AIM: To investigate whether the cigarette smoke extract (CSE) causes senescence of C2C12 myoblasts and the relationship between senescence and histone deacetylase 2(HDAC2). METHODS: Murine C2C12 cells were induced to differentiate into myoblasts. The HDAC2 activator and inhibitor were used to investigate the effects of CSE in the myoblasts on cell senescence and the expression of HDAC2. The expression of HDAC2 at mRNA and protein levels was determined by real-time PCR and Western blot, respectively, and the positive cell rate of β-galactosidase staining for cell senescence was also detected. RESULTS: The optimal concentration of CSE was 60 mL/L and the intervention time was 24 h. After the intervention of CSE, the positive cell rate of β-galactosidase staining was increased, accompanied with the reduction of HDAC2 expression at mRNA and protein levels. The expression of HDAC2 at mRNA and protein levels was increased by 4, 5, 6, 7-tetrabromobenzotriazole (TBB), accompanied with the reduction of positive cell rate of β-galactosidase staining. Furthermore, when HDAC2 expression at mRNA and protein levels was reduced by HDAC2 inhibitor valproic acid, the positive cell rate of β-galactosidase staining was increased.CONCLUSION: CSE promotes the senescence by reducing the expression of HDAC2 in C2C12 myoblasts.
Cigarette smoke extract; C2C12 myoblasts; Senescence; Histone deacetylase 2
1000- 4718(2015)04- 0738- 06
2014- 11- 24
2015- 02- 04
国家自然科学基金资助项目(No. 81260011)
R363; R563
A
10.3969/j.issn.1000- 4718.2015.04.029
△通讯作者 Tel: 0771-5356702; E-mail: bj1312002@aliyun.com

