鼻息肉患者外周血Th17细胞的表达及意义
王 悦,马永明,濮晓萍
(江苏大学附属人民医院耳鼻咽喉科,江苏 镇江 212002)
鼻息肉患者外周血Th17细胞的表达及意义
王 悦,马永明,濮晓萍
(江苏大学附属人民医院耳鼻咽喉科,江苏 镇江 212002)
目的 检测鼻息肉患者外周血中Th17细胞的表达水平,初步探讨其与鼻息肉形成的关系。方法收集46例慢性鼻窦炎伴鼻息肉患者的外周血作为鼻息肉组,另收22例单纯鼻出血或者鼻中隔偏曲患者外周血作为对照组。采用流式细胞术检测两组患者的外周血中的Th17细胞的表达水平。结果鼻息肉组外周血中Th17细胞的表达水平为(4.03±0.69)%,明显高于对照组的(1.35±0.26)%,差异有显著统计学意义(P<0.05)。结论鼻息肉的发生发展可能与高水平表达Th17细胞存在一定关系,具体发病机制有待进一步研究。
鼻息肉;Th17细胞;发病机制
鼻息肉(Nasal polyps,NP)是一种各种原因导致的鼻腔和鼻窦黏膜慢性炎症性疾病,成人发病率达1%~4.5%[1]。临床以持续性鼻塞伴头痛为主要就诊原因,目前治疗以类固醇激素喷鼻及鼻内镜手术为主,该病术后复发率较高,发病机制不明确,近年来,各类炎性细胞及其释放的炎症介质与细胞因子成为很多疾病研究的热点。本实验小组此前应用免疫组织化学方法对鼻息肉局部组织中IL-17进行了检测[2],发现局部鼻息肉组织中IL-17高水平浸润,推测到鼻息肉患者外周血中以分泌IL-17为主的Th17细胞可能高水平表达。
本研究采用流式细胞术检测鼻息肉患者外周血中Th17细胞的表达情况,进一步探讨它对鼻息肉发生发展的影响。
1 资料与方法
1.1 一般资料 所有组织标本来自2013年10月至2014年5月在本科住院患者。选取慢性鼻窦炎伴鼻息肉患者46例(鼻息肉组),其中男性28例,女性18例;以单纯鼻出血或鼻中隔偏曲患者22例作为对照组,其中男性14例,女性8例。所有患者取外周静脉血2 ml,收于乙二胺四乙酸二钾真空采血管,随后3 h内提取单个核细胞。所有患者术前1个月内未使用皮质类固醇激素(包括全身和局部)、非类固醇抗炎药物、组胺药物或者大环内酯类抗生素治疗。患者均无全身疾病、变应性鼻炎、支气管哮喘或者阿司匹林过敏史。鼻息肉组患者术后病理回报均为鼻息肉;对照组患者均排除鼻-鼻窦炎病史,鼻窦CT检查无鼻窦病变。本研究经过医院伦理委员会审查通过,所有患者均签署知情同意书。
1.2 仪器和试剂 人淋巴细胞分离液(FICOLL)选自天津TBD生物技术发展中心。单抗隆抗体(包括PE-抗人IL-17A,PE-Cyanine5-抗人CD3,FITC-抗人CD8)及相应同型抗体、Th17细胞破膜液及洗涤液均购于美国eBioscience公司。刺激霉素PMA,离子霉素(Ionomycin),莫能霉素(Monensin)购自Enzo公司。标准胎牛血清和RPMI-1640液选自维森特生物技术有限公司。0.01 mol/L无菌磷酸盐缓冲液(PBS,PH7.2)自配后高压处理。流式细胞仪FACS Canto及FACS Diva软件为美国BD公司。
1.3 方法 第一步:提取单个核细胞:将外周血2 000 r/min,4℃,离心5 min,去上层血清。用等体积无菌PBS稀释剩余血细胞,将稀释的血细胞缓缓加到等体积的ficoll液面之上,2 000 r/min,24℃,离心15 min。取中间白膜层(单个核细胞层),用1 ml无菌PBS洗涤2遍,500 g/min,4℃,离心5 min,去上清。用1 ml 10%胎牛血清1640稀释单个核细胞。取其中10 μl,用PBS再稀释5倍,显微镜下鲍氏计数板细胞计数。第二步:流式细胞术:24孔平底细胞培养板每孔约2×106个单个核细胞,,每孔分别加入5 μl PMA(10 ng/μl),1 μl离子霉素(1 μg/μl),4 μl莫能霉素(0.5 μg/μl),加10%胎牛血清1640使总体积为1 ml,置于37℃,5%CO2孵箱刺激5 h。然后收集细胞于无菌1.5 ml EP管,1 ml PBS洗两遍,500 g/min,4℃,离心5 min。留100 μl PBS重悬,加PE-Cyanine5-抗人CD32 μl,FITC-抗人CD84 μl,置混匀器,4℃冰箱,避光孵育30 min。后离心去上清,1 ml PBS洗涤两遍,500 g/min,4℃,离心5 min。每管加500 μl破膜液破膜,置混匀器上,4℃冰箱,避光30 min。离心去上清,1 ml洗涤液(原液用双蒸水按1:9比例稀释)洗两遍,500 g/min,4℃,离心5 min。留40 μl洗涤液,加PE-抗人IL-17A 2 μl,置混匀器,4℃冰箱,避光孵育1 h。1 ml洗涤液洗两遍,500 g/min,4℃,离心5 min,去上清。250 μl PBS重悬,50 μl多聚甲醛固定。所有标本均做同型对照。用FACS Canto检测Th17细胞的表达水平,并用FACS Diva软件分析数据。由于既往研究证实PMA刺激会使T细胞胞膜CD4分子表达下降而影响检测[3],因此本实验以 CD3+CD8-IL-17A+代表CD3+CD4+IL-17A+,统计其在CD3+CD8-T细胞中的比率。
1.4 统计学方法 采用SPSS16.0统计分析软件对检测结果进行处理,计量资料以均数±标准差(±s)表示,两独立样本之间比较应用t检验,以P<0.05表示差异有统计学意义。
2 结果
鼻息肉组与对照组患者外周血中Th17细胞表达水平见图1。对两组数据进行t检验发现,鼻息肉组患者外周血中Th17细胞的比率较高,达4.73%,见图1a,而对照组患者外周血中Th17细胞的比率较低,仅1.17%,见图1b。鼻息肉组患者外周血Th17细胞的比率达(4.03±0.69)%,明显高于对照组的(1.35±0.26)%,见图1c。且两组间差异有统计学意义(t=6.25,P<0.05)。
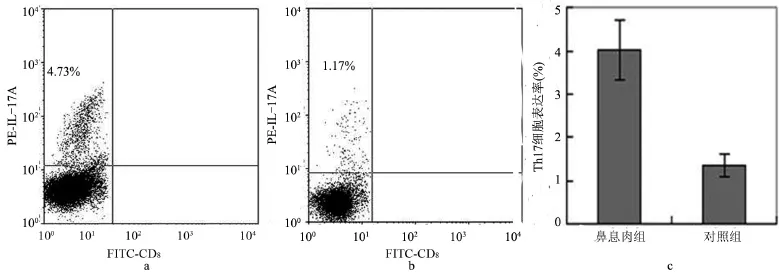
图1 外周血中Th17细胞表达水平
3 讨论
本研究通过对鼻息肉患者外周血中Th17细胞的检测发现,Th17细胞在鼻息肉患者外周血中表达较对照组患者显著增高,且差异有统计学意义(P<0.05),据此推断Th17细胞可能在鼻息肉的发病过程中起着重要作用,鼻息肉形成的具体过程自然与Th17细胞的功能密切相关。
Th17细胞是一种不同于Th1、Th2、Treg细胞的新型CD4+T淋巴细胞亚群,是固有T淋巴细胞在细胞因子TGF-β、IL-6、IL-1β和IL-23刺激下分化而来,其主要的效应分子为IL-17,IL-17家族有A~F六个成员[4],其中IL-17(即IL-17A)与IL-17F生物学功能相似,二者通过与各种细胞表面的IL-17RA和IL-17RC结合,启动相应靶基因转录,促使各种炎性因子的分泌,从而使局部炎性组织中性粒细胞、T细胞、DC等聚集,产生抗病原微生物作用,促进组织恢复正常[5]。在气道炎症性疾病中,IL-17能够诱导气道上皮细胞、内皮细胞及成纤维细胞分泌IL-1β、IL-6及GM-CSF,从而使中性粒细胞浸润于病变部位,促使局部炎症的持续[6]。
近年来,大量研究关注于Th17细胞或其分泌的主要效应分子IL-17与各种疾病发病机制之间的关联性,认为Th17细胞在各种炎症性疾病和自身免疫性疾病中都有较高水平表达,它的促炎作用是这些疾病发生的关键。在类风湿关节炎的发病过程中,Th17细胞正是通过诱导产生的多种细胞因子,使中性粒细胞,巨噬细胞及淋巴细胞聚集于滑膜,增强了局部炎症反应,使关节破坏加重[7-8]。在系统性红斑狼疮(SLE)患者血清中IL-17显著增高,并且在狼疮性肾炎患者肾脏中检测到高水平IL-17和IL-23,IL-17能够促进B细胞的生存,并协同B细胞激活因子避免B细胞的凋亡,从而增加产生自身抗体的细胞的数目,这可能在SLE发病中占有重要作用[9-10]。据目前的研究发现Th17细胞在炎症性肠病[11],克罗恩病[12],多发性硬化[13]的发病中也都发挥着一定的作用。这使耳鼻咽喉科的研究者们也致力于探测Th17细胞的特异性细胞因子IL-17A在本学科疾病中的作用,试图通过影响Th17细胞的分化增殖去促使一些疾病的好转或减少疾病的复发。在2004及2005连续两年的研究中,王鑫等[14-15]发现在鼻息肉组织中IL-17及其受体表达增多,认为IL-17是导致鼻息肉发生的重要细胞因子。这为我们研究Th17细胞与鼻息肉提供了一定的基础,由于Th17细胞分泌的炎性因子较多,我们实验组通过流式细胞术直接对这种炎性细胞进行检测,结果表明慢性鼻窦炎伴鼻息肉患者外周血中Th17细胞较对照组有明显增高,差异有统计学意义,认为Th17细胞分泌的促炎细胞因子通过外周循环到达鼻腔黏膜,与相应受体结合,诱发中性粒细胞和单个核细胞聚集,长期炎症刺激导致鼻黏膜破坏、重塑,最终形成严重的息肉病变。
本研究仅简单地对鼻息肉患者外周血中Th17细胞表达率进行了检测,而关于其在鼻息肉形成过程中的具体作用环节还尚未明确,对此进一步的研究将为我们治疗鼻息肉及防止其复发具有重要的临床意义。
[1]Rajguru R.Nasal polyposis:current trends[J].Indian J Otolaryngol Head Neck Surg,2014,66(Suppl 1):16-21.
[2]濮小萍,马永明,朱 伟,等.鼻息肉组织中IL-9和IL-17及Foxp3的表达及意义[J].临床耳鼻咽喉头颈外科杂志,2014,28(8): 513-515.
[3]毛建华,陈志敏,汤永民,等.佛波酯对人外周血淋巴细胞CD3和CD4及CD8分子表达的作用[J].浙江大学学报(医学版),2003,32 (6):155-159.
[4]Chen Z,O'Shea JJ.Th17 cells:a new fate for differentiating helper T cells[J].Immunol Res,2008,41(2):87-102.
[5]Fouser LA,Wright JF,Dunussi-Joannopoules K,et al.Thl7 cytokines and their emerging roles in inflammation and autoimmunity [J].1mmunoI Bey,2008,226:87-102.
[6]Alcorn JF,Crowe CR,Kolls JK.Th17 cells in asthma and COPD [J].Annu Rev Physiol,2010,72:495-516.
[7]Azizi G,Jadidi-Niaragh F,Mirshafiey A.Th17 Cells in immumnopathogenesis and treatment of rheumatoid arthritis[J].Int J Rheum Dis,2013,16(3):243-253.
[8]Truchetet ME,Mossalayi MD,Boniface K.IL-17 in the rheumatologist's line of sight[J].Biomed Res Int,2013,2013:295132.
[9]Perry D,Peck AB,Carcamo WC,et al.The current concept of Th17 cells and their expanding role in systemic lupus erythematous[J]. Arthritis,2011,2011:810649.
[10]Zhao L,Jiang Z,Jiang Y,et al.IL-22+CD4+T-cells in patients with active systemic lupus erythematosus[J].Exp Biol Med(Maywood), 2013,238:193-199.
[11]Dige A,Støy S,Rasmussen TK,et al.Increased levels of circulating Th17 cells in quiescent versus active Crohn's disease[J].J Crohns Colitis,2013,7:248-255.
[12]Siakavellas SI,Bamias G.Role of the IL-23/IL-17 axis in Crohn's disease[J].Discov Med,2012,14:253-262.
[13]Zepp J,Wu L,Li X.IL-17 receptor signaling and T helper 17-mediated autoimmune demyelinating disease[J].Trends Immunol,2011, 32:232-239.
[14]王 鑫,董 震.鼻息肉组织免疫相关基因的表达谱[J].中华耳鼻咽喉科杂志,2004,12(39):721-723.
[15]王 鑫,董 震.白细胞介素-17及其受体在鼻息肉组织中的表达及意义[J].中华耳鼻咽喉头颈外科杂志,2005,12(40):899-902.
Expression and significance of Th17 cells in patients with nasal polyps.
WANG Yue,MA Yong-ming,PU Xiao-ping.
Department of Otolaryngology,the Affiliated People's Hospital of Jiangsu University,Zhenjiang 212002, Jiangsu,CHINA
ObjectiveTo detect the expression of Th17 cells in peripheral blood in nasal polyps,and to explore the role of Th17 cells in pathogenesis of nasal polyposis.MethodsThe peripheral blood samples were collected from 46 patients of chronic sinusitis with nasal polyp(CRSwNP,the study group)and 22 patients with simple nasal bleeding or nasal septum deviation(the control group).Flow cytometry was used to detect the expression levels of Th17 cells in peripheral blood in the two groups.ResultsThe levels of Th17 cells in the study group was(4.03%±0.69%),significantly higher than(1.35%±0.26%)in the control group(P<0.05).ConclusionThe pathogenesis of CRSwNP may be involved in the increased expression of Th17 cells,and the detailed mechanisms should be further studied.
Nasal polyps;Th17 cells;Pathogenesis
R765.25
A
1003—6350(2015)15—2231—03
10.3969/j.issn.1003-6350.2015.15.0805
2014-12-23)
镇江市社会发展项目资助(编号:SH2013053)
马永明。E-mail:maym121@163.com

