长白山复序橐吾多糖的提取及其免疫活性研究
朱 梅,任桂红,赵桂云,孙海明,董 然,刘洪章
(1.北华大学化学与生物学院,吉林省吉林市 132013;2.吉林农业大学生命科学学院,吉林长春 130118)
长白山复序橐吾多糖的提取及其免疫活性研究
朱 梅1,任桂红1,赵桂云1,孙海明1,董 然2,刘洪章2
(1.北华大学化学与生物学院,吉林省吉林市 132013;2.吉林农业大学生命科学学院,吉林长春 130118)
经90%乙醇浸泡处理的复序橐吾叶,热水煮提,乙醇沉淀,常规干燥,得粗多糖,由理化性质分析表明,粗多糖为不含淀粉的酸性杂多糖;粗多糖经冻融法和酶-Sevag法联合脱蛋白及透析处理后,通过DEAE-纤维素离子交换层析、SepharoseCL-6B凝胶柱层析分级纯化,得到6个多糖级分;采用高效液相色谱法测定各级分的单糖,组成为甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、木糖、岩藻糖;进一步利用高效凝胶渗透色谱法对各多糖级分的分子量分布进行了分析;应用MTT法对复序橐吾多糖免疫活性进行测定,结果表明其对小鼠脾脏T淋巴细胞的体外增殖有一定的促进作用。
复序橐吾;多糖;分离提取;理化性质;免疫活性
复序橐吾(Ligularia jaluensis Kom.)系菊科橐吾属植物,为多年生草本,生于海拔450~1 000m的草甸子及林缘湿地,为长白山特有种[1-2]。复序橐吾根及根茎做“紫菀”入药,称“山紫菀”,有润肺、下气、祛痰,止咳之功效[3-4],其嫩叶是长白山区朝鲜族群众比较喜食的山野菜种类,具有特殊的风味。
对橐吾属植物多糖的研究,目前报道的有刘春兰[5-6]等对大黄橐、鹿蹄橐吾水溶性多糖分离提取及其抗氧化作用的探讨,其它研究还未见报道。笔者野外调查发现,长白山区野生复序橐吾蕴藏量大,是值得开发利用的植物资源。本文对复序橐吾多糖进行提取分离,对其理化性质、单糖组成及分子量分布进行分析,并探讨其对T淋巴细胞体外增殖的影响,为开发利用复序橐吾资源提供参考依据。
1 材料与方法
1.1 供试材料
(1)复序橐吾, 采自吉林省敦化市青沟子林场,海拔约416m的林缘沼泽湿草地,经吉林农业大学园艺学院董然教授鉴定为复序橐吾(Ligularia jaluensis Kom.)。
(2)ICR小鼠,吉林大学基础医学院实验动物中心提供。
1.2 试剂与仪器
1.2.1 试剂
牛血清白蛋白(中国生物制品检定所),D-半乳糖醛酸(Sigma公司进口分装) ,考马斯亮蓝G-250 (北京鼎国生物技术发展中心),DEAE-纤维素(Waterman公司),SepharoseCL-6B凝胶(Pharmcia公司),噻唑蓝(MTT)、RPMI-1640培养基(Sigma公司),二甲基亚砜(DMSO,Amersco),刀豆蛋白(ConA, Gibco),其它试剂均为国产分析纯。
1.2.2 仪器
旋转蒸发仪(Heidolph公司),冷冻干燥机(EYELA公司),TGL-16A高速台式离心机(苏州奇乐电子科技有限公司),TSK-gel-G3000PWXL (TOSOH),LC-10Avp高效液相色谱仪(Shimadzu),3550-UV 酶标仪(Bio-Rad公司),MCO-15ACCO2培养箱(日本三洋), 紫外可见分光光度计(Biochrom公司)。
1.3 试验方法
1.3.1 复序橐吾粗多糖的提取
称取干燥的经90%乙醇浸泡处理的复序橐吾叶250g,加入蒸馏水2.5L浸泡过夜,在保持90~100℃的条件下,热水煮提,间隙搅拌,每次30min,120目尼龙布过滤,残渣重复上述方法继续提取2次,合并3次滤液,滤液减压浓缩至一定体积,经80℃水浴浓缩至终体积为400mL,离心(4000rpm,10min),弃沉淀,上清液用无水乙醇按1∶4比例醇沉,置4℃冰箱中24h,离心,取沉淀,沉淀依次用无水乙醇、乙醚洗涤3次, 置于真空干燥箱中干燥,得复序橐吾粗多糖(CLJP)。
1.3.2 脱蛋白与透析
利用反复冻融、酶法和Sevag法联合除蛋白[7],将脱蛋白后的粗多糖溶液,置入截留分子量为1000的透析袋内,去离子水透析48h,盐和小分子物质不断扩散透析到袋外,样品液经冷冻后得复序橐吾脱蛋白多糖(LJP)。
1.3.3 复序橐吾多糖的分级纯化
(1)DEAE-纤维素柱层析:采用DEAE-Cellulose52 (OH-)柱层析,湿法装柱(2.6cm×40cm),平衡后上样。取复序橐吾多糖(LJP)40g溶于400mL溶于去离子水中,上样于平衡好的DEAE-52纤维素柱,依次用去离子水和0.5M NaC1溶液进行分级洗脱,流速为5mL·min-1,收集洗脱液(10mL/管),以硫酸-苯酚法在490mm波长下跟踪检测糖含量,分别收集不同的洗脱峰,获得去离子水洗脱级分和NaCl溶液洗脱级分。
(2)SepharoseCL-6B柱层析:将从DEAE-52纤维素柱层析得到的水洗脱级分和0.5 M NaCl溶液洗脱级分,离心(10000rpm,3min),上清液经SepharoseCL-6B(2.6cm×100cm)柱层析制备柱继续分级,上样2.0mL(20 mg·mL-1),用0.15M的NaCl洗脱,洗脱速度为1.0mL·min-1,BS-100A自动部分收集器收集洗脱液(每管20mL),以硫酸-苯酚法检测每管多糖含量,以洗脱管数为横坐标、吸光度(波长490nm处测定)为纵坐标绘制洗脱曲线,合并糖峰洗脱液,减压冻干。
1.3.4 理化性质研究
(1)总糖含量测定:采用苯酚-硫酸法[8],以葡萄糖为标准糖样绘制标准曲线。
(2)淀粉含量测定:采用KI-I2法[9],以可溶性淀粉为标准绘制标准曲线。
(3)糖醛酸含量测定:采用硫酸-咔唑比色法[10-11],以半乳糖醛酸为标准糖醛酸绘制标准曲线。
(4)蛋白质含量测定:采用考马斯亮蓝法[12],以牛血清白蛋白为标准蛋白绘制标准曲线。
(5)单糖组成分析:采用PMP衍生化和高效液相色谱(HPLC)法[13],分析多糖的单糖组成。
(6)多糖分子量分布测定:高效凝胶渗透色谱(HPGPC)法,采用LC-10Avp高效液相色谱仪系统,按色谱条件,测定洗脱体积,按公式(1-1)计算分配系数(Kav),以Kav为纵坐标,用不同分子量的葡聚糖标准品(1.0mg·mL-1),以其分子量的对数lgMw为横坐标绘制标准曲线。
Kav=Ve-Vo/Vt-Vo
(1-1)
其中,Ve为待测样品的糖峰洗脱体积,Vo为凝胶柱的外水体积,Vt为凝胶柱的总体积。
在相同条件下,将LJP用0.2M NaCl配制成2mg·mL-1的溶液,使用0.45μm 的微孔滤膜过滤,上样量20μL,流动相为0.2mol·L-1NaCl溶液,流速0.6mL·min-1,测定洗脱体积。
1.3.5 体外免疫活性测定方法
选择体重18~20g的昆明小鼠,颈椎脱臼处死,75%酒精消毒,无菌取脾,研磨制备脾细胞悬液,用0.01% Tris-NH4Cl溶解红细胞, RPMI-1640冲洗1次,以含10%小牛血清的RPMI-1640培养基配制成1×107mL-1的细胞悬液,加入96孔板中,每孔100μL;实验孔中分别加入不同稀释浓度的多糖样品,使其终浓度分别为200μg·mL-1、20μg·mL-1、2μg·mL-1、0.2μg·mL-1,每一实验组均加入ConA(终浓度2.5μg·mL-1);另设细胞对照组、ConA对照组(终浓度2.5μg·mL-1)、空白对照组,每孔加入液体终体积为200μL,每组设3个复孔。5%CO2培养箱中(37℃)培养44h后,每孔加入20μL MTT(5mg·mL-1),培养4h,离心5min(1000rpm),吸去上清,加入200μL DMSO,充分振荡 1min,酶标仪(λ595)测定吸光度值,计算刺激指数(SI):
SI = 实验组的A595nm- 空白对照的A595nm/ 细胞对照的A595nm- 空白对照的A595nm
采用t检验方法统计分析,检测数据用±SD表示。
2 结果与讨论
2.1 复序橐吾粗多糖的提取及其理化性质
按“1.3.1”的方法,得到棕褐色粉末状复序橐吾粗多糖(CLJP)51.33g,得率为20.53%,CLJP易溶于水,不溶于乙醇、乙醚、丙酮等有机溶剂。经乙醇的处理可除去单脂类、多肽、色素、寡糖、有机酸等小分子物质,提高多糖纯度。CLJP总糖含量为23.24%,蛋白质含量为1.10%,糖醛酸含量为19.20%。可见,CLJP由中性和酸性多糖组成;而采用KI-I2法对淀粉含量测定,结果显示CLJP不含淀粉。
本实验方法与文献[5-6]比较,综合能耗、时间等因素考虑,笔者认为适度的热水煮提,时间短、耗能低,提取率高,适合对橐吾多糖的提取;此外,还可以推测,橐吾属植物多糖是不含淀粉的酸性杂多糖,但种类、地域、来源、植物部位及提取方法不同会导致其蛋白质含量差别较大。
CLJP经冻融法和酶-Sevag法联合脱蛋白及透析处理,冷冻干燥,得脱蛋白多糖(LJP),得率为26.70%;对其总糖含量、糖醛酸含量进行测定,分别为65.25%、37.60%,表明粗多糖经除蛋白和盐分后,总糖含量和糖醛酸含量明显增加。
采用PMP衍生化和HPLC法,测得LJP由Man、Rha、GlcUA、GalUA、Glc、Gal、Ara7种单糖组成(图1),各单糖摩尔比为3.5∶1∶2∶7∶6.6∶9.7∶4.7,其中Gal、GalUA、Glc、Ara含量较高。
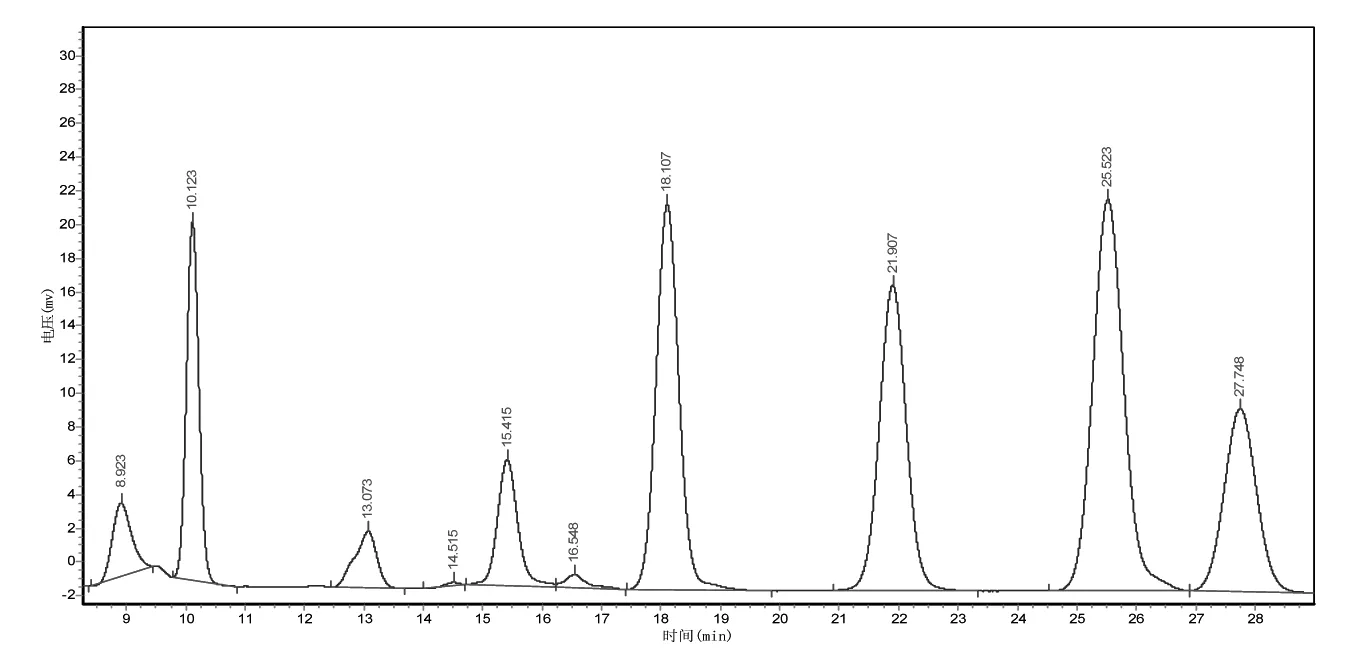
图1 LJP的HPLC色谱图
根据标准葡聚糖的分子量Mw和测得的Ve、Vo和总体积 Vt,按公式(1-1)计算 Kav,以 Kav 为纵坐标,lg Mw为横坐标得到标准曲线及回归方程Kav=-0.188X+1.0341, R2=0.9916。 对LJP进行HPGPC 分析显示(图2),LJP分子量范围在110~470000Da,说明其分子量分布较宽,且中等分子量多糖(1270,2760,110000,470000Da)较多。

图2 LJP HPGPC色谱图
2.2 LJP的分级纯化及各级分单糖组成、分子量分布分析
从DEAE-纤维素离子交换层析得到水和0.5M NaCl溶液洗脱级分两部分,然后分别通过SepharoseCL-6B凝胶层析继续分级得到LJPN1,LJPN2,LJPN3;LJPA1,LJPA2,LJPA3共6个多糖级分(图3)。

图3 Sepharose CL-6B柱层析洗脱曲线
对各多糖级分的单糖组成及按峰面积计算各单糖的百分含量分析显示,6个多糖级分由Man、Rha、GlcUA、GalUA、Glc、Gal、Ara、Fuc、Xyl组成,各多糖级分中含量较高的单糖组分分别是LJPN1:Gal(32.35%),GalA(23.85%),Ara(20.18%);LJPN2:GalA(40.14%),Gal(19.88%),Ara(16.77%);LJPN3:GalA(43.50%),Glc(15.38%);LJPA1:Glc(22.89%),Gal(21.59%),GalA(19.14%),Ara(16.45%);LJPA2:Glc(44.04%),GalA(16.96%);LJPA3:Rha(14.51%),GluA(9.85%)。此外,各级分酸性糖含量较高,原因可能是在正常情况下,中性多糖不被DEAE-纤维素吸附,被水洗脱下来,而酸性多糖则被DEAE-纤维素吸附,在吸附能力许可的范围内,洗脱液中只能检出微量的糖醛酸。但当上样量超量时,超过了DEAE-纤维素的吸附能力,洗脱液中糖醛酸的含量会明显增多,因此造成水洗脱级分的糖醛酸含量也较高。
通过HPGPC分析表明,LJPA3在TSK-gel-G3000PWXL凝胶层析上呈现单一对称峰,分子量为5 159Da,分子量相对均一;其它多糖级分呈现出2~3个峰,分子量在416~473 168Da之间,由2~3个不同分子量级分组成(图4)。
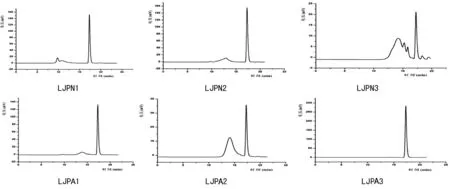
图4 LJPN1-3和LJPA1-3的HPGPC图谱
多糖的性质往往和它的分子量大小有关,且对多糖的生物活性也有影响,因此,多糖分子量测定是多糖研究的一项重要内容。通过对6个级分的分子量分布进行比较可见,本实验得到的各多糖级分基本为单一组分多糖或较窄分子量范围的多糖。
2.3 复序橐吾多糖对小鼠T淋巴细胞体外增殖的影响
实验结果表明,CLJP、LJPA3、LJPN1对ConA诱导的小鼠脾脏T淋巴细胞的体外增殖具有协同促进效应,且呈剂量依赖性(图5)。200μg·mL-1的CLJP、LJPA3、LJPN1均可显著增加ConA诱导的小鼠T淋巴细胞的增殖,与细胞对照组相比,各组P<0.05;20μg·mL-1的LJPA3、2μg·mL-1的LJPN1也可促进ConA诱导的小鼠T淋巴细胞增殖,但P>0.05。
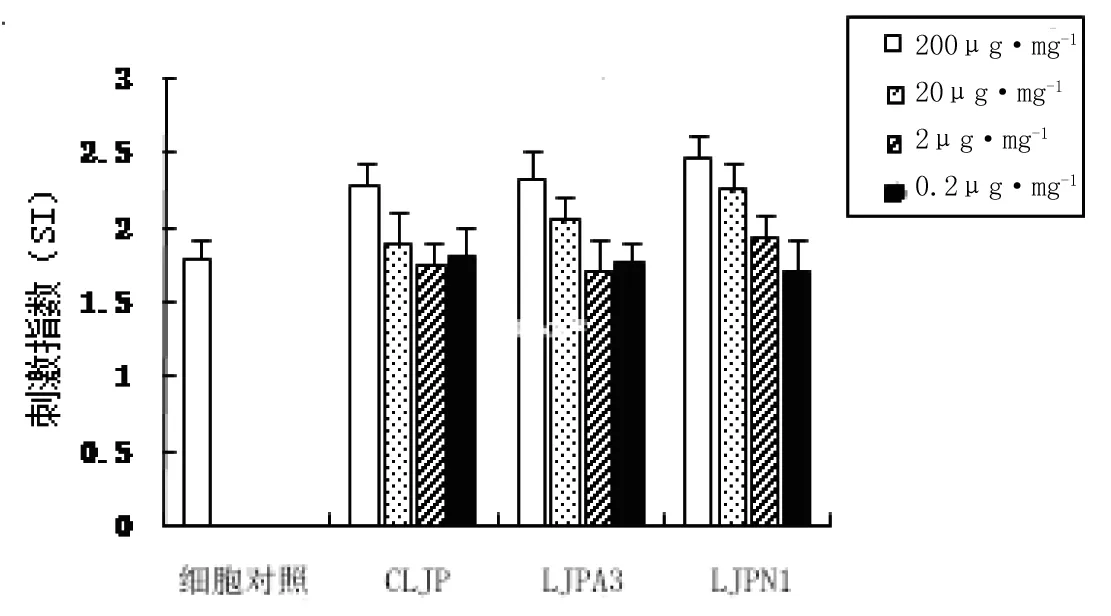
图5 CLJP、LJPA3、LJPN1对小鼠T淋巴细胞增殖的影响
研究表明,植物多糖可以通过激活T、B淋巴细胞、网状内皮细胞、巨噬细胞和NK 细胞等免疫细胞,对免疫系统发挥调节作用[15],所以植物多糖作为生物免疫调节剂已越来越被人们所重视。因此,在本实验的基础上,可以继续进行体内试验,为复序橐吾多糖在免疫调节方面的应用提供实验依据。
[1]江苏新医学院,中药大词典(上、下册)[M].北京:人民卫生出版社,1977:154,1152,2349.
[2]中国科学院北京植物研究所,中国高等植物图鉴:第四册[M].北京:科学出版社,1975:576-589.
[3]张达治,余国奠,张勉,等.橐吾属植物药用研究概况[J].中国野生植物资源,2003,22(2):4-7.
[4]刘尚武.中国植物志(第77卷第2分册)[M].北京:科学出版社,1989:55-103.
[5]刘春兰,周博,杜宁,等.大黄橐吾水溶性多糖的初步纯化及清除自由基活性研究[J],中央民族大学学报:自然科学版, 2007,16(4):341-345.
[6]刘春兰,杜宁,徐桂云,等.鹿蹄橐吾多糖LW21 的分离纯化及其结构分析[J].食品科学,2012,33(11):57-61.
[7]李永裕.余甘多糖分离纯化、结构及抗氧化活性研究[D].福州:福建农林大学,2010.23-24.
[8]Michel dubois,k.a.gilles,j.k.hamilton,p.a.rebers,and fred smith,colorimetric method for determinea tion of sugars and related substances,analytical chemistry,1956,28(3):350-356.
[9]徐昌杰,陈文峻,陈昆松,等.淀粉含量测定的一种简便方法-碘显色法[J].生物技术,1998,8(2):41-43.
[10]王文平,郭杞远,李琳,等.野木瓜多糖中糖醛酸含量测定[J].,食品科技,2007,32(10):84-86.
[11]夏永刚,梁军,杨炳友,等.麻黄多糖中糖醛酸含量的测定[J].中医药学报,2011,39(1):71-73.
[12]Bradford MM,Arapid and sensitive method for the quantitation of microgram quantities utilizing the principle of protein dye binding[J].Anal Biochem,1976(72):248-254.
[13]Strydom D J.Chromatographic separation of 1-phenyl-3-methyl·Spyrazolone—derivatized neural, acidicand basic aldoses[J].Journal ofChromatography A,1994(678):17-23.
[14]金春雁,张卫明,顾龚平,等.药用植物多糖的结构与生物活性[J].中国野生植物资源,2005,24(1):15-18.
Study on the Extraction and Immunological Activity of Polysaccharides from Ligularia jaluensis in Changbai Mountains
ZHU Mei1,REN Gui-hong1,ZHAO Gui-yun1,SUN Hai-ming1,DONG Ran2,LIU Hong-zhang2
(1. School of Chemistry and Biology,Beihua University, Jilin Jilin 132013, China;2.School of Life Sciences, Jilin Agricultural University, Changchun Jilin 130118, China)
Ligularia jaluensis leaves were soaking treated by 90% ethanol, then Crude polysaccharide were obtained by hot aqueous extraction, ethanol precipitation and conventional desiccation. Phisicochemical property analysis indicated that Ligularia jaluensis crude polysaccharide was acidic heteropolysaccharide without starch. 6 polysaccharide fractions were obtained via fractionation purification of deae-cellulose and SepharoseCL-6B Gel chromatography after deproteinzation through combination of freeze-thaw method and enzyme-Sevag method and dialysis. Monosaccharide composition of each polysaccharide fraction was determined by HPLC to consist of mannose, rhamnose, glucuronic acid, galacturonic acid, glucose, galactose, arabinose, xylose and fucose. MWD of each polysaccharide fraction were analysed further by HPGPC. The result of determination of immunological competence manifested that Ligularia jaluensis polysaccharide showed some auxo-action to mice T-cell proliferation in vitro.
Ligularia jaluensis;polysaccharides;separation and extraction; physicochemical property; immunological activity
2015-05-16
吉林省科技发展计划项目(20100254);吉林省教育厅科学技术研究项目(2012138)。
朱 梅(1963- ),女,吉林桦甸人,北华大学化学与生物学院副教授,博士,从事药用植物资源学研究。
刘洪章(1958- ),男,吉林长春人,教授,博士生导师,从事长白山野生经济植物种质资源研究。
Q539
A
2095-7602(2015)10-0066-05

