具鞘微鞘藻胞外多糖抗紫外辐射活性研究*
唐 倩 周 楠 唐东山,2 曾铁兵 朱 洪 张晓文,2
(1.南华大学环境保护与安全工程学院,湖南 衡阳 421001;2.南华大学放射性三废处理与处置重点实验室,湖南 衡阳 421001;3.南华大学医学院,湖南 衡阳 421001)
0 引言
多糖(polysaccharides)是除蛋白、核酸外的第三类大分子,是一类生物活性广泛的极性大分子聚合物,广泛分布于自然界各类生物体中[1]。胞外多糖(extracellular polysaccharides,EPSs)是指广义的细菌胞外多糖,即细胞外含多糖的结构。因细菌和真菌的胞外多糖具有易于分离纯化而且产量高等优点,人们对来源于微生物的多糖越来越重视,它们在工业生产中也颇受青睐。蓝藻(蓝细菌)是地球上最古老的光合放氧原核生物,一直是生物圈的优势生物类群[2],而荒漠蓝藻是荒漠土壤结皮和荒漠生态系统中非常重要的优势物种,目前对荒漠藻多糖的研究主要集中在其室内培养条件优化[3]和抗干旱、抗盐碱、抗捕食[4-6]及其在沙漠土壤成土中的作用等方面[7],对荒漠蓝藻胞外多糖抗紫外辐射活性的研究还较少。
具鞘微鞘藻(Microcoleus vaginatus Gom.)属于颤藻科,微鞘藻属的一种丝状蓝藻,作为荒漠生境中的优势藻种,在长期进化过程中获得了较强的抗紫外辐射能力,这种能力与其胞外多糖密切相关。许多研究表明:多糖能够使辐射所引起的迟发型超敏感性反应低下和SOD活性下降明显恢复,促进自由基清除,抑制或阻断自由基引起的脂质过氧化反应[8-9],因此研究具鞘微鞘藻的胞外多糖抗紫外辐射活性对于进一步了解荒漠藻多糖的生物活性、揭示荒漠藻适应环境胁迫的机理,进而对于加强荒漠化治理和促进生态安全具有一定的理论意义和应用价值。
1 材料与方法
1.1 主要试剂及仪器
所用试剂纯度均为分析纯。
旋转蒸发仪(R-3,瑞士)、高速台式离心机(TGL-10C,上海)、台式低温恒温振荡摇床(PSET15OA,上海)、电子天平(AL204,上海)、立式压力蒸汽灭菌器(BXM-30R,上海)、双光束紫外可见分光光度计(TU-1901,北京)、水浴恒温振荡箱(SHZ-88,江苏金坛)、隔水式恒温培养箱(GNP-9080,上海)、核酸蛋白仪(DU640,上海)、磁力加热搅拌器(78-1,湖南长沙)、人工气候箱(PYX-250QB,广东韶关)。
1.2 试验用胞外多糖
1.2.1 藻种来源与培养
本实验所用具鞘微鞘藻从中国科学院水生生物研究所藻种库购得。
藻种恢复培养成功后,采用 BG11培养基(121℃高压蒸汽灭菌30 min),通过反复通气培养来扩大藻种量,培养温度为25℃,光暗比12∶12,每天手动摇晃数次。
1.2.2 具鞘微鞘藻粗多糖提取
取培养20 d的微鞘藻,抽滤收集取上清液,抽滤后过0.45μm的微孔滤膜,旋转蒸发仪浓缩(40℃,120 r/min)上清液至原来体积的1/4,加入体积倍数为3倍的95%乙醇,产生白色絮状沉淀,充分搅拌,4℃静止沉降过夜后弃上清液,4 000 r/min离心10 min得沉淀,沉淀用无水乙醇洗涤2~3次。
1.2.3 Sevag 法脱蛋白
将沉淀溶于一定量的水中,加入3倍体积比为3∶1的氯仿和正丁醇混合液,振荡0.5 h,4 000 r/min离心除去沉淀。重复以上步骤至无白色沉淀生成。多糖含量测定采用酚-硫酸法[10-11]。
1.3 试验用大肠埃希氏菌
大肠埃希氏菌的菌株为E.coliJM109,取自南华大学医学院病原生物学研究所。
在-80℃冰箱中保存的冰冻菌种融化后,接种于预先配置好的LB固体培养基上,37℃恒温培养箱培养20 h。根据试验要求配制初始浓度约为109CFU/mL的菌悬液:从平板上挑取E.coliJM109接种于4 mL LB液体培养基,继续于37℃、220 r/min下振荡培养4 h后,测定吸光度0.4~0.5麦氏浊度,即为实验所需菌样。
1.4 E.coli JM109菌种的紫外辐照存活曲线
(1)取8 mL制备的浓度约为109CFU/mL菌液加到直径9 cm的小培养皿内,培养皿内放入无菌磁力搅拌棒,然后置于电磁搅拌器上,15 W和20 W紫外灯下30 cm处,照射前先开启紫外灯预热20 min。开启皿盖在搅拌状态下分别照射 5、10、15、20、30、40、50、60、70、80、90、100、110、120 s,每个照射时间设3个平行样,操作避免白炽光。
(2)取未照射的菌液和照射菌液各1 mL进行稀释分离,避光置于37℃恒温培养箱中培养24 h,利用平板菌落计数法计数。

1.5 多糖抗紫外辐射实验步骤
为得出不同量的多糖对大肠杆菌保护作用的差别,设置200、400、800 mg/L的3个梯度浓度。取浓度为109CFU/mL的大肠埃希氏菌菌悬液1 mL,与浓度为200、400、800 mg/L的多糖溶液7 mL分别混匀,对照为l mL菌悬液与7 mL无菌生理盐水混匀。将之前已制备好的菌液加到直径9 cm的小培养皿内,培养皿内放入无菌磁力搅拌棒,然后置于磁力搅拌器上,于15 W、20 W紫外灯下30 cm处照射,照射前,先开启紫外灯预热20 min。开启皿盖在搅拌状态下分别照射10 s,20 s,40 s及80 s,操作避免白炽光[12]。
取照射后的菌液各1 mL进行稀释分离,避光置于37℃恒温培养箱中培养24 h,利用平板菌落计数法计数活菌细胞数。多糖对实验菌株的紫外保护作用以抗辐射率(%)表示:

Ai:对照实验菌液紫外照射后存活的菌数;
Ao:样品实验菌液紫外照射后存活的菌数。
2 结果与分析
2.1 大肠埃希菌的紫外辐射存活率
图1为紫外灯辐射下大肠埃希菌存活率。

图1 紫外灯辐射下大肠埃希菌存活率
如图1所示,辐射时间为5 s时,15W紫外灯辐射下大肠埃希菌存活率为50%,20W紫外灯辐射下大肠埃希菌存活率为43%;辐射时间为10 s时,15W紫外灯辐射下大肠埃希菌存活率为41%,20W紫外灯辐射下大肠埃希菌存活率为37%;辐射时间为60 s时,15W紫外灯辐射下大肠埃希菌存活率为17%,20W紫外灯辐射下大肠埃希菌存活率为12%;80 s以后,二者的紫外存活率都接近于0。由此可知,随着辐射时间的增长,大肠埃希菌的紫外存活率越来越低,5~40 s之间,该菌的紫外存活率下降比较明显,40~60 s之间该菌的紫外存活率的下降速度趋于平缓,但是60 s之后,该菌的紫外存活率又急速下降,80 s以后几乎没有存活的菌落。该实验结果表明:大肠埃希菌对短时间、低剂量的紫外辐射具有一定的抵抗能力,但对于长时间、高剂量的紫外辐射几乎没有抵抗力;在相同功率的紫外灯照射下,紫外存活率随照射时间延长而降低,高紫外线照射强度对大肠埃希菌的杀菌效果要高于低强度。
紫外线辐射时,大肠埃希氏菌会形成过氧化氢,并进一步产生过氧自由基。由于自由基含未配对的电子,所以极不稳定,因此会从邻近的分子(包括脂肪、蛋白质和DNA)上夺取电子,让自己处于稳定的状态。这样一来,邻近的分子又变成一个新的自由基,然后再去夺取电子,如此连锁反应的结果便是让细胞的结构受到破坏,造成细胞功能丧失、基因突变、甚至死亡。随着辐射时间的增长,大肠埃希氏菌体内产生越来越多的自由基,当自身修复功能不足以阻止自由基的损害时,细胞便走向死亡。
2.2 具鞘微鞘藻胞外多糖抗辐射率
自然界中微生物利用光能、抵御强光的辐射,是光化学反应的主体。紫外线通过光敏化剂间接对DNA产生损伤,通常辐射激发光敏化剂,产生氧或氢氧自由基,引起脂质过氧化,造成对细胞、酶类及核酸等生物大分子的损伤。自由基能造成DNA束断裂、碱基水合物或者导致DNA和与之相联系的蛋白质发生交联。DNA与蛋白质交联形成DNA二级结构,该结构能影响二聚体形成的位置。
利用抗氧化剂消除紫外线辐射所带来自由基的侵害是微生物抵抗紫外辐射的一种机理。多糖是一种新兴的天然抗氧化剂,多糖能够使辐射所引起的迟发型超敏感性反应低下和SOD活性下降明显恢复,过氧化水平降低。在紫外辐射条件下,多糖对大肠埃希氏菌抗紫外辐射能力有一定的增强效应。
2.2.1 不同功率紫外辐射下,胞外多糖浓度对抗辐射率的影响
如图2(a)所示,在20 W紫外灯辐射的条件下,添加400 mg/L多糖溶液的大肠埃希氏菌菌悬液的抗辐射率要高于添加200 mg/L与800 mg/L多糖溶液的菌悬液。如当辐射时间为40s时,添加400 mg/L多糖溶液的菌悬液的抗辐射率为41%,添加200 mg/L与800 mg/L多糖溶液的菌悬液的抗辐射率分别为24%和28%;当辐射时间为80 s时,添加400 mg/L多糖溶液的菌悬液的抗辐射率为24%,添加200 mg/L与800 mg/L多糖溶液的菌悬液的抗辐射率分别为16%和20%。在15 W紫外灯辐射的条件下,多糖的抗辐射率与20 W紫外灯辐射下的抗辐射率大体相似,如图2(b)所示。
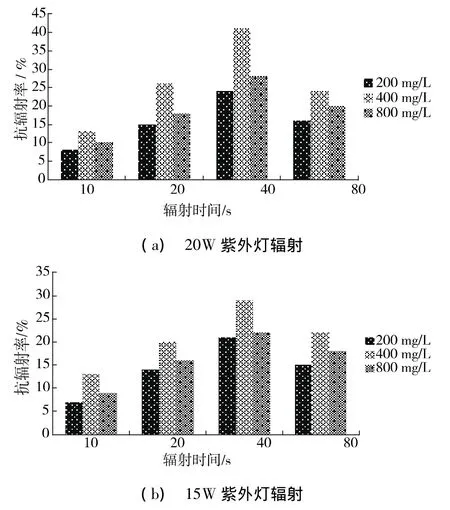
图2 不同紫外灯辐射下多糖抗辐射率
添加400 mg/L多糖溶液且辐射时间为40 s时,大肠埃希氏菌的辐射防护作用最强,这可能是因为浓度为400 mg/L时,多糖能更好地清除由于辐射所导致菌悬液里的细菌组分中分子或原子激发而产生的自由基,并且能增强大肠埃希氏菌本身的免疫力与抗辐射能力,修复紫外辐射损伤,从而保护菌体。200 mg/L的多糖溶液可能由于量太少,不足以迅速清除因紫外辐射而产生的大量自由基,消除紫外辐射对大肠埃希氏菌的负面影响,并且虽然自由基的存活时间非常短暂只有10 s,但是一旦自由基进入生物体内就会直接或间接损伤细胞膜或直接与基因结合导致细胞转化或死亡。800 mg/L的多糖溶液对大肠埃希氏菌的保护作用低于400 mg/L多糖溶液的原因可能是过量的多糖分子挤占了大肠埃希氏菌的生存空间,阻碍其光复活反应或是DNA修复等活动的进行,因此其对大肠埃希氏菌的保护效果较差。
2.2.2 同紫外辐照时间下,胞外多糖浓度对抗辐射率的影响
同一浓度的多糖大肠埃希氏菌菌悬液的抗紫外辐射率大致随时间增长呈上升趋势,但在40 s之后抗辐射率逐渐下降。如图3所示,在多糖浓度为200 mg/L、紫外灯功率为20W、15W条件下,多糖大肠埃希氏菌菌悬液在40 s的抗辐射率分别为24%和22%,在20 s的抗辐射率分别为15%和14%,在80 s的抗辐射率分别为16%和15%,而在10 s的抗辐射率分别只有8%和7%。这可能是因为当辐射时间比较短时,辐射作用产生的自由基相对较少,所以多糖对大肠埃希氏菌的辐射防护作用相对要小,此外,紫外辐射时间较短时,由于大肠埃希氏菌本身的自我保护能力及自我修复功能使其死亡率较低,这也会致使多糖抗辐射率的下降。

图3 胞外多糖浓度对不同紫外辐射的抗辐射情况
20W紫外灯辐射条件下,多糖的抗辐射率高于15W紫外灯辐射下的抗辐射率。在多糖浓度为400 mg/L的条件下,20W紫外灯照射条件下多糖的抗紫外辐射率要比15W紫外灯照射条件下的高出约4~10个百分点。这可能是由于在高强度紫外灯辐射下,产生的自由基更多,自由基形成后,它们可以进攻、浸润和损伤细菌结构,在细胞膜受损部位产生类脂过氧化物,致使死亡的大肠埃希氏菌更多。一方面,在高强度紫外灯辐射下,大肠埃希氏菌本身死亡率较高;另一方面,由于多糖的抗辐射、抗氧化活性增强了大肠埃希氏菌的免疫能力,使该菌在面对高强度紫外辐射时,抵抗能力较强,存活率提高。此外多糖能够清除因辐射产生的大量自由基,阻止自由基对大肠埃希氏菌的浸润、攻击和损伤,维护其生命活动,提高大肠埃希氏菌的紫外存活率。因此,在高强度的紫外辐射条件下,多糖对大肠埃希氏菌的保护作用就更明显,相对来说抗辐射率就更高。
3 结论
多糖作为一种生物活性物质,具有抗氧化和清除自由基的作用,可以综合改善机体的免疫能力和各方面的生理功能。经紫外辐射后的细菌,其细胞DNA会受到损伤,即引起DNA分子形成嘧啶二聚体结构[14],同时还会产生破坏力很强的活性氧自由基,这些自由基反过来又引起DNA分子断裂,进而影响DNA复制或导致基因突变[15]。多糖可以清除OH、O2-自由基,减少自由基对细胞的损伤,减缓脂质过氧化,增强细胞的免疫力,有助于细胞抵抗紫外辐射所引起的损伤。
大肠埃希氏菌是革兰氏阴性菌,细胞壁外膜含有脂质成分,如脂多糖、磷脂和脂蛋白,更易受到氧自由基的侵袭产生类脂过氧化物,损伤细胞的膜结构,导致大肠埃希氏菌的死亡。胞外多糖对大肠埃希氏菌的保护作用一是通过清除自由基,减少自由基对细菌结构的攻击、损伤,另外一个途径就是胞外多糖可以增强大肠埃希氏菌的免疫力和抗氧化功能,对抗紫外辐射损伤。
多糖的抗氧化作用已得到广泛重视,许多研究都表明了多糖具清除自由基,抑制脂质过氧化的作用,它可以保护微生物,提高微生物的紫外存活率。本实验的结果也说明了这一点,也对将来需要继续研究胞外多糖抗紫外辐射活性研究有一定的参考意义。但是关于胞外多糖抗紫外辐射活性还需要更深入的研究,如多糖作用的靶点、有效部位及其机理等。此外,不同的提取方法对多糖结构也会有一定的影响,可能会造成生物活性的差异,因此多糖的提取工艺也应该考虑进来,这些都值得我们进一步探索、研究。
[1]许春平,刘帅,孙斯文.不同来源多糖在降血糖降血脂方面的研究进展[J].食品研究与开发,2014,15:115-118.
[2]唐倩,周楠,唐东山.荒漠蓝藻抗逆性及应用研究进展[J].环境保护与循环经济,2014,11:34 -37.
[3]张雅涵.具鞘微鞘藻室内培养及产胞外多糖条件的优化[D].兰州:兰州理工大学,2014.
[4]Hu CX,Zhang D L,Huang Z B,et al.The vertical microdistribution of cyanobacteria and green algae within desert crusts and the development of the algal crusts[J].Plant Soil,2003,257:97 -111.
[5]Chen L Z,Li D H,Liu Y D.Salt tolerance ofMicrocoleus vaginatusGom.,a cyanbacterium isolated from desert algal crust,was enhanced by exogenous carbohydrates [J].J.Arid Environ.,2003,55b:645 -656.
[6] Stal L J.Cyanobacterial mats and stromatolites[M]//Whitton and Pons(Eds.).The Ecology of Cyanobac teria:Their Diversity in Time and Space.Dordrecht:K luwer Academic Publishers,2000:62.
[7]陈兰周,刘永定,宋立荣.微鞘藻胞外多糖在沙漠土壤成土中的作用[J].水生生物学报,2002,02:155 -159.
[8] Hong-Bin Wang,Sheng-Jun Wu,Dou Liu.Preparation of polysaccharides from cyanobacteria Nostoc communeand their antioxidant activities[J].Carbohydrate Polymers,2014,99:553–555.
[9]陈立,董俊兴.多糖抗辐射作用研究进展[J].癌变.畸变.突变,2004,06:380 -382.
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,2004.
[11]李战.三种紫球藻培养、胞外多糖提取及RAPD分析[D].上海:上海师范大学,2004.
[12]梁晓婷.Pantoea agglomerans TCa-7抗紫外辐射损伤作用的研究[D].大连:中国海洋大学,2006.
[13]王洪媛,江晓路,任虹,等.抗UV-B辐射菌紫外吸收代谢产物分析及其抗紫外辐射活性研究[J].中国海洋药物,2006,04:1 -5.
[14]谢作明.荒漠藻类对紫外辐射的响应及其结皮形成的研究[D].北京:中国科学院研究生院(水生生物研究所),2006.

