石榴果实发育期有机酸组分及含量变化
杨雪梅,尹燕雷,冯立娟,武 冲
(山东省果树研究所,山东 泰安 271000)
石榴(Punica granatum L.)为石榴科石榴属果树,石榴果实营养丰富,其籽粒中果汁含量占70%以上,果汁中含有丰富的糖、有机酸及人体必需微量元素等营养成分,保健功能强。有机酸作为植物初生代谢的产物及代谢中间产物,对植物机体发育过程具调控作用。有机酸可作为新陈代谢活跃的溶质在细胞渗透调节和平衡细胞内过量阳离子;同时有机酸还是植物应对营养亏缺、对抗重金属、植物与微生物在根与土壤交界面发生相互作用机制中的关键成分[1]。有机酸还可提高果实的抗病性[2],有机酸可通过降低鲜切水果和蔬菜的pH值来抑制低温贮藏期间氧化及微生物的生长,研究表明适当浓度柠檬酸处理可保持苹果切块的感官品质,延缓营养物质的下降,抑制微生物的繁殖,对鲜切苹果有较好的护色效果[3]。通常有机酸在果实生长过程中积累,在成熟过程中作为糖酵解、三羧酸循环等呼吸基质以及糖原异生作用基质而被消耗[4]。迄今已通过高效液相色谱(HPLC)技术对包括杏[5]、桃[6-7]、草莓[8-9]、梨[10]、柑橘[11]等多种果树果实中有机酸种类与含量进行测定,但对石榴果实发育过程中有机酸组分动态变化的研究尚未见相关报道。因此,本研究以山东主栽优良品种“泰山三白甜”和“泰山红”为试材,其中,前者籽粒白色口感甜而不酸无涩味,后者籽粒深红似玛瑙,口感酸甜略涩,2个品种在形态及品质上均具有较大差异。通过比较二者果实发育过程中有机酸组分及含量的差异以明确二者品质差异形成的原因,为石榴栽培与生产提供一定的科学理论依据。
1 材料和方法
1.1 试验材料
试验于2014年7—10月进行采样,7月10日开始,每10 d取样1次,直到果实完全成熟。每次采5个果实。供试“泰山红”和“泰山三白甜”石榴果实均采自山东省果树所试验苗圃,树体生长、立地条件和栽培管理水平基本一致,果实随机取自树势基本一致的树冠外围中上部结果枝,取样时间均为10:00左右。釆样后迅速置于放有冰袋的保温盒中,送回实验室置于冰箱中4℃存放,四分法取样,将所釆5个果实分别沿中轴十字形纵切每果实取1/4的籽粒混匀,用4层纱布挤汁迅速置于-20℃冰箱中保存备用。
1.2 主要仪器
实验室超纯水制造系统:LCT理化分析型超纯水机(立纯水处理);XUB5超声脱气系统装置:德国Eppendorf 5415R冷冻高速离心机:Agilent HPLC(美国安捷伦,附紫外检测器);色谱柱:安捷伦ZORBAX Eclipse XDB C18(4.6 mm ×150 mm,5 μm)。
1.3 试验方法
1.3.1 标准曲线的确定 标准溶液的配制:准确称取标准品草酸、酒石酸、抗坏血酸(Vc)和乙酸各10 mg;苹果酸、乳酸、柠檬酸和琥珀酸20 mg用5 mL流动相(含0.2%偏磷酸)溶解定容到10 mL容量瓶中,分别配制成1 mg/mL和2 mg/mL的标准溶液置于 -20℃冰箱中保存备用,制作标准曲线时,分别将配好的标样稀释成6种不同浓度,单独进样记录色谱保留时间(RT值)及不同浓度的峰面积。以进样量(mg/mL)为横坐标,峰面积(mAU·min)为纵坐标,绘制标准曲线,进行线性回归,建立回归方程。
将8种有机酸标准溶液以一定比例混合,过滤后上机,记录混合有机酸标准品溶液色谱图,获得色谱保留时间(RT值)及各组分分离情况。
1.3.2 有机酸的提取与测定 准确量取石榴果汁1 mL,加入0.2%的偏磷酸溶液3 mL,漩涡震荡混匀后于7 500 r/min,4℃离心15 min,转移上清到容量瓶中,沉淀后再分别加入0.2%的偏磷酸溶液3 mL和2.5 mL重复提取收集2次,最后将收集的上清定容至10 mL,过0.45 μm的微孔水系滤膜待测。安捷伦色谱柱:ZORBAX Eclipse XDB-C18柱4.6 mm×150 mm(5 μm),测定使用Agilent 1200 LC型高效液相色谱仪(美国安捷伦),RID 10-A示差折光检测器,流动相:0.2%偏磷酸∶甲醇=95∶5,检测波长分别为210 nm,243 nm[12],流速 0.6 mL/min,进样量 10 μL。
1.3.3 总可滴定酸含量测定 石榴果实可滴定酸含量(titratable acidity,TA)采用酸碱滴定法测定[13]。
1.4 数据处理
数据采用Excel 2003分析软件进行数据分析,相关性分析采用SPSS Statistics19进行统计分析。
2 结果与分析
2.1 标准曲线及检测波长的确定
草酸、酒石酸、苹果酸、柠檬酸、乙酸、琥珀酸和Vc,分别单独进样,获得各自色谱保留时间即RT值(表1)。以进样量(mg/mL)为横坐标,峰面积(mAU·min)为纵坐标,绘制标准曲线,进行线性回归,建立回归方程,信噪比S/N=3时标准溶液浓度为方法检测限。从表1可看出,相关系数R值与精密度RSD值符合实验预期要求,表明该色谱工作条件测定有机酸性能稳定、重现性高。

表1 不同有机酸标样回归方程及检出限Tab.1 Regression equations and detection limit of different organic acid sample
图1所示,8种酸按一定比例混合后过滤上机,进样6次,记录混合有机酸标准品溶液色谱图。8种酸的混合标样除Vc外均在210 nm处有最大吸收峰(图1a),而Vc在243 nm下有最大吸收峰(图1b),根据其吸收峰的波长不同可分别测定出7种有机酸和Vc含量。

图1 不同波长下7种有机酸和Vc混和标准品HPLC图谱(a:检测波长210 nm;b:检测波长243 nm)Fig.1 Mixed standard sample of 7 kinds organic acid and Vc by HPLC under different wavelength(a:detection wavelength of 210 nm;b:detection wavelength of 243 nm)
2.2 “泰山三白甜”和“泰山红”石榴果实发育过程中总可滴定酸(TA)含量
图2所示,2个石榴品种果实发育过程中TA含量均呈发育前期高,后期降低的趋势,整个发育期内出现2~3次高峰,且前期峰值均高于后期峰值。花后30~50 d2个石榴品种TA含量均呈升高趋势,至第50天TA含量均升至发育期内第1次峰值;50~60 d二者有机酸含量均迅速降低;60~90 d期间“泰山红”石榴TA含量呈缓慢降低趋势;“泰山三白甜”石榴在70~90 d期间TA含量逐渐升高,至第90天达第2次峰值,之后TA含量迅速降低;而“泰山红”石榴至第100天TA含量达第2次峰值,之后TA含量先降低后略有升高。在整个果实发育过程中“泰山红”石榴果汁中的总可滴定酸均高于各个时期的“泰山三白甜”石榴。

图2 “泰山三白甜”和“泰山红”石榴果实发育过程中总可滴定酸含量变化Fig.2 Changes of total titriable acid of‘Taishansanbaitian’and‘Taishanhong’pomegranate during the fruit developing

图3 “泰山三白甜”和“泰山红”石榴果实发育过程中各有机酸含量变化Fig.3 Changes of each organic acid content of‘Taishansanbaitian’and‘Taishanhong’pomegranate during the fruit developing
2.3 “泰山三白甜”和“泰山红”石榴果实发育过程中各有机酸组分含量变化
图3a,b,c所示,2个石榴品种果实发育过程中草酸、柠檬酸和琥珀酸3种有机酸含量变化趋势均呈相类似的双峰曲线,其中以草酸含量变化曲线与TA含量变化趋势最一致。2个品种草酸含量均在花后第50天达最高分别为40.70 mg/mL和18.08 mg/mL,整个发育期内“泰山红”石榴草酸含量均较“泰山三白甜”石榴高,前者含量约为后者的2.1~3.5倍(图3a);2个石榴品种的柠檬酸含量均在11 mg/mL以上,且整个发育期内“泰山三白甜”石榴柠檬酸含量均高于“泰山红”石榴,其柠檬酸含量在各个时期均在21 mg/mL以上(图3b);整个发育期内“泰山三白甜”石榴琥珀酸含量(1.78~3.24 mg/mL)均高于“泰山红”石榴(0.45~0.89 mg/mL),“泰山三白甜”石榴是“泰山红”石榴琥珀酸含量的3.0~7.1倍(图3c)。由此可知,草酸为和柠檬酸分别为“泰山红”和“泰山三白甜”石榴的主导有机酸,而草酸的含量是总可滴定酸含量影响最大。
图3d所示,2个石榴品种果实发育过程中苹果酸含量变化趋势较一致,均呈下降趋势,果实发育过程中“泰山三白甜”中苹果酸含量均高于“泰山红”石榴。花后30~40 d二者苹果酸含量均呈上升趋势,到花后第40天二者苹果酸含量均达最高,分别为“泰山三白甜”14.892 1 mg/mL和“泰山红”8.012 1 mg/mL。花后40~50 d含量均迅速降低,花后60 d至采收前二者苹果酸含量变化均较平稳。
图3e示,石榴发育过程中2个石榴果实中Vc含量均不足0.1 mg/mL,Vc含量在整个发育过程中2个石榴品种均出现2个高峰,“泰山三白甜”石榴于花后第70天含量达最高每100 g鲜质量约7.4 mg;“泰山红”石榴于花后第40天含量达最高含量每100 g鲜质量约7.0 mg,且其60~120 d“泰山三白甜”果实中Vc含量均高于“泰山红”。表明这2个石榴品种果实中Vc含量中等,石榴的较强的抗氧化性能可能来源于其酚类物质。
图3f所示,果实发育过程中“泰山三白甜”石榴在盛花后30~50 d酒石酸含量迅速升高,至50 d时达最高约1.37 mg/mL,50~60 d含量迅速降低,70~120 d酒石酸含量变化趋势较为平缓在0.57~0.64 mg/mL;而“泰山红”石榴果实中酒石酸含量在整个发育过程中变化趋势始终较为缓慢在0.46 ~0.68 mg/mL。
乙酸和乳酸在2个石榴品种果实中含量均较低,不足0.1 mg/mL。乙酸含量在2个石榴品种果实发育过程中均维持在一定水平,表明乙酰CoA脱乙酰基生成的乙酸在石榴代谢过程中处于稳态(图3g);2个石榴品种果汁中均检出少量的乳酸,2个石榴品种发育过程中乳酸含量变化趋势基本一致(图3h),表明石榴代谢发育过程中存在乳酸参与的代谢途径。
2.4 “泰山三白甜”和“泰山红”石榴果实发育期内各有机酸组分的含量
图4所示,试验中7种有机酸在石榴不同发育时期均有检出,其中“泰山红”石榴中以草酸含量最高,其次分别为柠檬酸、苹果酸、酒石酸、琥珀酸、乙酸和乳酸。而“泰山三白甜”石榴果实中以柠檬酸含量最高,其次分别为草酸、苹果酸、琥珀酸、酒石酸、抗坏血酸、乙酸和乳酸。表明2个石榴品种的有机酸含量及组成比例不同,这可能是影响2个石榴品种口感,造成“泰山红”比“泰山三白甜”口感偏酸的主要原因之一。

图4 “泰山红”和“泰山三白甜”石榴果实发育期内各有机酸组分的平均含量Fig.4 Average contents of each organic acids composition in‘Taishansanbaitian’and‘Taishanhong’pomegranate fruit during the developing period
2.5 “泰山三白甜”和“泰山红”石榴果实发育期内各有机酸组分含量相关性分析
有表2可知,2个石榴品种各有机酸组分相关性不同。“泰山三白甜”石榴果实发育过程中酒石酸和草酸含量及柠檬酸和乙酸含量均在0.01水平上两两呈显著正相关;琥珀酸、酒石酸和苹果酸及苹果酸和Vc含量均在0.05水平两两上呈显著负相关。而“泰山红”石榴果实发育过程中酒石酸和乳酸、乙酸含量均在0.01水平上两两呈显著正相关;草酸和乳酸含量在0.05水平上呈显著正相关。表明2个石榴品种果实发育过程中各有机酸的代谢相关性不同,其原因尚不明确,有待于深入研究。
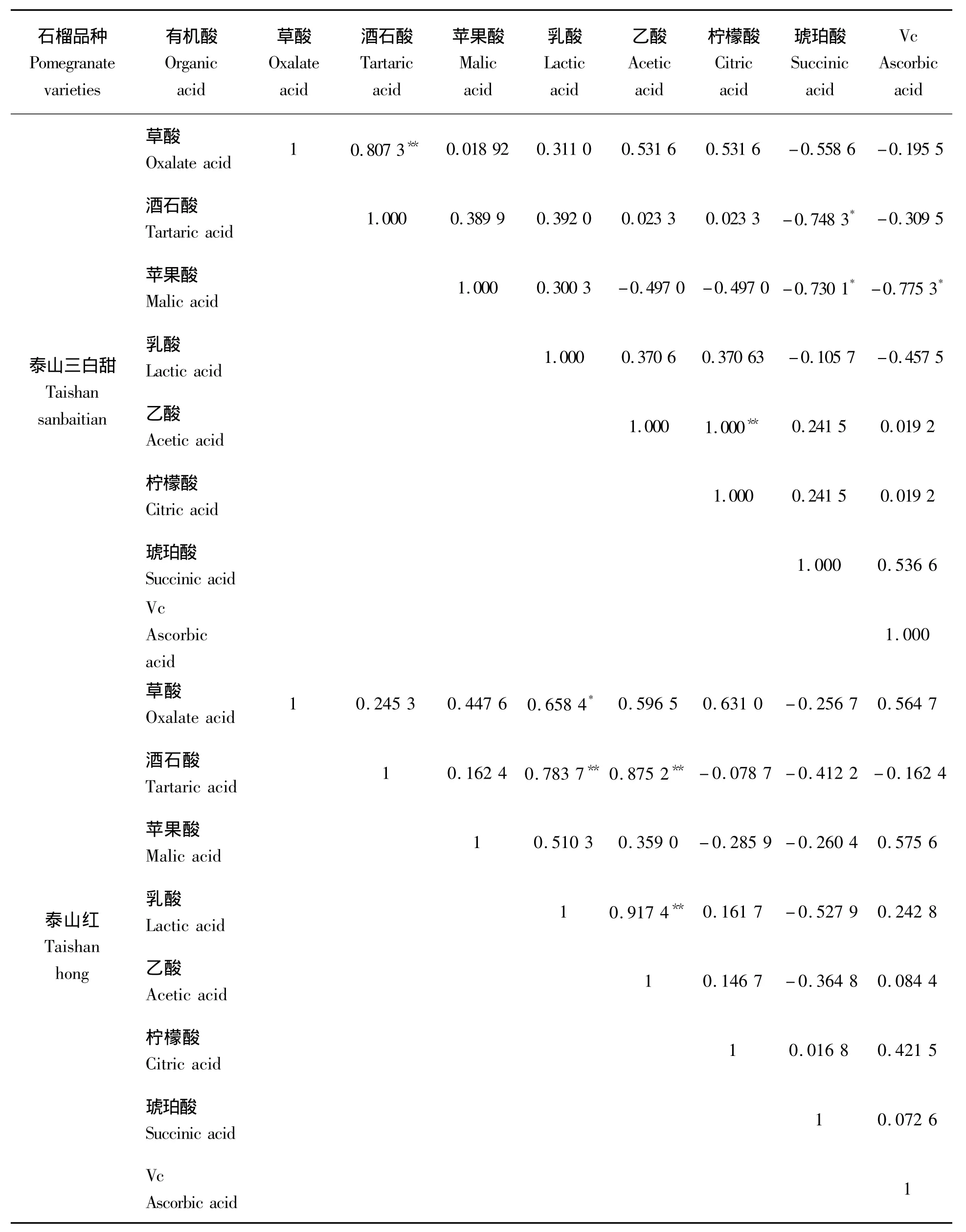
表2“泰山三白甜”和“泰山红”石榴果实发育期内各有机酸组分含量相关性分析Tab.2 The correlation analysis of organic components in‘Taishansanbaitian’and‘Taishanhong’pomegranate fruit during the developing period
3 结论与讨论
果实中有机酸、糖及一些挥发性成分共同形成果实的特有风味。不同果实及同一果实的不同部位有机酸含量不同。同一树种不同品种果实各有机酸组分变化也不同,通常随着果实的发育成熟果实中有机酸含量降低[14]。有机酸含量在果实发育过程中呈动态变化,本研究中,2个石榴品种果实发育期均以柠檬酸、草酸、苹果酸和琥珀酸为主要有机酸成分,不同之处在于各有机酸所占比例不同。“泰山红”石榴果实发育过程中始终以草酸含量最高,“泰山三白甜”始终以柠檬酸含量最高。“泰山三白甜”果实中苹果酸和琥珀酸含量在整个发育期内均高于“泰山红”,但其TA始终低于“泰山红”,“泰山三白甜”整个发育期口感偏甜,无明显酸味,其原因可能与草酸含量直接相关。比较3种主要有机酸的离解常数 PKa1值:草酸(1.22)<柠檬酸(3.15)<苹果酸(3.46),可知草酸酸性最强[15],因此,草酸含量的差异一定程度上决定了2个石榴品种的风味及口感的差异。
柠檬酸是石榴中含量最高的有机酸之一,柠檬酸在机体内起着重要作用。有研究表明柠檬酸可影响草酸钙结石的形成,可同时抑制草酸钙的成核、生长和聚集[16],这可以解释石榴中高含量的草酸食用后并未对人体造成伤害,可能与石榴中较高含量的柠檬酸有关。
通过对石榴发育过程中有机酸含量的分析发现:石榴中有机酸含量丰富,尤其以柠檬酸和草酸最多,不同品种石榴的有机酸组分含量差异较大。通过对有机酸组分及含量的测定为进一步研究石榴中各有机酸的代谢途径提供基础。因此,石榴有机酸合成及代谢的相关限制性酶及部分有机酸在石榴机体内的功能将是下一步研究的重点。
[1]López-Bucio J,Nieto-Jacobo M F,Ramirez-Rodriguez,et al.Organic acid metabolism in plants:from adaptive physiology to transgenic cultivars for cultivation in extreme soils[J].Plant Science,2000,160(1):1-13.
[2]Sun X H,Xiong J J,Zhu A D,et al.Sugars and aganic acids changes in pericarp and endocarp tissues of pumelo fruit during postharvest storage[J].Scientia Horticulturae,2012,142(7):112-17
[3]范林林,赵文静,赵丹,等.柠檬酸处理对鲜切苹果的保鲜效果[J].食品科学,2014,35(18):230-235.
[4]陈发兴,刘星辉,陈立松.果实有机酸代谢研究进展[J].果树学报,2005,22(5):526-531.
[5]Bartolozzi F,Bertazza G,Bassi D,et al.Simultaneous determination of soluble sugars and organic acids as their trimethylsilyl derivatives in apricot fruits by gas-liquid chromatography[J].Journal of Chromatography A,1997,758(1):99-107.
[6]牛景,赵剑波,吴本宏,等.不同来源桃种质果实糖酸组分含量特点的研究[J].园艺学报,2006,33(1):6-11.
[7]Wu B H,Quilot B,Génard M,et al.Changes in sugar and organic acid concentrations during fruit maturation in peaches,P.davidiana and hybrids as analyzed by principal component analysis[J].Scientia Horticulturae,2005,103(4):429-439.
[8]吴本宏,李绍华,Quilot B,等.桃果皮毛、果肉颜色对果实糖与酸含量的影响及相关性研究[J].中国农业科学,2003,36(12):1540-1544.
[9]Selli R,Sansavini S.Sugar,acid and pectin content in relation to ripening and quality of peach and nectarine fruits[J].Acta Horticulturae,1995,379(6):345-358.
[10]霍月青,胡红菊,彭抒昂,等.砂梨品种资源有机酸含量及发育期变化[J].中国农业科学,2009,42(1):216-223.
[11]Silva F O,Ferraz V.Microwave-assisted preparation of sugars and organic acids for simultaneous determination in citric fruits by gas chromatography[J].Food Chemistry,2004,88(12):609-612.
[12]陈雪,吴林,李刚,等.食品中总抗坏血酸和总异抗坏血酸HPLC法测定[J].中国公共卫生,2011,27(2):160-161.
[13]张宪政,陈风玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994:9.
[14]文涛,熊庆娥,曾伟光.脐橙果实发育过程中有机酸合成代谢酶活性的变化[J].园艺学报,2001,28(2):161-163.
[15]华东理工大学化学系,四川大学化工学院.分析化学[M].北京:高等教育出版社,2003:410-411.
[16]李君君,侯善华,夏志月,等.服用柠檬酸钾前后草酸钙结石患者的尿微晶和尿液性质变化[J].无机化学学报,2012,28(2):245-250.

