2012—2013年我国部分地区猪伪狂犬病流行病学调查
邹 敏,杨旭兵,郑 辉,王 红,李陆梅,孙 健,王福军,吴发兴,范根成
(1.青岛易邦生物工程有限公司,山东 青岛 266114;2.中国动物卫生与流行病学中心,山东 青岛 266032)
伪狂犬病(pseudorabie,PR)是由伪狂犬病病毒(pseudorabie virus,PRV)感染引起的猪、牛、羊、犬等多种动物共患、急性传染病[1-2],我国将其列为二类动物传染病。猪是PRV的贮存宿主,病猪、带毒猪以及带毒鼠类为本病重要传染源[3]。猪感染PRV后的临床症状因感染日龄而异,仔猪常表现明显的神经症状或顽固性腹泻,病死率达100%;断奶仔猪病死率为10%~20%;育肥猪常呈隐性感染,仅表现增重减慢;成年猪感染后多耐过,但长期排毒;母猪则现为返情、不发情、屡配不孕;妊娠母猪通常表现为流产、产死胎和木乃伊胎;公猪则常发生睾丸肿胀、萎缩、种用性能降低或丧失等[4]。
本病于1902年由匈牙利学者Aujeszky最先发现,此后陆续在各养猪国家或地区被发现。我国自1947年首次报道此病以来[5],此病几乎遍布全国各地,严重阻碍了我国养猪业的健康发展。
控制本病最优先的方式是进行疫苗免疫接种。目前,美国、德国、荷兰、比利时等西方发达国家均通过接种PRV基因缺失弱毒疫苗、疫情监测等制订一整套猪伪狂犬病根除计划,消灭了该病[6]。我国对猪伪狂犬病实施预防为主的策略,通过开展疫苗(主要是PRV弱毒活疫苗)免疫、流行病学调查、监测及综合性措施进行防控。2012年,我国首次颁布了《国家中长期动物疫病防治规划(2012—2020年)》,明确提出采取分病种、分区域、分步骤的策略,通过加大疫病监测、流行病学调查、提升科技支撑能力等措施,在2020年将生猪发病率降至5%,使猪伪狂犬病、猪瘟等猪群疫病得到净化或根除。
为了摸清PRV感染情况,我们陆续对采集或收集的猪场组织样品、血清样品进行了PRV PCR和野毒感染抗体检测,现将有关情况报告如下。
1 材料与方法
1.1 材料
1.1.1 组织样品。2012年至2013年,青岛易邦公司技术服务部采集或收集来自我国东北、华北、华中、华东、华南、西南等地区14个省份、169个疑似繁殖障碍发病猪场的组织样品1127份,经查询来样登记表,其中明确使用猪伪狂犬病弱毒活疫苗的猪场有151个。
1.1.2 血清样品。2012年至2013年,共采集或收到来自我国东北、华北、华中、华东、华南、西南等地区18个省份、393个猪场的猪血清样品14801份,经查询来样登记表,曾明确使用过猪伪狂犬病弱毒活疫苗的猪场有291个。
1.1.3 PRV gE-PCR检测用试剂。PRV gE-PCR检测引物直接引用吴发兴等[7]的设计,上、下游引物的序列是:TCCACTCgCAgCTCTTCTCg、gCACgTCATCACgAAggAgC,预期扩增产物大小约632bp,引物序列送上海生工进行合成,溶解成20 pmol的浓度,-20℃冻存备用。DNAzol购自Invitrogen公司,Ex-Taq酶、GC BufferI、DNA 2000Marker等PCR检测用试剂购自大连宝生物。
1.1.4 ELISA检测用试剂。伪狂犬病毒gpI ELISA(即gE-ELISA,用于检测PRV野毒感染抗体)检测试剂盒购自美国IDEXX公司。
1.1.5 主要仪器。3K15型台式冷冻离心机由德国Sigma公司生产,TP600型PCR仪由宝生物公司生产,电泳仪及凝胶成像仪由北京六一仪器公司生产,Mutiskan MK3型酶标仪由美国Thermo公司生产。
1.2 方法
1.2.1 待检样品处理
1.2.1.1 组织样品的预处理。将冻存的组织样品(主要是脾脏、淋巴结,少量样品还含有脑组织)取出置室温解冻,然后在超净工作台中用灭菌处理的剪刀、镊子先剪至米粒大小,然后转移至预先灭菌处理的玻璃研磨器中,加入5倍体积的灭菌生理盐水,再研磨至糊状,然后分装到2mL灭菌离心管中,-70℃冻存待检。
1.2.1.2 血清样品的预处理。将采集或收集到的血清样品平衡至室温,观察样品是否呈淡黄色、透明状液体,否则需经过低速离心处理后方能进行抗体检测。
1.2.2 样品检测
1.2.2.1 组织样品PRV gE-PCR检测。从-70℃冰箱中取出经预处理的样品混悬液在室温融解,4℃ 12000 r/min离心10 min,取250μL上清加入750μL DNAzol中提取PRV DNA,按照参考文献[7]中的PRV野毒感染PCR检测体系及方法进行PRV gE-PCR扩增,扩增结束后进行电泳检测,用凝胶成像仪观察是否有目的条带出现,在阳性对照成立前提下进行PCR检测结果判定。
1.2.2.2 血清样品检测。取1.2.1.2节预处理过的猪血清和gE-ELISA试剂盒平衡至室温进行检测,检测过程严格按照试剂盒说明书进行,在阴阳性对照成立的前提下,如果待检样品的S/N值<0.60,结果判定为PRV gE抗体阳性;如果待检样品的S/N值﹥0.70,结果判定为PRV gE抗体阴性;如果0.6<S/N值≤0.7,则判定为可疑,需再次检测。
2 结果与分析
2.1 组织样品PRV PCR检测结果
2.1.1 PRV病原学检测结果。对1127份发病猪组织样品进行PRV gE-PCR检测,结果共检出PRV核酸阳性样品98份,总体阳性率为8.69%;169个场中有31个猪场检出PRV核酸阳性,场阳性率为18.34%。其中,明确使用猪伪狂犬病弱毒疫苗的151个猪场中检出PRV核酸阳性场21个,场阳性率为13.91%;未进行PRV弱毒活疫苗免疫或免疫背景不清楚的18个猪场中PRV核酸阳性场为10个,场阳性率为55.56%。组织样品的PRV野毒感染PCR检测结果说明,上述地区猪群中存在PRV野毒感染(表1)。
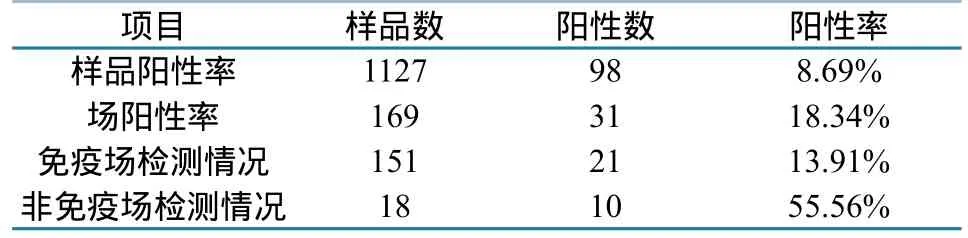
表1 2012—2013年14省份规模猪场PRV野毒感染PCR检测结果
2.1.2 不同年份组织样品PRV gE-PCR检测结果比较。为了解采自不同年份发病猪场组织样品中PRV野毒感染情况差异,对来自不同区域的发病猪组织样品中PRV野毒感染PCR检测结果进行了比较,总体表现为随着时间的推移,上述地区猪群中PRV野毒感染情况存在差异,有上升趋势(表2)。

表2 2012—2013年不同地区规模猪场PRV野毒感染情况PCR检测结果比较
2.1.3 PRV gE-PCR检测情况区域差异比较。为比较各地区PRV病原学检测结果差异,对组织样品PCR检测数据按地区进行分类统计,结果发现不同年份、不同地区被采样猪群中均存在不同程度的PRV野毒感染,其中,华东地区被采样猪群中PRV的病原学检出率较高,其次是华中地区(图1)。
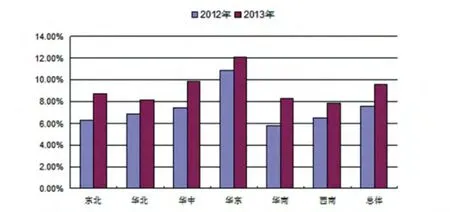
图1 不同年份、不同地区规模猪场PRV PCR检测结果比较
2.2 血清样品PRV gE-ELISA抗体检测结果
2.2.1 PRV gE-ELISA检测结果。对14801份血清样品进行检测,共检出PRV gE抗体阳性样品2388份,平均阳性率达16.13%;393个场中173个猪场检出PRV gE抗体阳性,场阳性率为44.02%。其中,曾进行过猪伪狂犬病弱毒疫苗免疫的291个猪场中检出阳性场158个,场阳性率达54.29%;未进行疫苗免疫或免疫背景不清楚的102个猪场中有15个场检出阳性,阳性率为14.71%(表3)。说明,上述18个省份猪群中可能存在PRV野毒感染,且较为普遍。

表3 2012—2013年18省份规模猪场PRV gE抗体检测结果
2.2.2 不同年份PRV gE抗体阳性率比较结果。为了解采自不同年份猪血清样品中PRV gE抗体阳性率差异,我们对来自不同区域的猪血清样品PRV gE抗体阳性率进行了比较,总体表现为随着时间的推移,上述地区猪群中PRV gE抗体阳性率呈上升趋势(表4)。

表4 2012—2013年不同地区规模猪场PRV gE抗体阳性率比较
2.2.3 PRV gE抗体检测区域差异比较。为比较各地区PRV感染情况,我们对检测数据按地区进行分类统计,结果发现不同年份、不同地区被采样猪群中均存在不同程度的PRV野毒感染,其中华东地区感染情况最为严重,2012—2013年被检测群体的PRV gE抗体阳性率均超过了20%,其次是华中、华南地区,西南、华北、东北地区相对较低(图2)。

图2 不同年份猪群规模猪场PRV gE抗体阳性率示意图
2.2.4 不同日龄猪群PRV gE抗体检测差异比较。为比较不同年份、不同日龄的猪群中PRV感染情况,我们对检测数据按照年份、猪的日龄进行分类统计(剔出日龄不明确的样品),结果发现,不同日龄的猪群PRV感染情况也存在差异,总体感染情况由高到低依次为种猪、哺乳仔猪、育肥猪、保育猪,但随着时间推移,各年龄阶段猪群中PRV野毒感染呈逐年上升趋势(表5)。
3 讨论
3.1 本研究中的样品病原学检测结果显示,从14个省份、169个猪场、1127份发病猪组织样品中检出PRV核酸阳性样品98份,总体阳性率为8.69%;169个猪场有中31个检出PRV核酸阳性,场阳性率为18.34%。其中,明确使用PRV弱毒活疫苗的151个猪场中有21个阳性场,阳性率为13.91%;未进行PRV弱毒活疫苗免疫或免疫背景不清楚的18个猪场中阳性场为10个,场阳性率为55.56%。表明在上述省份的被采样猪群中存在PRV野毒感染。同时,按区域进行归类分析,可见华东、华中地区被检测猪群PRV野毒检出率高于东北、华北、华南、西南地区;从年份上看,上述地区被检测猪群PRV野毒感染情况总体呈上升趋势。
3.2 2012—2013年,18个省份、393个猪场检出PRV gE抗体的总体阳性率达16.13%,场阳性率达到22.02%,剔除未免疫PRV弱毒疫苗场后的猪场阳性率高达54.29%,未进行PRV弱毒疫苗免疫的场阳性率也达到了14.71%,说明上述地区的猪场的确存在PRV野毒感染。比较数据发现,曾经使用过PRV弱毒活疫苗的猪场PRV野毒感染阳性率
反而比未免疫场或没有明确免疫信息场PRV野毒感染阳性率还高,主要原因是本研究的数据全部来自疑似发病猪场,不排除已发生猪伪狂犬病的可能。规模化养猪场的免疫程序是根据本场疫病流行情况、防控需要制定的;疫苗免疫场阳性检测率较高,可能是在免疫空白期感染了PRV野毒,因为PRV一旦感染就会终身潜伏在猪体内,会产生gE抗体本底,也不排除个别猪场使用过PRV全病毒灭活疫苗的可能性。
3.3 本研究先期主要开展的针对发病场或临床不稳定猪场的PRV野毒感染血清学鉴别检测,对揭示被采样地区相关猪场的PRV感染本底指导猪场开展本病的免疫与防控具有一定指导价值。同时,为掌握上述地区猪场PRV感染情况,我们还进行了PRV野毒感染情况PCR检测,尽管样品数量相对较少,但检测结果也充分证实这些猪场的确存在PRV的感染或发病。在后续监测中我们将加大病原学检测数量,进一步掌握上述地区猪场PRV的感染状况。
3.4 比较不同采样时间、不同采样地区以及不同日龄(即生产阶段)猪群组织及血清样品中PRV野毒感染检测数据发现样品所在地区均存在不同程度的PRV野毒感染,以华东、华中最为严重;且各个地区猪群中PRV感染情况随时间推移有上升趋势。提示,上述地区应加强该病的防控,各猪场应确实做好猪伪狂犬病免疫和监测,特别是要加强对种猪的免疫工作,必须确保从源头做好净化。查验样品登记表发现,多数猪场尽管进行了本病免疫,但多限于种猪,为降低生产成本,很少对后备猪、育肥猪进行免疫,结合后备猪及育肥猪血清样品PRV野毒感染抗体阳性率上升的这一结果,说明必须加强对后备猪的免疫工作,以确保猪场生产平稳,避免发生疫情。
3.5 本研究结果充分说明,控制与净化伪狂犬病对各养猪场来说仍然是一项挑战性工作,特别是在当前养殖密度高、流通频繁、环境污染严重的大背景下。为有效预防和控制该病的发生与流行,借鉴欧美等发达国家消灭猪伪狂犬病的成功经验,引导相关猪场采取以下综合防控措施:一是坚持自繁自养、全进全出的养殖模式。二是严格引种管理,应从无伪狂犬地区的猪场引种,做好引种前的隔离观察、检疫工作,从源头坚决阻断外疫传入。三是做好疫苗免疫接种工作,选择临床免疫预防效果确实的疫苗(建议使用安全有效的gE基因完全缺失弱毒疫苗),有效降低猪场猪伪狂犬病的发病率、死亡率,避免野毒感染。四是定期进行免疫抗体和野毒感染抗体监测,依据检测结果及时进行免疫或补免,当检测到阳性动物时,结合病原学检测结果,及时、坚决剔除阳性动物,以便净化种群。五是加强猪场的饲养管理、营养和保健,以提升群体抗病能力。此外,还应加强猪场的灭鼠、消毒工作,严格禁止外来人员、车辆入场。
[1]殷震,刘景华.动物病毒学 [M].2版.北京:科学出版社,1997:998-1009.
[2]Barbara E S,Jeffery J E,Sylvie D A,et al.猪病学[M].赵德明,张仲秋,沈建忠,译.9版.北京:中国农业科学出版社,2008:465-505.
[3]娄高明,杜伟贤.伪狂犬病流行情况及猪场防制策略[J].中国动物检疫,1999,16(5):43-51.
[4]农业部兽医局.一二三类动物疫病释义[M].北京:中国农业出版社,2011:139-146.
[5]杨尚斌,高洪,黄慧,等.大理地区散养户猪伪狂犬病病毒野毒株感染的血清学分析[J].动物疫学进展,2012,33(1):121-123.
[6]倪娇,周绪斌,张馨玉,等.近期部分规模化猪场猪伪狂犬病野毒抗体监测情况调查[J].中国畜牧兽医,2007,34(9):201-203.
[7]吴发兴,郑辉,亓传德,等.猪伪狂犬病病毒PCR检测方法的建立与应用[J].动物疫学进展,2009,30(5):5-9.

