巯基乙胺改性蛭石对水体中Ag(I)的吸附性能研究
陈理想,吴平霄,杨 林,祝雅杰 (.华南理工大学环境与能源学院, 工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 50006;2.广平大学,越南 广平)
银因具有良好的可锻性、延展性、光敏性以及导电导热性,广泛应用于电镀、电池、胶卷等领域;长期接触银类化合物可能导致肝脏和肾脏等受到损害[1-2].目前常用的处理银的方法有离子交换法[3]、电解法[4]以及膜分离法[5]等.但这些方法一般具有处理成本高、运行费用高等缺点.吸附法由于其操作简单、吸附效率高和吸附剂种类多等特点,已广泛用于处理各种重金属含量超标的废水[6-11].黏土矿物作为一种普遍吸附材料,具有储量丰富、价格低廉、较高的比表面积和环境友好性等特点[12-13].
蛭石是由一个铝氧八面体和两个硅氧四面体组成层状粘土矿物,具有较好的物理和化学稳定性.由于蛭石层间和表面的离子交换过程,以及同型置换作用,使得蛭石具有较高的离子交换容量[14].蛭石的这种特性也使得其能作为一种有效的吸附剂来去除废水中的重金属.但由于蛭石对重金属离子的吸附能力有限,所以很多学者针对提高蛭石对重金属的吸附能力而开展了广泛的研究[7,15].
胺基作为一种中性基团,其中氮原子上有一对自由电子,如果利用含胺基物质来改性粘土矿物,可以提高黏土矿物对重金属的吸附能力.有学者利用乙胺改性蒙脱石和蛭石来吸附重金属,获得了较好的效果[16-17].为了进一步研究胺基对黏土材料的改性作用以及对重金属的吸附机理同时制备一种新型的高效吸附剂,本文选用巯基乙胺改性蛭石,利用FTIR、BET、TG-DSC等手段研究改性蛭石的结构特征,并研究其对 Ag+的吸附性能;同时探讨吸附时间、pH值、初始浓度、吸附剂量以及共存阳离子对吸附性能的影响.最后结合结构表征以及等温吸附模型和动力学模型,分析改性蛭石对Ag+的吸附机理.
1 实验部分
1.1 实验材料
蛭石原土(VER)购于中国广东省飞来峰非金属矿物有限公司,阳离子交换量为85.5mmol/100g,巯基乙胺购自上海阿拉丁试剂有限公司,无水乙醇(CH3CH2OH)、硝酸银(AgNO3)、氢氧化钠(NaOH),盐酸(HCl),硝酸(HNO3)均为分析纯,均购于广州化学试剂厂,去离子水为实验室自制.
1.2 改性蛭石的制备
将原始蛭石磨碎后200目筛,然后密封保存储备;取磨好的蛭石3g加入到60mL的蒸馏水中,配制成5%的悬浮液,将悬浮液在60℃下超声10min,按1.0倍CEC的比例加入巯基乙胺(MEA),在30 ℃下振荡24h后离心分离,用蒸馏水洗涤3次.得到的固体在60℃烘箱内干燥,得到的样品研磨过200目筛,密封保存.最终产品命名为MEA-VER.
1.3 材料的表征
复合材料的傅里叶变换红外光谱(FT-IR)表征采用PerkinElmer公司的1725X红外光谱仪,分辨率为0.3cm-1,扫描波长范围为400~4000cm-1,测试温度为 25℃.样品的制备过程为:将粉末状样品和烘干后的 KBr晶体研磨 10min,样品和KBr的百分比为0.2%~1%,然后在固体压片机上压成小圆片.材料的比表面积分析采用美国Micromeritics公司的ASAP 2020比表面积与孔径测定仪,测试条件为:以氦气为载气,在 353.5K脱气 12h,用 N2吸附法测定吸附剂的比表面积,用 t-plot方法计算外表面积和微孔体积,用 BJH方法计算平均微孔直径.热重分析测试采用 STA 449F1型扫描量热仪进行,测试方法:测量范围从室温缓慢升温至 800℃,升温速率 5℃/min,N2流速10Ml/min,差热量程100μV,仪器分辨率2℃.
1.4 吸附试验
以银离子作为目标污染物,称取一定量的AgNO3分析纯试剂,加入烧杯后再加适量的去离子水,配制一系列梯度浓度的 Ag+溶液.分别称取VER和MEA-VER各0.05g,放在50mL离心管中,各加入25mL浓度为120mg/L的AgNO3溶液,充分混合,用0.1mol/L的HCl和NaOH溶液调节pH值至6,放在摇床上在30℃的条件下反应24h.
待反应完毕,在4800r/min条件下离心15min,取上清液用 0.45µm 滤头过滤,用原子荧光光谱仪测定溶液中 Ag+离子的残余浓度.另外,在相同的条件下分别测定在不同的吸附时间(5~1440min)、 pH 值 (1~12)、 吸 附 剂 量(0.4~12g/L)、Ag+初始浓度(2~1000mg/L)以及离子强度(Ca2+、Na+)下溶液中Ag+的残留浓度.
通过下面公式来计算吸附量(mg/g)和去除率(%):

式中:V,重金属溶液的体积,mL;m,黏土矿物的用量,g;C0、C吸附前后重金属离子的浓度,mg/L.
2 结果与讨论
2.1 傅里叶红外光谱分析(FTIR)
图1为VER和MEA-VER的红外光谱图.在天然蛭石的红外光谱图中,457、683和 1002cm-1处的强吸收峰分别代表蛭石晶体片层中 Si-O的伸缩振动、R-O-Si(R = Fe, Al, Mg)振动和Si-O-Si弯曲振动[18];648cm-1处的吸收峰代表了蛭石层间吸附水O-H的弯曲振动[16];3410和3715cm-1处的吸收峰分别代表了四面体片层中-OH的伸缩振动和Si-OH基团中O-H的拉伸振动[19].这些红外特征峰都与蛭石的结构特征有关.与VER的红外光谱相比,MEA-VER出现了一些新的吸收峰.其中,1459、1511和3252cm-1处的吸收峰代表-CH2的变形振动或-NH2的弯曲振动[20];1400cm-1处的吸收峰代表了-CH2的弯曲振动[21].这些吸收峰都是巯基乙胺的特征吸收峰,表明巯基乙胺已经成功的负载到蛭石上.因为巯基乙胺在原始蛭石上的修饰比例较小,所以C-S基和S-H的伸缩振动峰(分 别 为 700cm-1和 2500cm-1)并 未 在MEA-VER的红外图谱中表现出来[22].
2.2 比表面积与孔结构分析(BET)
图2为VER和MEA-VER的N2吸附-脱附曲线,从图2可以看出,VER和MEA-VER的吸附-脱附曲线为典型的 IV 型等温线,在p/p0为0.2~1.0的区间内具有吸附-脱附滞后环,表现出明显的介孔材料特征[23].图 3为 VER和 MEAVER的孔径分布曲线,从图 3可以看出,VER和MEA-VER的平均孔径分布比较广泛,且两种材料中的孔道结构基本为介孔(2~50nm).结合表 1数据可以看出,经过巯基乙胺改性之后,蛭石的微孔体积有所增加,平均孔径减少,这表明巯基乙胺改性起到了一定的造孔作用.改性后比表面积从3.82m2/g增加到了 14.87m2/g,孔体积从0.0074cm3/g增加到了 0.0194cm3/g,这主要是改性过程中的表面沉淀作用和巯基乙胺对蛭石的侵蚀作用所引起的[16,24].经过巯基乙胺改性之后,蛭石的孔径变小,比表面积变大,能够提供更多的吸附位点,吸附能力增大,更有利于吸附的进行.

图2 VER和MEA-VER的N2吸附-脱附曲线Fig.2 N2 adsorption-desorption curves of VER and MEA-VER

图3 VER和MEA-VER的孔径分布Fig.3 Pore size distribution of VER and MEA-VER

表1 VER和MEA-VER的孔结构及比表面积信息Table 1 Structure information of VER and MEA-VER
2.3 热重分析(TG-DSC)
图4显示了VER和MEA-VER的热重-差示扫描量热分析谱图.在 VER的图中,在温度为50~200℃范围内,失重率为4.46%,这主要是层间水分子丢失引起的,表现为 120℃处有一个明显的吸收峰,这表明层间水分子是通过氢键作用与层板连接在一起的.在500~850℃范围内,失重率为2.19%,这主要是羟基的缩和脱水.在 850~1000℃范围内,失重率为 1.61%,这主要是形成了新的物相-顽火辉石[25].根据 Poyato等[26]的研究,当温度超过1100
℃除了会形成顽火辉石外还会形成尖晶石.
MEA-VER的失重行为与VER有较大区别,主要表现在200~300℃以及300~500℃的失重过程.这主要是因为经过巯基乙胺改性之后引入了-NH2和-SH.MEA-VER的吸热曲线并没有太大的变化,只是层间水分子的特征吸收峰有所减弱,这可能是经过巯基乙胺改性后扰乱了层间水分子的有序排列[27].
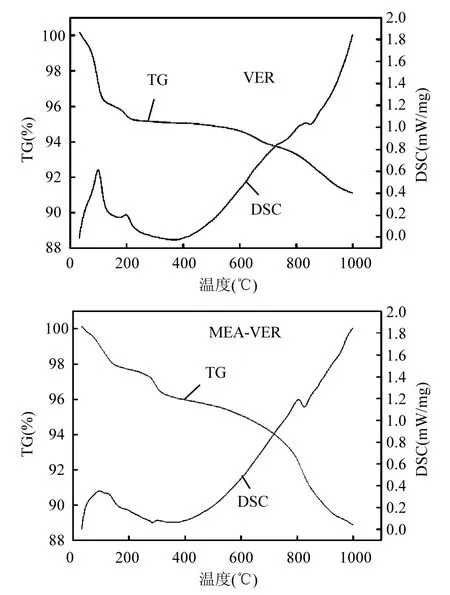
图4 VER和MEA-VER的热重-差示扫描量热分析谱Fig.4 TG-DSC curves of VER and MEA-VER
2.4 时间对吸附的影响
在Ag+初始浓度为120mg/L,初始pH值为6,吸附剂量为4g/L的条件下,研究了时间对Ag+去除效率的影响.如图 5所示,随着吸附时间的增加,Ag+的去除率增大,在200min左右达到最大去除率;如果再增加吸附时间,Ag+的去除率并没有明显的增大.所以,200min为最佳的吸附时间.MEA-VER对 Ag+的去除率要明显的高于VER,当吸附达到平衡时,MEA-VER的去除效率约为 70%,而VER仅只有23%左右.这表明经过巯基乙胺改性后能够提高蛭石对Ag+的去除率.

图5 反应时间对Ag+吸附的影响Fig.5 Effect of contact time of Ag+ adsorption on VER and MEA-VER
2.5 初始pH值对吸附的影响
溶液的初始pH值能够影响吸附剂和吸附质的表面电荷,对金属离子的去除率有很大的影响,同时研究 pH值的影响,也能进一步研究其吸附机理[16].因此,在Ag+初始浓度为120mg/L,吸附剂量为4g/L,接触时间为200min的条件下研究pH值在1~12范围内波动时,其对Ag+吸附效率的影响.如图 6所示,在较低的 pH 值范围内,MEAVER和VER对Ag+的去除效率偏低,这主要是金属离子之间、金属离子与 H+之间的静电排斥作用以及 H+对蛭石表面吸附位点竞争作用.随着pH 值的增大,H+的竞争作用减弱,蛭石表面的负电荷密度增大,表面的吸附位点去质子化,从而增强了 Ag+和吸附位点间的电荷吸附作用[28].在整个pH值范围内,MEA-VER对Ag+的去除率明显比 VER要好,这主要有两个方面的原因,一是改性后蛭石表面的负电荷增多,提供了更多的吸附位点;二是经过巯基乙胺改性后在蛭石表面引入了-NH2和-SH,与溶液中Ag+形成配位吸附[29].

图6 pH值对去除率的影响Fig.6 Effect of pH on adsorption capacities
2.6 吸附剂量对吸附的影响
在Ag+初始浓度为120mg/L,pH值为6,反应时间为200min条件下研究吸附剂量对吸附的影响.如图 7所示,吸附剂浓度在 0~4g/L 范围内时,Ag+的去除率明显增大.当吸附剂浓度超过4g/L时,去除效率没有明显的变化.出现这种趋势是因为随着吸附剂量的增大,提供的吸附位点增多,从而快速提高了 Ag+的去除率;但当继续增大吸附剂量时,溶液中 Ag+的浓度降低,去除率缓慢增加直至保持平衡.
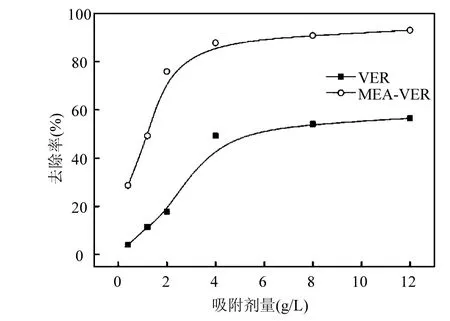
图7 吸附剂量对吸附的影响Fig.7 Effect of adsorbent dosage on the adsorption capacities
2.7 体系中共存阳离子对吸附的影响
本实验探讨了当溶液中存在 Na+和 Ca2+时,其对VER和MEA-VER吸附Ag+的影响.如图8所示,共存阳离子对 Ag+的吸附产生较大影响,随着离子强度的增加,Ag+的去除率降低.其中 Ca2+的存在对Ag+吸附的抑制作用要明显强于K+,这与离子所带电荷有关,离子所带电荷越多,其对Ag+产生的电荷竞争越强,对 Ag+吸附的抑制作用也越强,这表面电荷吸附是MEA-VER和VER吸附Ag+的一种作用机理.

图8 离子强度对吸附的影响Fig.8 Effect of coexisting cations on adsorption capacities
2.8 等温吸附模型
等温吸附模型可以用来描述吸附剂的表面性质以及吸附能力.本文选择Langmuir和Freundlich模型来描述初始浓度在 2~1000mg/L范围内,吸附平衡时吸附剂与吸附质之间的关系.Langmuir等温吸附模型假设吸附剂表面性质均一,各处吸附能相等的单分子层吸附.其表达是如下:

式中:qe为平衡吸附量,mg/g;Ce为平衡浓度,mg/L;qm为饱和吸附量,mg/g;KL为常数.
Freundlich等温吸附模型适用于吸附剂表面不均匀的多层吸附.其表达式如下:

式中:qe为平衡吸附量,mg/g;Ce为平衡浓度mg/L;KF和 n为常数,分别与吸附容量和吸附剂-吸附质间的吸引力有关.
图9和表2分别为Langmuir和Freundlich等温吸附模型的拟合图和拟合数据.由表 2可知Langmuir的拟合效果比 Freundlich好.这表明Ag+在VER和MEA-VER上的吸附属于单层吸附[30].由图 9可知,经过巯基乙胺改性之后,蛭石的吸附能力得到较大的提高,其最大吸附量由104.64mg/L变成 120.65mg/L.这表明,经过巯基乙胺改性后的蛭石能够作为一种良好的吸附剂来去除废液中的Ag+.

图9 等温吸附模型拟合Fig.9 Adsorption isotherms of Ag+ on VER and MEA-VER

Langmuir Freundlich样品 KL(L/mg)(mg/g) R2 n KF(L/g) R2 qm VER MEA-VER 0.0014 0.0187 104.64 120.65 0.9906 0.9616 1.5383 4.5213 0.8306 23.7704 0.936 0.8989

表3 吸附动力学拟合方程Table 3 Kinetic parameters for Ag+ adsorption on VER and MEA-VER
2.9 吸附动力学模型
本文选用准一级动力学模型和准二级动力学模型来分析吸附过程中吸附速率的大小以及反映平衡时间.
准一级动力学模型方程如下:
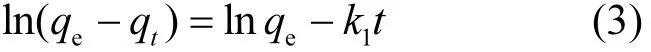
式中:qe指平衡时的吸附量mg/g;qt指反应时间为t时的吸附量mg/g;k1准一级动力学的速率常数.
通过ln(qe-qt)与t的变化关系,对数据进行拟合,得到理论qe、k1与相关系数R2.如表3所示,R2值较低,且理论饱和吸附量与实际饱和吸附量相差较大,所以准一级动力学不适合 VER和MEA-VER对Ag+的吸附过程.
准二级动力学模型方程如下:

式中:qe指平衡时的吸附量 mg/g;qt指反应时间为t时的吸附量mg/g;k2代表准二级动力学的速率常数.
通过t/qt与t的变化关系,对数据进行拟合,如图10所示.经分析得到理论qe、k2与相关系数R2.如表3所示,VER和MEA-VER的相关系数R2分别达到0.997和0.998,且理论饱和吸附量与实际饱和吸附量相近,所以准二级动力学方程能够很好地解释VER与MEA-VER对Ag+的吸附过程.其中K值是反应过程的速率常数,由表3可知,经过巯基乙胺改性后,蛭石的吸附速率得到大大的提高.
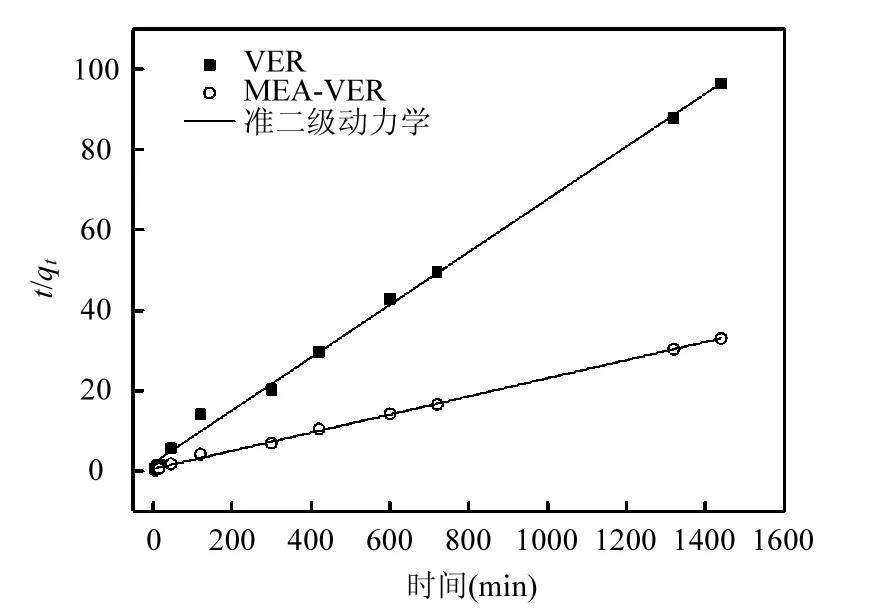
图10 VER和MEA-VER对Ag+吸附的准二级动力学模型Fig.10 Pseudo-second-order kinetic obtained for the adsorption of Ag+ onto VER and MEA-VER
3 结论
3.1 经过巯基乙胺改性后,蛭石的比表面积和微孔体积增大,这为吸附过程提供了更多的吸附位点,提高了蛭石的吸附能力.
3.2 Langmuir等温吸附模型和 Pseudo-secondorder动力学模型能够很好地解释 VER和MEA-VER对Ag+的吸附过程.经过巯基乙胺改性后,蛭石的吸附能力得到大大提高,吸附速率变快.
3.3 VER和MEA-VER对Ag+的吸附机理主要是电荷吸附和配位吸附.
[1]Ansari R, Delavar A F. Application of poly 3-methylthiophene for removal of silver ion from aqueous solutions [J]. Journal of Applied Polymer Science, 2009,113(4):2293-2300.
[2]滕 应,黄昌勇,龙 健.铅锌银尾矿污染区土壤酶活性研究 [J].中国环境科学, 2002,22(6):551-555.
[3]Manos M J, Malliakas C D. Heavy-metal-ion capture, ionexchange, and exceptional acid stability of the open-framework chalcogenide (NH4) (4) In12Se20 [J]. Chemistry-a European Journal, 2007,13(1):51-58.
[4]Pollet B, Lorimer J P. Sonoelectrochemical recovery of silver from photographic processing solutions [J]. Ultrasonics Sonochemistry, 2000,7(2):69-76.
[5]Park S Y, Chung J W. Covalent assembly of metal nanoparticles on cellulose fabric and its antimicrobial activity [J]. Cellulose,2012,19(6):2141-2151.
[6]刘 云,吴平霄.柱撑蛭石吸附去除废水中重金属离子的实验研究 [J]. 矿物岩石, 2006,(04):8-13.
[7]周建兵,吴平霄.十二烷基磺酸钠(SDS)改性蒙脱石对Cu2+、Cd2+的吸附研究 [J]. 环境科学学报, 2010,30(01):88-96.
[8]Yan L, Shan X. Adsorption of cadmium onto Al-13-pillared acid-activated montmorillonite [J]. Journal of Hazardous Materials, 2008,156(1-3):499-508.
[9]李坤权,杨美蓉,王燕锦,等.新型胺化介孔炭的制备及其对Pb(II)的吸附 [J]. 中国环境科学, 2014,34(8):1985-1992.
[10]秦泽敏,董黎明,刘 平,等.零价纳米铁吸附去除水中六价铬的研究 [J]. 中国环境科学, 2014,34(12):3106-3111.
[11]鲍艳宇,周启星,万 莹,等.3种四环素类抗生素在褐土上的吸附和解吸 [J]. 中国环境科学, 2010,30(10):1383-1388.
[12]Bailey S E , Olin T J. A review of potentially low-cost sorbents for heavy metals [J]. Water Research, 1999,33(11):2469-2479.
[13]陈天虎,汪家权.蒙脱石粘土改性吸附剂处理印染废水实验研究[J]. 中国环境科学, 1996,16(1):60-63.
[14]吴平霄.有机插层蛭石功能材料的制备与表征研究 [J]. 功能材料, 2003,(06):728-731.
[15]Sari A, Tuzen M. Adsorption of silver from aqueous solution onto raw vermiculite and manganese oxide-modified vermiculite [J].Microporous and Mesoporous Materials, 2013,170:155-163.
[16]Long H, Wu P. Efficient removal of cesium from aqueous solution with vermiculite of enhanced adsorption property through surface modification by ethylamine [J]. Journal of Colloid and Interface Science, 2014,428:295-301.
[17]Long H, Wu P. Evaluation of Cs+removal from aqueous solution by adsorption on ethylamine-modified montmorillonite [J].Chemical Engineering Journal, 2013,225:237-244.
[18]Yu X, Wei C. Development of organovermiculite-based adsorbent for removing anionic dye from aqueous solution [J]. Journal of Hazardous Materials, 2010,180(1–3):499-507.
[19]Yu X, Wei C. Preparation of trimethylchlorosilane-modified acid vermiculites for removing diethyl phthalate from water [J].Journal of Colloid and Interface Science, 2012,369(1):344-351.
[20]Wu P, Dai Y. Characterization of organo-montmorillonites and comparison for Sr(II) removal: Equilibrium and kinetic studies [J].Chemical Engineering Journal, 2012,191(0):288-296.
[21]Li Z, Jiang W. An FTIR investigation of hexadecyltrimethylammonium intercalation into rectorite [J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2008,71(4):1525-1534.
[22]Celis R, Hermosin M C. Heavy metal adsorption by functionalized clays [J]. Environmental Science & Technology,2000,34(21):4593-4599.
[23]Valente J, Tzompantzi F. Adsorption and photocatalytic degradation of phenol and 2,4dichlorophenoxiacetic acid by Mg-Zn-Al layered double hydroxides [J]. Applied Catalysis B-Environmental, 2009,90(3/4):330-338.
[24]代亚平,吴平霄.氨丙基三乙氧基硅烷改性蒙脱石的表征及其对Sr(Ⅱ)的吸附研究 [J]. 环境科学学报, 2012,32(10):2402-2407.
[25]Liu Y, Xiao D. Kinetics and thermodynamics of lead (II)adsorption on vermiculite [J]. Separation Science and Technology,2007,42(1):185-202.
[26]Poyato J, Perez-Maqueda L A. Effect of Na+ and NH4+ cations on microstructure changes of natural vermiculite during heat treatment [J].Journal of Thermal Analysis and Calorimetry, 2002,67(1):73-82.
[27]Wang Y, Wu P. In-depth study on intercalating threonine into layered double hydroxides [J]. Applied Clay Science, 2011,53(4):615-20.
[28]Alkan M, Karadas M. Adsorption of CTAB onto perlite samples from aqueous solutions [J]. Journal of Colloid and Interface Science, 2005,291(2):309-318.
[29]Mountford A, Campi E M. N type Smiles rearrangement of the aminoethanethiol moiety attached to heterocyclic compounds [J].Tetrahedron, 2010,66(19):3452-3456.
[30]Tan I, Ahmad A. Adsorption isotherms, kinetics, thermodynamics and desorption studies of 2, 4, 6-trichlorophenol on oil palm empty fruit bunch-based activated carbon [J]. Journal of Hazardous Materials, 2009,164(2/3):473-482.

