西瓜ClPDF2.1蛋白的原核表达及其对香蕉枯萎病菌的抑制活性测定
张继友 景晓辉 吴伦英 刘国道

摘 要 尖孢镰刀菌古巴专化型侵染香蕉引起的香蕉枯萎病严重危害中国香蕉产业。植物防卫素是一类小的富含半胱氨酸的抗真菌蛋白。本研究旨在了解西瓜(Citrullus lanatus)防卫素蛋白ClPDF2.1对香蕉枯萎病菌的抑制活性。提取西瓜RNA后反转录为cDNA,以西瓜cDNA为模板,克隆ClPDF2.1基因,将测序正确的ClPDF2.1连接到载体pGEX-6P-1,随后转化Trans BL21(DE3)pLysS,IPTG 诱导GST-ClPDF2.1融合蛋白表达16 h后,经SDS-PAGE电泳及Western blot鉴定GST-ClPDF2.1融合蛋白的表达,进行GST-ClPDF2.1融合蛋白体外抑制香蕉枯萎病菌生长的功能初探。本研究为进一步培育转基因香蕉抗病品种奠定基础。
关键词 西瓜防卫素基因ClPDF2.1;原核表达;抗真菌活性;香蕉枯萎病菌
中图分类号 S651 文献标识码 A
Abstract Banana wilt disease, caused by the pathogenic fungus Fusarium oxysporum f. sp. cubense 4(Foc 4), is regarded as one of the mostserious threat to banana production. Plant defensins are cysteine-rich innate anti-microbial proteins that play an important role in plant disease resistance, particularly to fungal diseases. In this paper, watermelon defensin ClPDF2.1 cDNA sequences were cloned and then inserted into vector pGEX-6P-1 with glutathione-S-transferase(GST)tag to construct the prokaryotic expression plasmid. The recombinant plasmids pGEX-6P-1-ClPDF2.1 were transformed into Trans BL21(DE3)pLysS and expressed in the prokaryotic expression system. Results of SDS-PAGE and western blot after Glutathione Sepharose 4B affinity chromatography purification, showed that the specific fusion protein was successfully constructed and expressed after IPTG induction. The antifungal activity of watermelon defensins proteins ClPDF2.1 against Foc 4 growth indicated that ClPDF2.1 could decrease Foc 4 hypha growth by 81.7% at eighty micromolar concentration. This study showed that ClPDF2.1 could be a potential resistance gene for controlling banana Fusarium wilt disease.
Key words Watermelon defensin gene ClPDF2.1; Prokaryotic expression; Antifungal activity; Fusarium oxysporum f. sp. cubense 4
香蕉是中国重要的热带水果,然而随着香蕉枯萎病(Fusarium wilt disease)在包括海南、广东在内的多个省份不断蔓延的同时,香蕉种植面积不断减少,香蕉产业遭受了严重的打击[1]。香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum Schlecht f. sp. cubense WC Snyder & HN Hans, Foc)侵染香蕉后引起的一种典型维管束病害[2]。香蕉枯萎病菌4号生理小种(Foc 4)能侵染包括Cavendish在内的几乎所有香蕉品种,截至目前仍无有效的防治措施[2]。目前关于香蕉枯萎病的研究主要集中在拮抗菌株的筛选[3]和枯萎病菌致病相关基因的克隆[4]等方面,而对于源自香蕉或其它植物的香蕉枯萎病抗性基因挖掘不多。
植物防卫素是一类小的富含半胱氨酸的抗真菌蛋白,被认为对动植物无毒[5]。通过人工合成、原核表达或转基因育种,多个植物防卫素对多种植物病害的防控起到显著作用[5]。然而,截至目前,研究较为清楚的植物防卫素种类不多,主要包括RsAFP2、MsDef1、MtDef4、NaD1[5],其中NaD1以二聚体的形式发挥对尖孢镰刀菌的抗性[6]。本团队前期研究表明苜蓿MtDef4能够抑制橡胶多主棒孢病菌(Corynespora cassiicola)生长而不能抑制橡胶胶孢炭疽菌(Collectotrichum gloeosporioides)的生长[7]。2013年,张曼等[8]从西瓜中克隆出西瓜防卫素基因ClPDF2.1,发现其表达受到外源植物激素水杨酸(Salicylic Acid)、茉莉酸甲酯(methyl jasmonate)、乙烯利(ethephon)和西瓜枯萎病菌的诱导。本研究拟利用原核表达技术体外纯化ClPDF2.1,研究其对香蕉枯萎病菌生长的抑制能力,为将来通过转基因技术培育抗病香蕉品种提供潜在候选基因。
1 材料与方法
1.1 材料
1.1.1 试验材料 西瓜种子由中国热带农业科学院品种资源研究所提供,播种于温室。原核表达载体pGEX-6P-1购自GE Healthcare Life Sciences,大肠杆菌菌株E. coli Trans 5α、原核表达菌株Trans BL21(DE3)pLysS化学感受态细胞购自北京全式金生物技术有限公司。香蕉枯萎病菌4号生理小种菌株B2(Foc B2)由中国热带农业科学院环境与植物保护研究所黄俊生研究员提供。
1.1.2 试剂 植物总RNA提取试剂盒、TIANScriptⅡcDNA第一链合成试剂盒、DNA产物纯化和胶回收试剂盒以及质粒提取试剂盒购自北京天根生化科技有限公司;限制性内切酶、T4 DNA连接酶购自Invitrogen公司;TransStart FastPfu DNA Polymerase、anti-GST抗体购自北京全式金生物技术有限公司;Bradford 蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司;马铃薯葡萄糖琼脂(PDA)培养基购买自环凯微生物科技,其它试剂均为国产分析纯。
1.2 方法
1.2.1 ClPDF2.1基因克隆 利用植物总RNA提取试剂盒提取西瓜叶片RNA,利用TIANScriptⅡcDNA第一链合成试剂盒将西瓜RNA反转录为cDNA用于随后的ClPDF2.1基因克隆。
根据报道的ClPDF2.1开放阅读框序列[7],设计带有酶切位点的引物ClPDF2.1-F:CACGAATTCAT
GAAGTTCTTTTCCGCTGC;ClPDF2.1-RATACTCGAG
TCAAACGCAGTGCTTTGTG。PCR程序:95 ℃预变性3 min;95 ℃ 20 s,50 ℃ 20 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。经 1.5%琼脂糖凝胶电泳检测PCR条带大小。
1.2.2 原核表达载体的构建 利用EcoRI和XhoI对PCR扩增的ClPDF2.1基因和带有GST标签的pGEX-6P-1载体双酶切,电泳后按照胶回收试剂盒说明书的步骤切胶回收ClPDF2.1基因(225 bp)和pGEX-6P-1载体。在10 μL连接体系中加入如下组分:1 μL 酶切后的pGEX-6P-1载体+8 μl ClPDF2.1基因片段+1 μL T4 连接酶缓冲液+1 μL T4连接酶。23 ℃连接5 h后全部用于转化Trans 5α蓝白斑筛选,在氨苄抗性的LB平板上挑取白色菌落,进行菌落PCR初步鉴定阳性克隆后用EcoRI和XhoI双酶切鉴定后再交由上海生工测序。将测序正确的质粒pGEX-6P-1-ClPDF2.1转化Trans BL21(DE3)pLysS,得到GST-ClPDF2.1。GST为阴性对照。
1.2.3 重组质粒在大肠杆菌中的诱导表达及western blot检测 挑取测序正确的GST-ClPDF2.1单克隆接种到4 mL 氨苄抗性的LB培养基中(氨苄终浓度为50 μmmol),200 r/min 转速下37 ℃过夜培养,随后将菌液以1 ∶ 100的比例加入到400 mL 氨苄抗性的LB培养基中,继续振荡培养至菌液OD600=0.6左右,加入终浓度为1 mmol的IPTG,在16 ℃条件下继续培养8 h诱导GST融合蛋白的表达,4 000 r/min离心10 min收集菌体,用PBS缓冲液将沉淀悬起,经超声破碎细胞后(20 mL裂解体系,400~600 W,超声3 s,暂停3 s,时间约15 min),13 000 r/min离心10 min,上清于-80 ℃保存备用。pGEX-6P-1为阴性对照。
分别取10 μL稀释100倍的GST-ClPDF2.1和GST上清液,加入2 μL 5×SDS loading buffer,轻轻颠倒混匀,100 ℃沸水浴煮5 min变性蛋白,用于后续的SDS-PAGE电泳(5%浓缩胶,12%分离胶)。电泳结束后利用Bio-Rad湿转仪将GST-ClPDF2.1蛋白转至PVDF膜上,5%脱脂牛奶室温封闭1 h后,用Anti-GST抗体4 ℃孵育2 h,TBST缓冲液洗掉未与靶蛋白结合的Anti-GST(重复洗脱3次),加入二抗室温孵育1 h,TBST缓冲液洗掉未结合的二抗(重复洗脱3次)。按照ECL发光试剂盒(GE Healthcare)说明书步骤检测GST-ClPDF2.1和GST蛋白的表达。
1.2.4 GST-ClPDF2.1融合蛋白的纯化 取出-80 ℃保存的GST-ClPDF2.1融合蛋白(30 mL),加入1 mL经预冷的PBS缓冲液处理的GST Agarose Beads,4 ℃冰箱反复颠倒混匀1 h(促进GST-ClPDF2.1与GST Agarose Beads结合),2 000×g 4 ℃条件下离心3 min后弃上清,20 mL预冷的PBS缓冲液反复清洗GST Agarose Beads,重复2次(洗净未与树脂结合的杂蛋白)。加入1 mL GST Elution Buffer,轻轻颠倒混匀10 min左右竞争洗脱GST-ClPDF2.1。GST为对照。利用Bradford蛋白质定量检测试剂盒测定纯化的GST和GST-ClPDF2.1融合蛋白浓度。
1.2.5 GST-ClPDF2.1融合蛋白对香蕉枯萎病菌体外抑菌活性检测 配制含80 μmol GST-ClPDF2.1的PDA培养基(4.01 g PDA粉末溶于100 mL无菌水中),用打孔器(10 mm)打取香蕉枯萎病菌Foc B2菌块放置于PDA平板中央,28 ℃黑暗条件下培养4 d后观察GST-ClPDF2.1对Foc B2生长的抑制情况。含相同浓度GST的PDA培养基接种Foc B2为对照,每个处理重复3次。
2 结果与分析
2.1 原核表达载体pGEX-6P-1-ClPDF2.1的构建及鉴定
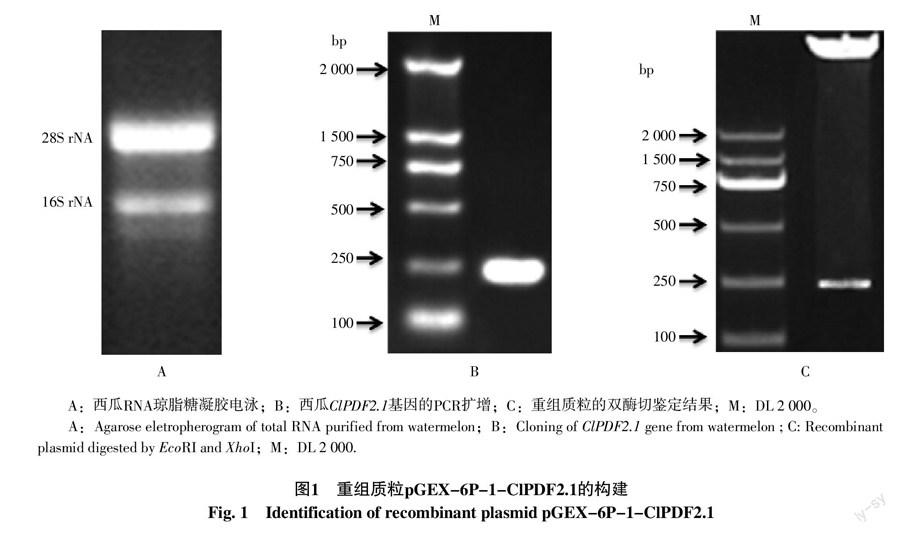
笔者提取出高质量的西瓜叶片RNA,其中28S rRNA亮度约为16S rRNA的2倍(图1-A)。以西瓜cDNA为模板,用带有酶切位点的ClPDF2.1引物进行PCR扩增,得到ClPDF2.1基因编码区(图1-B)。采用菌落PCR鉴定阳性克隆,经双酶切后得到一条约250 bp的条带(图1-C),与预期ClPDF2.1大小一致,再经上海生工测序,笔者成功构建原核表达载体pGEX-6P-1-ClPDF2.1。
2.2 GST-ClPDF2.1融合蛋白的诱导
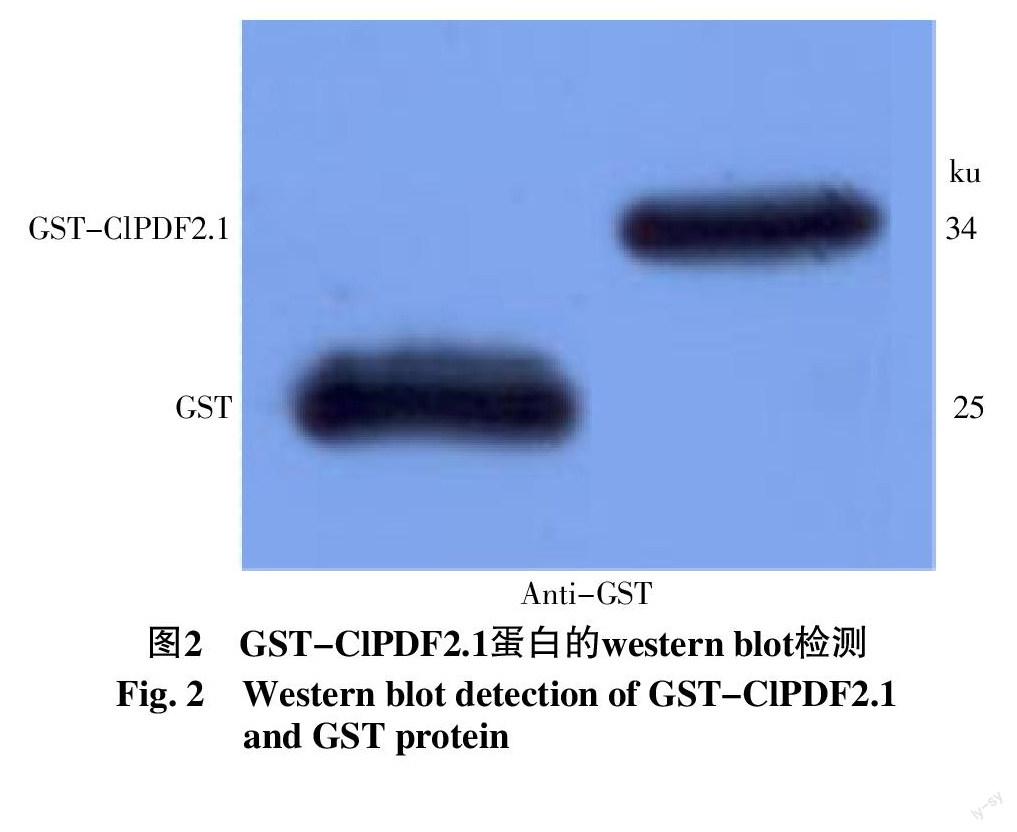
重组质粒pGEX-6P-1-ClPDF2.1转化大肠杆菌原核表达菌株Trans BL21(DE3)pLysS后,用IPTG诱导重组蛋白的表达,进行SDS-PAGE电泳,随后的Anti-GST进行western-blot检测。笔者发现利用Trans BL21(DE3)pLysS菌株可大量诱导25 ku的GST和34 ku的GST-ClPDF2.1(图2)。
GST Agarose Beads进一步纯化GST和GST-ClPDF2.1后,利用Bradford蛋白质定量检测试剂盒测定蛋白浓度,将GST和GST-ClPDF2.1终浓度调整为1 mmol。
2.3 GST-ClPDF2.1融合蛋白对香蕉枯萎病菌体外抑菌活性检测
在含有相同浓度GST和GST-ClPDF2.1的PDA培养基上,接种10 mm香蕉枯萎病菌菌块,28 ℃黑暗条件下培养4 d后笔者发现:在含有80 μmoL GST的PDA平板上,香蕉枯萎病菌生长正常,菌落直径达到6 cm(表1);在含有80 μmol GST-ClPDF2.1的PDA平板上,香蕉枯萎病菌几乎没有任何生长,菌落直径为1.1 cm(表1)。ClPDF2.1抑制香蕉枯萎病生长率达到81.7%(图3),这说明ClPDF2.1具有较大的潜力成为将来香蕉枯萎病抗性基因。
3 讨论与结论
植物防卫素(defensins)又名植物抗微生物蛋白(plant antimicrobial proteins, AMPs),指的是一类广泛分布于自然界多种植物抗真菌蛋白[9]。体外的抑菌活性以及防卫素的广泛分布性表明其可能在植物对病原菌抗性中发挥重要作用[10]。植物防卫素很可能通过靶向真菌细胞膜鞘脂类受体进而发挥功能[5]。景晓辉等[7]发现GST-MtDef4融合蛋白能够抑制多主棒孢病菌生长,抑菌率达到60%。Gaspar等[11]发现棉花过表达植物防卫素NaD1后获得对尖孢镰刀菌显著抗性的转基因棉。Kong等[12]在烟草和马铃薯体内利用根特异启动子驱动山葵防卫素(Wasabi defensin)基因表达,获得了对尖孢镰刀菌显著抗性的转基因植株。
近年来关于香蕉枯萎病的报道主要集中于枯萎病菌的real time PCR检测[13-15],利用生物有机肥[16]、内生细菌[17]防控香蕉枯萎病。然而上述措施难以从根本上消除枯萎病菌对香蕉产业造成的影响。2014年Ghag等[18]利用农杆菌介导的遗传转化技术在香蕉中过表达鹅肠草(Stellaria media)防卫素基因Sm-AMP-D1,结果发现转基因香蕉对香蕉枯萎病1号生理小种(Fusarium oxysporum f. sp. cubense race 1)具有明显的抗性,然而Sm-AMP-D1能否防控香蕉枯萎病菌4号生理小种有待进一步研究。
本研究发现ClPDF2.1与GST标签蛋白融合后能够正确表达,未形成难以纯化的包涵体。体外抑菌实验表明ClPDF2.1几乎完全抑制香蕉枯萎病菌的生长。虽然现阶段笔者并不清楚ClPDF2.1的作用机理,参考其他植物防卫素抑制真菌生长的作用机制,笔者推测可能是由于ClPDF2.1能够特异与香蕉枯萎病菌细胞膜存在的鞘脂互作,进而导致ClPDF2.1进入香蕉枯萎病菌细胞抑制菌丝的生长。考虑到香蕉的主要实用部分为果实,而香蕉枯萎病菌为土传病害,主要从香蕉幼苗根系侵染香蕉,在将来培育转基因抗病香蕉时,可借助香蕉根特异启动子来驱动ClPDF2.1在根部特异表达,以期最终获得抗香蕉枯萎病菌转基因香蕉。
参考文献
[1] 孙 勇, 曾会才, 彭 明, 等. 香蕉枯萎病致病分子机理与防治研究进展[J]. 热带作物学报, 2012, 33(4): 759-766.
[2] Guo L J, Han L J, Yang L Y, et al. Genome and transcriptome analysis of the fungal pathogen Fusarium oxysporum f. sp cubense causing banana vascular wilt disease[J]. PLoS One, 2014, 9 (4): e73 945.
[3] 殷晓敏, 郑服丛, 贺春萍, 等. 枯草芽孢杆菌B215生物学特性及对香蕉枯萎病的生防效果评价[J]. 热带作物学报, 2010, 31(8): 1 416-1 419.
[4] 郭立佳, 杨腊英, 彭 军, 等. 香蕉枯萎病病原菌Six同源基因的鉴定[J]. 热带作物学报, 2013, 34(12): 2 391-2 396.
[5] Vriens K, Cammue B P A, Thevissen K. Antifungal plant defensins: mechanisms of action and production[J]. Molecules, 2014, 19 (8): 12 280-12 303.
[6] Lay F T, Mills G D, Poon I K H, et al. Dimerization of plant defensin NaD1 enhances its antifungal activity[J]. J Biol Chem, 2012, 287(24): 19 961-19 972.
[7] 景晓辉, 吴伦英, 沈 雁, 等. GST-MtDef4融合蛋白的原核表达及体外抑菌活性的检测[J]. 热带作物学报, 2014, 35(4):718-723.
[8] 张 曼, 羊杏平, 王薇薇, 等. 西瓜防御素基因ClPDF2.1的克隆及表达分析[J]. 西北植物学报, 2013, 33(5): 872-877.
[9] Carvalho A D, Gomes V M. Plant defensins and defensin-like peptides-biological activities and biotechnological applications[J]. Curr Pharm Design, 2011, 17(38): 4 270-4 293.
[10] De Coninck B, Cammue B P A, Thevissen K. Modes of antifungal action and in planta functions of plant defensins and defensin-like peptides[J]. Fungal Biol Rev, 2013, 26(4): 109-120.
[11] Gaspar Y M, McKenna J A, McGinness B S, et al. Field resistance to Fusarium oxysporum and Verticillium dahliae in transgenic cotton expressing the plant defensin NaD1[J]. J Exp Bot, 2014, 65(6): 1 541-1 550.
[12] Kong K, Ntui V O, Makabe S, et al. Transgenic tobacco and tomato plants expressing Wasabi defensin genes driven by root-specific LjNRT2 and AtNRT2.1 promoters confer resistance against Fusarium oxysporum[J]. Plant Biotechnol, 2014, 31(2): 89-96.
[13] Peng J, Zhang H, Chen F P, et al. Rapid and quantitative detection of Fusarium oxysporum f. sp cubense race 4 in soil by real-time fluorescence loop-mediated isothermal amplification[J]. J Appl Microbiol, 2014, 117(6): 1 740-1 749.
[14] Yang L L, Sun LX, Ruan X L, et al. Development of a single-tube duplex real-time fluorescence method for the rapid quantitative detection of Fusarium oxysporum f. sp cubense race 1(Foc 1)and race 4(Foc 4)using TaqMan probes[J]. Crop Prot, 2015, 68: 27-35.
[15] Zhang X, Zhang H, Pu J J, et al. Development of a real-time fluorescence loop-mediated isothermal amplification assay for rapid and quantitative detection of Fusarium oxysporum f. sp cubense tropical race 4 in soil[J]. PLoS One, 2013, 8(12): e82 841.
[16] Zhang N, He X, Zhang J, et al. Suppression of Fusarium wilt of banana with application of bio-organic fertilizers[J]. Pedosphere, 2014, 24(5): 613-624.
[17] Ho Y N, Chiang H M, Chao C P, et al. Hsieh, C.C. Huang, In planta biocontrol of soilborne Fusarium wilt of banana through a plant endophytic bacterium, Burkholderia cenocepacia 869T2[J]. Plant and Soil, 2015, 387(1-2): 295-306.
[18] Ghag S B, Shekhawat U K S, Ganapathi T R. Transgenic banana plants expressing a Stellaria media defensin gene(Sm-AMP-D1) demonstrate improved resistance to Fusarium oxysporum[J]. Plant Cell Tissue Organ Cult, 2014, 119(2): 247-255.

