小探头内镜超声对早期胃癌浸润深度的诊断价值
姚方,杨爱明,伍东升,吴晰,郭涛,周炜洵,陆星华
中国医学科学院北京协和医学院北京协和医院1消化内科2病理科,北京100730
小探头内镜超声对早期胃癌浸润深度的诊断价值
姚方1,杨爱明1,伍东升1,吴晰1,郭涛1,周炜洵2,陆星华1
中国医学科学院北京协和医学院北京协和医院1消化内科2病理科,北京100730
目的评价应用小探头内镜超声 (endoscopic ultrasonography,EUS)对早期胃癌浸润深度的诊断价值及影响因素。方法回顾性分析2010年3月至2012年12月于北京协和医院诊治且资料完整的59例早期胃癌患者资料,患者在内镜治疗或手术治疗前均接受小探头EUS检查并判断病变浸润深度,最终以内镜/手术病理结果为金标准,评价EUS对早期胃癌浸润深度诊断的敏感性、特异性和准确性,并分析影响EUS判断准确性的病变自身内镜特点及病理学因素。结果EUS判断早期胃癌病变浸润深度总体病变诊断敏感性为79.7%,特异性为81.4%,准确性为79.7%。其中,EUS诊断黏膜层病变的敏感性为66.1%,特异性为80.0%,准确性为79.7%;诊断黏膜下层病变的敏感性为80.0%,特异性为81.6%,准确性为81.4%,两者之间差异无统计学意义 (P>0.05)。EUS判断胃癌病变过高分级比例为16.9%,以胃上1/3 (20.0%)和中1/3(27.3%)、大体形态为隆起型 (0-Ⅰ:25.0%,0-Ⅱa:38.5%)以及合并溃疡 (33.3%)的病变更为多见,这类病变诊断的准确性也相应较低。EUS判断胃癌病变过低分级比例为3.4%。结论小探头EUS对于判断早期胃癌浸润深度有较高的准确性,有助于作出适当的治疗决策,病变部位、大体类型及溃疡的存在会影响判断的准确性。
早期胃癌;内镜超声;浸润深度
Med J PUMCH,2015,6(2):83-88
早期胃癌的定义是指局限于黏膜层或黏膜下层的胃癌,无论是否有淋巴结转移[1]。近年来,随着早期胃癌内镜下治疗的开展,对于早期胃癌浸润深度的判断有了更高要求。早期胃癌的内镜下治疗,包括内镜下黏膜切除术 (endoscopic mucosal resection,EMR)和内镜下黏膜下层剥离术 (endoscopic submucosal disection,ESD),对于没有淋巴结转移的早期胃癌患者可以达到根治性切除的目的,相比于传统的外科手术,疗效相当,并具有创伤小、保存胃正常解剖及功能的优点,目前已经作为早期胃癌的标准治疗方案之一[2-5]。早期胃癌的淋巴结转移与其病变的浸润深度有关,日本Gotoda等[2]报道黏膜下层浸润深度在500 μm以内的早期分化型胃癌如果病理证实没有脉管浸润,则淋巴结的转移率为0,该研究组随后的研究发现局限在黏膜层且直径小于2 cm的未分化型腺癌,如果没有脉管浸润,最终淋巴结的转移率也为0[6],意味着这类患者采用内镜治疗完全能够达到根治性切除的目的。因此,准确判断病变的浸润深度对于决定早期胃癌的治疗方式非常重要。
内镜超声 (endoscopic ultrasonography,EUS),尤其是能够清晰地展示胃壁各层结构的高频超声小探头EUS,已经被广泛应用于胃癌的术前分期评价,对所有胃癌的T分期和N分期评价总准确性为78%~92%和63%~78%,对进展期胃癌评价的准确性比早期胃癌更高[7-8]。目前已经有很多研究报道EUS评估早期胃癌浸润深度的准确性,但结果相差较大。目前认为,影响判断准确性的主要因素有:病变部位、病变的内镜特点 (大体形态,是否合并溃疡)、病变大小;另一方面,研究的设计对结果也有较大影响[8-10]。本研究旨在通过回顾性研究,评价小探头EUS对早期胃癌浸润深度的诊断价值,并分析影响其诊断准确性的因素。
资料和方法
资料
2010年3月1日至2012年12月31日于北京协和医院接受诊治的早期胃癌患者共64例,回顾性分析其中资料完整者59例。所有患者经普通内镜或放大色素内镜检查发现病变,活检证实为胃癌,在治疗前接受小探头EUS检查并评估病变浸润深度,之后40例接受ESD,其余19例进行外科手术治疗,ESD及外科手术标本经病理学检查证实为累及黏膜层或黏膜下层的早期胃癌。
研究方法
患者在检查前签署知情同意书,行利多卡因胶浆口咽部局部麻醉后接受EUS检查,检查采用超声高频小探头 (UM-DP12-25R,频率为12 MHz,主机为EUM2000,Olympus,Tokyo,Japan),检查时先观察病变的部位、大体形态及内镜下特点,然后在胃腔内注入200~500 ml不含气水,在内镜直视下将超声小探头通过活检孔道插入达病变上方进行EUS检查,记录清晰的超声图像并判断局部浸润深度,所有检查均由同一组有经验的超声内镜医生完成。
高频超声小探头可以清晰地显示胃壁的五层结构[11],由里向外第一层高回声代表黏膜层 (M层),第二层低回声结构为黏膜肌层 (MM层),第三层高回声结构为黏膜下层 (SM层),第四层低回声结构为固有肌层 (MP层),第五层强回声代表浆膜下及浆膜层 (SS层)(图1)。当低回声病变仅累及第一层和第二层时判断为M层受累,如果累及1~3层则判断为SM层浸润。沿胃长轴将胃分为上、中、下1/3以记录病变的位置,上1/3包括胃底、贲门及胃体的近段1/3,中1/3包括胃体中下1/3及胃角,下1/3包括胃窦及幽门区。病变大体形态根据巴黎分型[12],将早期胃癌分为隆起型 (0-Ⅰ)、平坦型 (0-Ⅱ)和凹陷型(0-Ⅲ),其中0-Ⅱ型根据形态又可以分为表浅隆起型(0-Ⅱa)、平坦型 (0-Ⅱb)和表浅凹陷型 (0-Ⅱc)3个亚型。
统计学处理
分别计算EUS判断M层和SM层浸润的敏感性、特异性及准确性,并用卡方检验对两组进行比较,P<0.05为差异有统计学意义。同时比较不同内镜及病理特点病变EUS诊断的准确性,评价影响EUS准确性的因素。

图1正常胃壁EUS图像
结果
患者临床及病理资料
59例患者中男性39例,女性20例,男∶女为1.95∶1,平均年龄 (62.2±8.4)岁 (43~85岁)。59例患者共发现病变59处,其中位于胃下1/3者最多,中1/3者次之;病变最大直径范围在0.7~5.5 cm之间;大体形态以0-Ⅱc型最多,其次为0-Ⅱa型。病理组织学检查证实大多数局限于M层,分化型腺癌占绝大多数,仅6例为未分化型腺癌或有印戒细胞成分(表1)。
EUS判断早期胃癌病变深度的诊断价值
59例早期胃癌EUS诊断病变深度和病理诊断最终结果比较见表2。早期胃癌EUS诊断M层病变深度的敏感性为 66.1%,特异性为 80.0%,准确性为79.7%,诊断SM层病变的敏感性为80.0%,特异性为81.6%,准确性为81.4%,两组之间差异无统计学意义 (P>0.05);总体病变诊断的敏感性为79.7%,特异性为81.4%,准确性为79.7%。图2示1例早期胃癌EUS确定病变为M层并经病理证实。
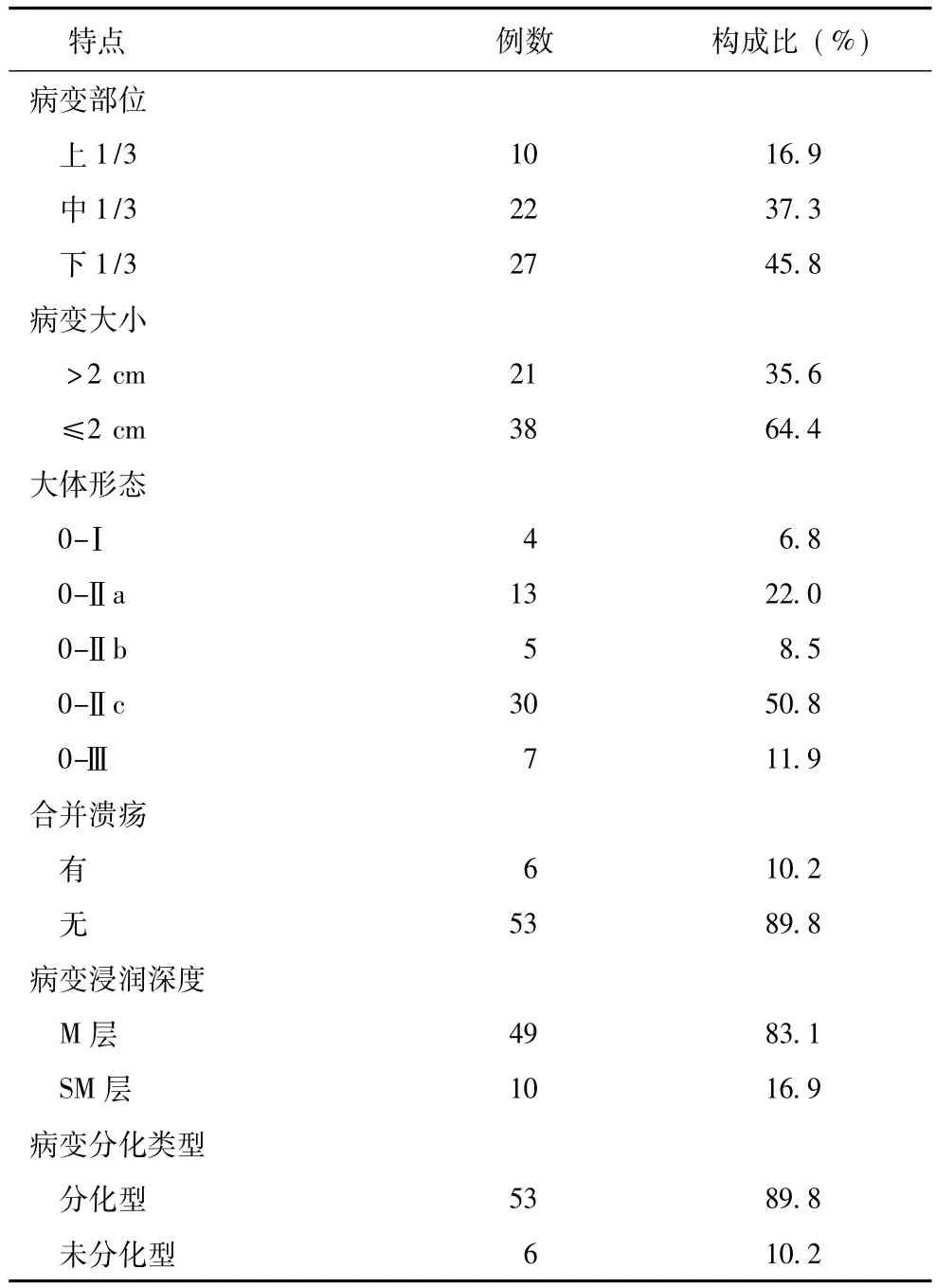
表159例早期胃癌病变的内镜和病理检查特点

表2早期胃癌EUS诊断病变深度和病理最终结果比较
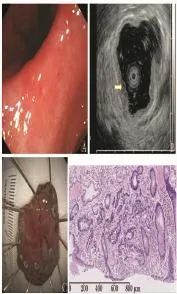
图2早期胃癌EUS正确分级
早期胃癌不同内镜及病理特点下EUS诊断病变深度的准确性见表3,早期胃癌诊断总体准确性为79.7%,位于胃上1/3和中1/3、大体形态为隆起型(0-Ⅰ及0-Ⅱa)以及合并溃疡的病变诊断的准确性相对较低;过高分级的比例为16.9%,位于胃上1/3和中1/3、大体形态为隆起型 (0-Ⅰ及0-Ⅱa)(图3)以及合并溃疡的病变容易过高分级;过低分级的比例为3.4%。
讨论
日本Gotoda[13]提出的早期胃癌内镜下治疗扩大适应证目前已经被广泛接受,包括:(1)黏膜内癌,分化型腺癌,无脉管浸润,无溃疡,病变大小不限; (2)黏膜内癌,分化型腺癌,无脉管浸润,合并溃疡,病变小于3 cm;(3)黏膜下层浅层浸润 (深度小于500 μm),分化型腺癌,无脉管浸润,无溃疡,病变小于3 cm;(4)黏膜内癌,未分化型腺癌,无脉管浸润,无溃疡,病变小于2 cm。此类早期胃癌淋巴结转移率极低,内镜下治疗可以达到治愈性切除的目标,获得与外科手术相近的预后结果,创伤小,操作相对简便,能尽可能保存胃原有的结构及功能。对于超出此类适应证之外的病变,淋巴结转移的比例大大增加,单纯的内镜切除常常不能达到根除胃癌的目的,需要追加外科手术。
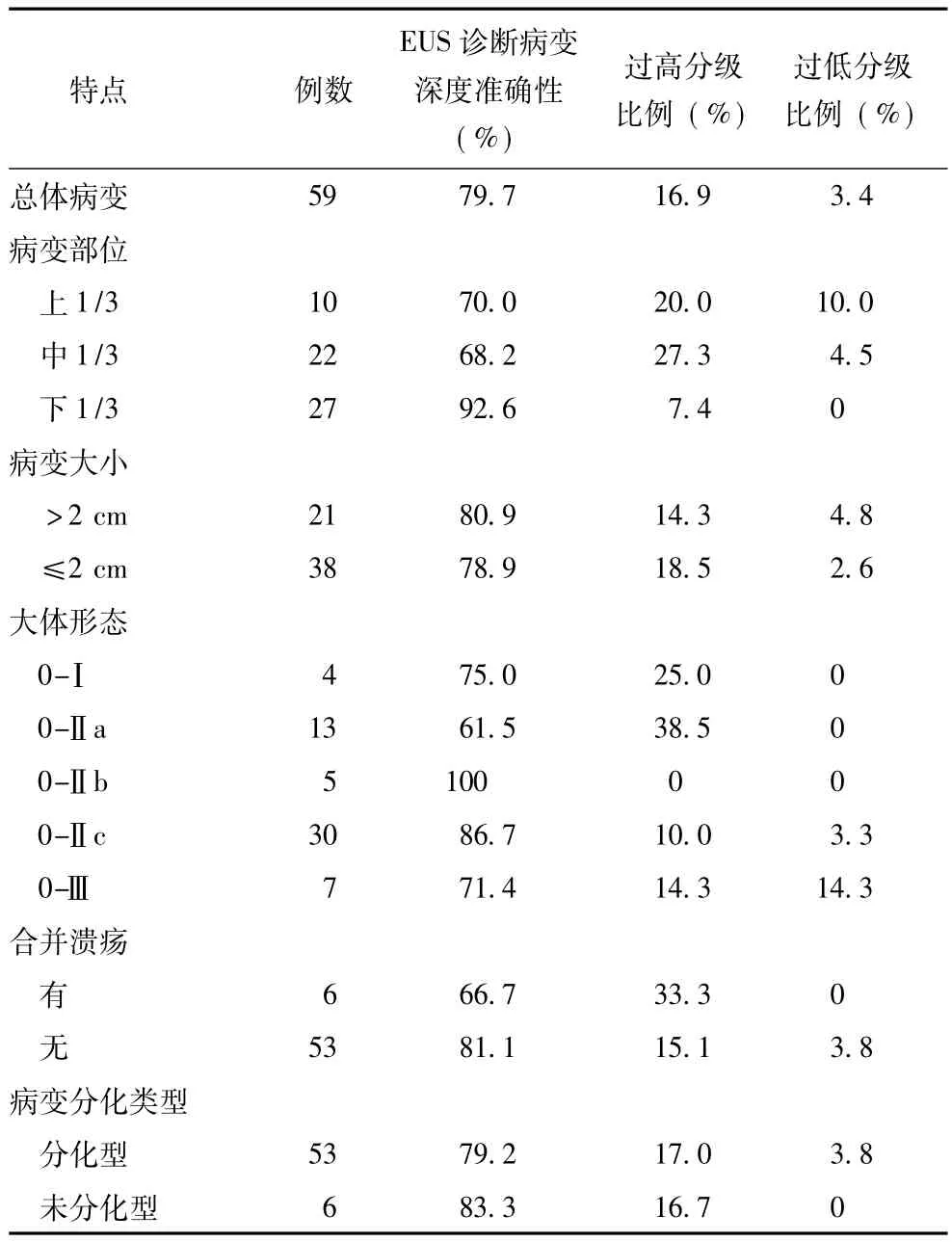
表3早期胃癌不同内镜及病理特点下EUS诊断病变深度的准确性
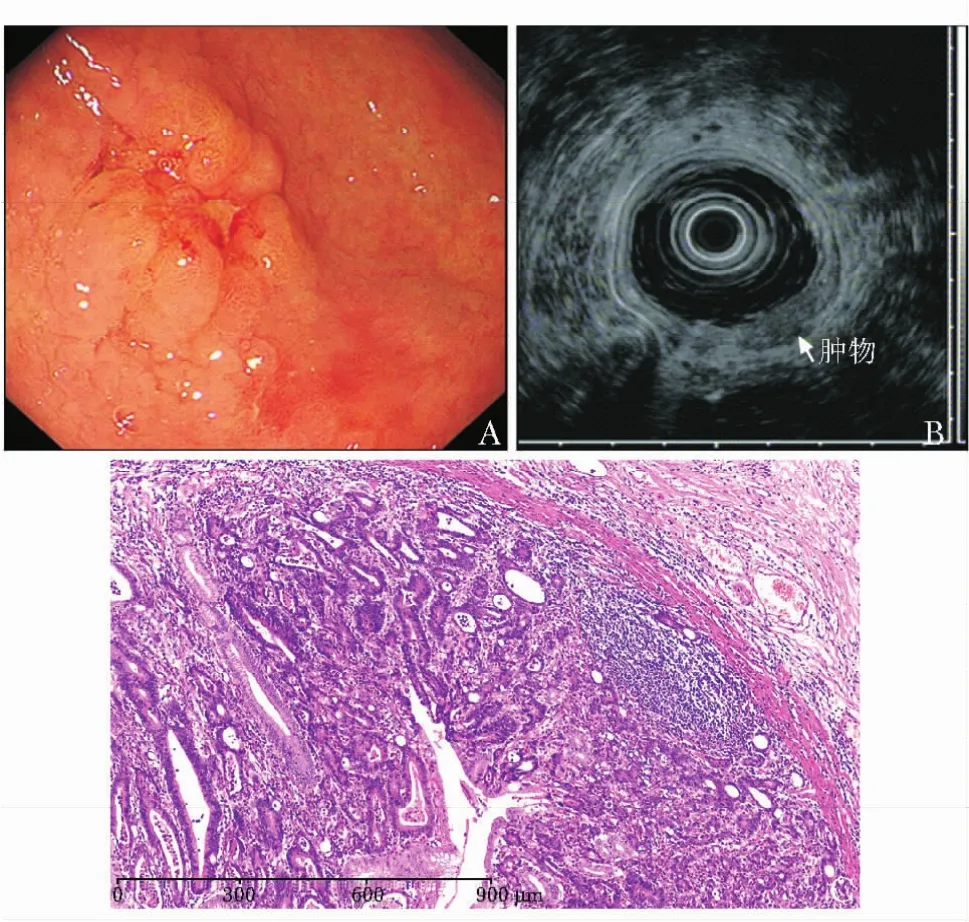
图3早期胃癌EUS过高分级
因此,对于早期胃癌患者,在制定治疗决策之前,必须明确病变的大体形态、大小、是否存在溃疡、组织学类型及病变的浸润深度等。前几种特征通过仔细的内镜检查及精确活检病理检查通常能获得明确的答案,而针对病变的浸润深度,尽管某些内镜下特点对于判断病变黏膜下层浸润有一定帮助,但不同内镜医生判断的准确性差异很大[14],活检病理也很难提供黏膜下层浸润的信息,因而常常依赖于影像学检查。由于胃是空腔脏器,胃壁很薄且有很大的延展性,传统的CT和MRI对于胃癌局部浸润的T分期诊断价值都有限,常常作为评价淋巴结转移 (N分期)和远处转移 (M分期)的手段[15-17]。EUS能够清晰地展示胃壁各层结构,已经被广泛应用于胃癌的术前分期评价,目前被公认为评价胃癌局部浸润深度的最佳手段[17-19]。但是对于早期胃癌,EUS诊断浸润深度的准确性不如进展期胃癌[7-8,10,18]。
关于EUS对胃癌局部分期的研究很多,不同研究其准确性差异很大,大多波动于65% ~92%[7-9,16-19]。本研究采用了12 MHz的超声小探头对早期胃癌病变进行扫查,诊断的总体准确性为79.7%,敏感性为79.7%,特异性为81.4%,与已有文献报道一致[7-9,16-19]。同时本研究分别计算了M层和SM层病变EUS的诊断敏感性、特异性和准确性,M层分别为 66.1%、80.0%和79.7%,SM层分别为80.0%、81.6%和81.4%,两者均在上述文献 [7-9,16-19]的报道范围之内,但SM层病变的结果要略优于M层,尤其是敏感性有所提高,两者之间差异没有统计学意义,可能是由于SM层病变例数太少所致,该结果有待更多纳入SM层病变的研究来证实。
Kwee等[20]进行了一项关于EUS区分M层及M层以下病变诊断价值的荟萃分析,共纳入18个研究,每个研究的样本数在30~226例 (平均89.5例),结果发现各项研究的敏感性为 18.2% ~100%(平均87.8%),特异性34.7% ~100%(平均80.2%),存在显著差异 (P<0.0001)。影响研究结果的因素很多,包括采用检查设备、操作者经验、入选病例等,病变的内镜和病理特点对于诊断结果也有很大影响。目前认为与病变相关的可能影响因素包括:病变部位、大小、大体形态、是否合并溃疡以及组织学分型[8-9,14,18-19,21]。本研究也探讨了不同内镜和病理特点病变EUS诊断的准确性和错误分级的情况。针对部位而言,之前的报道大多以胃上 1/3病变准确率最低[9,14,18,22],与超声小探头不易接近病变有关,另外胃底的SM层较薄,有较多的血管和纤维组织,也会影响诊断结果[22]。本研究发现位于胃中1/3的病变准确率最低 (68.2%),上1/3病变次之 (70.0%),两者结果非常接近,原因可能是:(1)22例胃中1/3病变中有15例为胃角附近的病变,超声小探头不易接近并进行标准切线位扫查,影响诊断结果;(2)胃上1/ 3病变例数相对较少。另外,本研究结果提示大体形态为隆起型 (0-Ⅰ及0-Ⅱa,分别为75.0%和61.5%)以及合并溃疡的病变 (66.7%)诊断的准确性相对较低,与Akashi等[21]的研究结果类似。隆起型病变区域较厚,位于病变上方的高频超声小探头产生的声波在SM层以上被反射,因而SM层声像显示不够清楚,影响诊断的准确性,换用更低频率的小探头扫查或者用普通超声内镜直接扫查可能会有帮助。溃疡底部通常会有炎症、水肿以及纤维化,也会影响超声检查结果。本研究结果显示不同大小病变EUS诊断的准确性接近,分化型和未分化型腺癌的EUS诊断准确性也没有明显差异,但由于未分化型腺癌的例数较少,结果可靠性有待更大样本研究证实。
本研究结果提示,对于早期胃癌,EUS判断病变深度时容易出现过高分级 (16.9%),主要发生在位于胃上1/3(20.0%)和中1/3(27.3%)、大体形态为隆起型 (0-Ⅰ:25.0%,0-Ⅱa:38.5%)以及合并溃疡 (33.3%)的病变中,提示对于这类病变,小探头EUS判断病变深度的价值有局限,可能会作出错误的判断,导致部分患者因过高分级失去内镜切除病变的机会,因而需要结合病变内镜特点 (有无SM层浸润改变)、黏膜下注射抬举征是否阳性或换用普通超声内镜检查进行综合判断,以作出正确的治疗决策。过低分级的比例较低,仅为3.4%,这个结果可能与SM层病变例数较少有关,可靠性有待进一步确认。
本研究是回顾性分析,存在一定的局限性,主要在于样本量较小,按内镜和病理特点分层后数据分布不均,个别组例数过少,得出的结果未能进行统计学分析判断差异的显著性。另外,由于病理检查结果未能测量SM层病变的浸润深度,无法对SM层病变进行更深层次的分析 (区分SM浅层浸润及深层浸润)。要获得EUS对早期胃癌浸润深度诊断价值更为精确可靠的结果,需要更大样本量的研究,尤其要纳入更多累及SM层的病例,并对SM浅层及深层浸润进行区分。
综上,小探头EUS对于判断早期胃癌浸润深度有较高的准确性,有助于作出适当的治疗决策,病变部位、大体类型及溃疡的存在会影响EUS的准确性,胃上1/3和中1/3、大体形态为隆起型 (0-Ⅰ和0-Ⅱa)以及合并溃疡的病变更易出现过高分级,判断病变深度时需要综合考虑其内镜下特点,必要时采用其他检查手段。
[1]Sano T,Kobori O,Muto T.Lymph node metastasis from early gastric cancer:endoscopic resection of tumour[J].Br J Surg,1992,79:241-244.
[2]Gotoda T,Yanagisawa A,Sasako M,et al.Incidence of lymph node metastasis from early gastric cancer:estimation with a large number of cases at two large centers[J].Gastric Cancer,2000,3:219-225.
[3]Tanaka M,Ono H,Hasuike N,et al.Endoscopic submucosal dissection of early gastric cancer[J].Digestion,2008,77:23-28.
[4]Isomoto H,Shikuwa S,Yamaguchi N,et al.Endoscopic submucosal dissection for early gastric cancer:a large-scale feasibility study[J].Gut,2009,58:331-336.
[5]李兆申,王贵齐,张澍田,等.2014中国早期胃癌筛查及内镜诊治共识意见[J].中华消化内镜杂志,2014,31:361-373.
[6]Hirasawa T,Gotoda T,Miyata S,et al.Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated type early gastric cancer[J].Gastric Cancer,2009,12:148-152.
[7]Puli SR,Reddy JBK,Bechtold ML,et al.How good is endoscopic ultrasound for TNM staging of gastric cancer?A metaanalysis and systematic review[J].World J Gastroenterol,2008,14:4011-4019.
[8]Cardoso R,Cobum N,Seevaratnam R,et al.A systematic review and meta-analysis of the utility of EUS for preoperative staging for gastric cancer[J].Gastric Cancer,2012,15: S19-S26.
[9]Lee HH,Lim CH,Park JM,et al.Low accuracy of endoscopic ultrasonography for detailed T staging in gastric cancer[J].World J Surg Oncol,2012,10:190-195.
[10]Caletti G,Fusaroli P.The rediscovery of endoscopic ultrasound(EUS)in gastric cancer staging[J].Endoscopy, 2012,44:553-555.
[11]Kimmey MB,Martin RW,Haggitt RC,et al.Histologic correlates of gastrointestinal ultrasound images[J].Gastroenterology,1989,96:433-441.
[12]The Paris endoscopic classification of superficial neoplastic lesions:esophagus,stomach,and colon:November 30 to December 1,2002[J].Gastrointest Endosc,2003,58: S3-S43.
[13]Gotoda T.Endoscopic resection of early gastric cancer[J].Gastric Cancer,2007,10:1-11.
[14]Hizawa K,Iwai K,Esaki M,et al.Is endoscopic ultrasonography indispensable in assessing the appropriateness of endoscopic resection for gastric cancer?[J].Endoscopy,2002,34:973-978.
[15]Mehmedovic A,Mesihovic R,Saray A,et al.Gastric cancer staging:EUS and CT[J].Med Arch,2014,68:34-36.
[16]Lei C,Huang L,Wang Y,et al.Comparison of MRI and endoscopic ultrasound detection in preoperative T/N staging of gastric cancer[J].Mol Clin Oncol,2013,1:699-702.
[17]Hwang SW,Lee DH.Is endoscopic ultrasonography still the modality of choice in preoperative staging of gastric cancer?[J].World J Gatroenterol,2014,20:13775-13782.
[18]Cho JW.The role of endoscopic ultrsonography in T staging: early gastric cancer and esophageal cancer[J].Clin Endosc,2013,46:239-242.
[19]Yoshinaga S,Oda I,Nonaka S,et al.Endoscopic ultrasound using ultrasound probes for the diagnosis of early esophageal and gastric cancers[J].World J Gatroinest Endosc,2012,4:218-226.
[20]Kwee RM,Kwee TC.The accuracy of endoscopic ultrasonography in differentiating mucosal from deeper gastric cancer[J].Am J Gastroenterol,2008,103:1801-1809.
[21]Akashi K,Yanai H,Nishikawa J,et al.Ulcerous change decreases the accuracy of endoscopic ultrasonography diagnosis for the invasive depth of early gastric cancer[J].Int J Gastrointest Cancer,2006,37:133-138.
[22]Takao T,Hiroyuki O,Yoshiro K,et al.Usefulness and Problems of Endoscopic Ultrasonography in Prediction of the Depth of Tumor Invasion in Early Gastric Cancer[J].Acta Med Okayama,2011,65:105-112.
Diagnostic Value of Miniprobe Endoscopic Ultrasonography in Assessment of Tumor Invasion Depth in Early Gastric Cancer
YAO Fang1,YANG Ai-ming1,WU Dong-sheng1,WU Xi1,GUO Tao1,ZHOU Wei-xun2,LU Xing-hua1
1Department of Gastroenterology,2Department of Pathology,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
ObjectiveTo evaluate the role of miniprobe endoscopic ultrasonography(EUS)in assessing the depth of tumor invasion in early gastric cancer and to analyze the factors affecting the accuracy of EUS.MethodsThis retrospective study included 59 cases of pathologically confirmed early gastric cancer diagnosed and hospitalized in Peking Union Medical College Hospital in the period of March 2010 to December 2012.They all received miniprobe EUS for predicting the depth of invasion before endoscopic or surgical resection.We assessed the diagnostic sensitivity,specificity and accuracy of EUS by comparing the pre-treatment EUS results with the postoperative histopathological findings.The endoscopic features and pathological factors possibly influencing the accuracy of EUS were also analyzed.ResultsThe overall diagnostic sensitivity,specificity and accuracy of EUS in assessing the depth of early gastric cancer invasion were 79.7%,81.4%and 79.7%,respectively.The sensitivity,specificity and accuracy for mucosal layer lesion were 66.1%,80.0%and 79.7%,respectively;and the sensitivity,specificity and accuracy for submucosal lesion were 80.0%,81.6%and 81.4%,respectively,showing no significant diference(P>0.05).The overgrading rate of EUS was 16.9%,and the overgrading mainly happened in leisons located in upper third(20.0%)and middle third(27.3%)of the stomach,with a superficial appearance of elevated type(0-Ⅰ:25.0%,0-Ⅱa:38.5%)or with ulcers(33.3%).The above mentioned lesions were also associated with a relatively lower diagnostic accuracy of EUS.The undergrading rate of EUS was 3.4%.ConclusionsMiniprobe EUS has a fairly high diagnostic accuracy in assessing the depth of gastric cancer invasion,which helps the planning of treatment strategy.The location,macroscopic type of lesions and coexisting ulcer would affect the dignostic accuracy of EUS.
early gastric cancer;endoscopic ultrasonography;depth of invasion
YAO FangTel:010-69155017,E-mail:yaofang99@sina.com
R735.2;R445.1
A
1674-9081(2015)02-0083-06
10.3969/j.issn.1674-9081.2015.02.002
2014-11-19)
姚方电话:010-69155017,E-mail:yaofang99@sina.com

