ANGPT1、ANGPT2、VEGF在急性髓系白血病小鼠模型中的表达研究*
杨 红,田凤瑛,周泽平,邵 亮,张 铀△
(1.昆明医科大学第二附属医院血液科,昆明 650101;2.云南省昆明市延安医院儿科
650051;3.武汉大学中南医院血液科,武汉 430071)
·论著·
ANGPT1、ANGPT2、VEGF在急性髓系白血病小鼠模型中的表达研究*
杨 红1,田凤瑛2,周泽平1,邵 亮3,张 铀1△
(1.昆明医科大学第二附属医院血液科,昆明 650101;2.云南省昆明市延安医院儿科
650051;3.武汉大学中南医院血液科,武汉 430071)
目的 通过构建急性髓系白血病(AML)小鼠模型,从mRNA水平研究促血管生成素(ANGPT)1、ANGPT2、血管内皮生长因子(VEGF)的表达水平与急性髓系白血病的关系。方法 NOD/SCID小鼠腹腔接种HL-60细胞,建立AML小鼠模型,称模型组,未经处理的NOD/SCID小鼠作对照组。用病理组织学及流式细胞学方法鉴定小鼠模型是否成功。实时荧光定量PCR(RQ-PCR)技术检测ANGPT2、ANGPT1及VEGF mRNA在AML小鼠肿瘤组织中的表达水平。应用Spearman相关分析法分析ANGPT2 mRNA表达水平与小鼠生存期的关系。结果 成功构建AML小鼠模型。RQ-PCR结果显示模型组肿瘤组织的ANGPT2、VEGF mRNA的表达水平较正常对照组显著增高,差异有统计学意义(P<0.05),而ANGPT1 mRNA的表达水平两组差异无统计学意义(P>0.05)。ANGPT2 mRNA表达水平与AML小鼠生存期呈负相关。结论 ANGPT2 mRNA在AML小鼠中高表达且与AML小鼠生存期呈负相关,ANGPT2表达与AML病情进展及预后相关。
急性髓系白血病;小鼠模型;促血管生成素;血管内皮生长因子
急性髓系白血病(AML) 是严重危害人类健康的恶性肿瘤之一。目前尚缺乏疗效好且不良反应小的治疗方案。研究发现,血管增生在AML的致病机理中发挥重要作用,其中促血管生成素-酪氨酸激酶受体(ANGPT-TIE)通路是主要的血管增生信号通路之一。研究发现,ANGPT2在实体瘤组织和血液系统肿瘤患者外周血中高表达。目前发现ANGPT2与AML的预后密切相关。本研究通过构建急性髓系白血病小鼠模型,从mRNA水平研究ANGPT1、ANGPT2、血管内皮生长因子(VEGF)的表达水平与AML的关系,探讨ANGPT2对AML预后的影响,为靶向ANGPT2治疗AML提供理论及实验基础。
1 材料与方法
1.1 动物、细胞与材料 NOD/SCID小鼠购自北京维通利华实验动物技术有限公司,雄性,周龄3周(<5周),体质量约5 g左右,饲养于昆明医科大学SPF级实验动物实验室。HL-60细胞全称为HL-60人原髓细胞白血病细胞,购自中国科学院上海细胞库。主要实验试剂有IMDM培养基和胎牛血清购自上海哈灵生物科技有限公司,总RNA提取试剂盒、QuantiTect®SYBR®Green PCR试剂盒、PrimeScriptTM RT Master Mix 购自 TaKaRa公司,其他试剂为市售分析纯。PCR引物序列由上海生工生物技术服务有限公司设计及合成。
1.2 方法
1.2.1 HL-60细胞的培养 细胞用10%小牛血清,100 U/mL青霉素和100 U/mL链霉素、RPMI-1640培养液,置25 cm2塑料培养瓶内,每瓶培养基的体积为8 mL;培养条件37 ℃,饱和湿度,5% CO2,取对数生长期HL-60细胞进行实验。
1.2.2 AML小鼠模型的构建 取传代后处于对数生长期的HL-60细胞株,在倒置显微镜下用细胞计数板进行计数,将1×107个细胞在已局部消毒的NOD/SCID小鼠的左下腹进行腹腔接种。
1.2.3 急性髓系白血病NOD/SCID小鼠模型的鉴定
1.2.3.1 观察NOD/SCID小鼠的一般情况 动态观察小鼠精神、食欲、体质量、活动能力、毛发情况、腹腔积液、皮下肿瘤大小、生存时间等情况。
1.2.3.2 流式细胞分析仪检测骨髓细胞CD33阳性率 髓系细胞表面抗原CD33在人白血病细胞系HL-60上表达的阳性率可达99%。将濒临死亡的小鼠脱颈椎处死,小鼠置于75%乙醇中浸泡5~10 min,分离胫骨、股骨,将分离好的胫骨、股骨放入装有PBS的培养皿,剪断干骺端后用1 mL注射器吸取少许PBS反复冲洗骨髓腔,装入有EDTA抗凝剂的离心管中,经PBS洗2 次后,加入抗人CD45和CD33抗体同时加入小鼠血清,4 ℃避光染色30 min,再经PBS洗2次,流式细胞仪检测,Midfilt软件分析细胞分布。
1.2.3.3 病理学检查 取濒死小鼠及死亡小鼠的实体瘤、肝、脾、肺、脑等脏器用10%甲醛固定后,常规石蜡包埋、切片、HE 染色,光镜下观察形态学改变,以明确小鼠的死亡原因。
1.2.4 实时荧光定量PCR(real-time fluorescence quantitative PCR,RQ-PCR)检测AML小鼠肿瘤组织中ANGPT2、ANGPT1以及VEGF mRNA的表达水平 采用Promega公司SV 总RNA 分离纯化试剂盒提取RNA,紫外分光光度计评价所提取RNA的浓度和纯度(A260/A280 >1.8)。采用PrimeScriptTM RT Master Mix(Perfect Real Time)试剂盒逆转录cDNA。利用Primer软件设计扩增引物,由上海生工生物技术服务有限公司设计及合成,具体序列如下。ANGPT1基因,上游引物:5′-TGC ACT AAA GAA GGT GTT TTG CT-3′,下游引物:5′-CCG GTG TTG TAT TAC TGT CCA A-3′,片段大小197 bp;ANGPT2基因,上游引物:5′-CCT CGA CTA CGA CGA CTC AGT-3′,下游引物:5′-TCT GCA CCA CAT TCT GTT GGA-3′,片段大小146 bp;VEGF基因,上游引物:5′-GCA CAT AGA GAG AAT GAG CTT CC-3′,下游引物:5′-CTC CGC TCT GAA CAA GGC T-3′,片段大小105 bp;β-actin基因,上游引物:5′-TGC CAT CCT AAA AGC CAC-3′,下游引物:5′-TCA ACT GGT CTC AAG TCA GTG-3′,片段大小289 bp。RQ-PCR反应按QIAGEN公司QuantiTect SYBR Green PCR试剂盒说明书进行。总反应体系为20.0 μL。2×SYBR Primix Ex TaqTM 10.0 μL,上游及下游引物各1.0 μL,cDNA 2.0 μL,H2O 6.0 μL。反应条件如下:94 ℃预变性3 min;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 30 s,44个循环。扩增产物行2%琼脂糖凝胶电泳,确定产物特异性。根据目的基因对比标准品的RQ值作为ANGPT1、ANGPT2、VEGF mRNA相对表达水平。
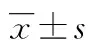
2 结果
2.1 成功构建AML小鼠模型 腹腔接种HL-60细胞后约20~33 d左右10只小鼠均有不同程度发病,小鼠出现精神状态差、活动减少、嗜睡、步态不稳、行动迟缓、进食减少、体质量不增或下降。通过病理学检查发现小鼠的肝、脾、肺、脑、肾等全身重要脏器均有肿瘤细胞的广泛浸润,其小血管内亦可见大量的肿瘤细胞浸润。流式细胞仪检测,结果显示CD33在小鼠骨髓中高表达,表达率为30.0%~97.4%,见图1。

A、C:CD45/SSC射门;B、D:CD33表达量。
图1 流式细胞术检测小鼠骨髓CD33表达
1:DNA分子标记物(DL2000);2:正常组织内参β-actin基因;3:肿瘤组织内参β-actin;4:正常组织VEGF基因;5:肿瘤组织VEGF基因;6:正常组织ANGPT2基因;7:肿瘤组织ANGPT2基因;8:正常组织ANGPT1基因;9:肿瘤组织ANGPT1基因。
图2 PCR扩增产物2%琼脂糖凝胶电泳图
2.2 ANGPT1、ANGPT2、VEGF mRNA表达水平 取10例经鉴定成功建模的小鼠的肿瘤组织为模型组,10例未经任何处理的小鼠为对照组,RQ-PCR法检测ANGPT1、ANGPT2及VEGF mRNA表达水平。ANGPT2、VEGF和β-actin 基因扩增产物溶解曲线分析显示,溶解浓度均一,可排除非特异性扩增。目的和内参基因PCR扩增产物经2%琼脂糖凝胶电泳可见,ANGPT1靠近197 bp处,ANGPT2靠近146 bp处,VEGF靠近105 bp处,且条带致密、明亮,无引物二聚体和非特异性扩增,说明扩增产物正确,引物特异性好,见图2。
2.3 ANGPT1、ANGPT2、VEGF mRNA在模型组和对照组中的表达 ANGPT1去掉一个异常值13.642,进行统计学分析。结果显示模型组与正常组比较,ANGPT1 mRNA表达差异无统计学意义,而两组间ANGPT2及VEGF mRNA的差异均有统计学差异,模型组明显高于正常组(P<0.05),结果见图3。
2.4 ANGPT2 mRNA表达量与小鼠生存期的相关性分析 研究结果显示小鼠生存期为(38.6±4.1)d,而ANGPT2的mRNA表达量为46.963±25.742 3。为了进一步明确二者之间是否存在关系,采用Spearman相关分析,结果显示ANGPT2基因mRNA表达量与小鼠生存期呈负相关关系(P<0.01,r=-0.997),见图4。
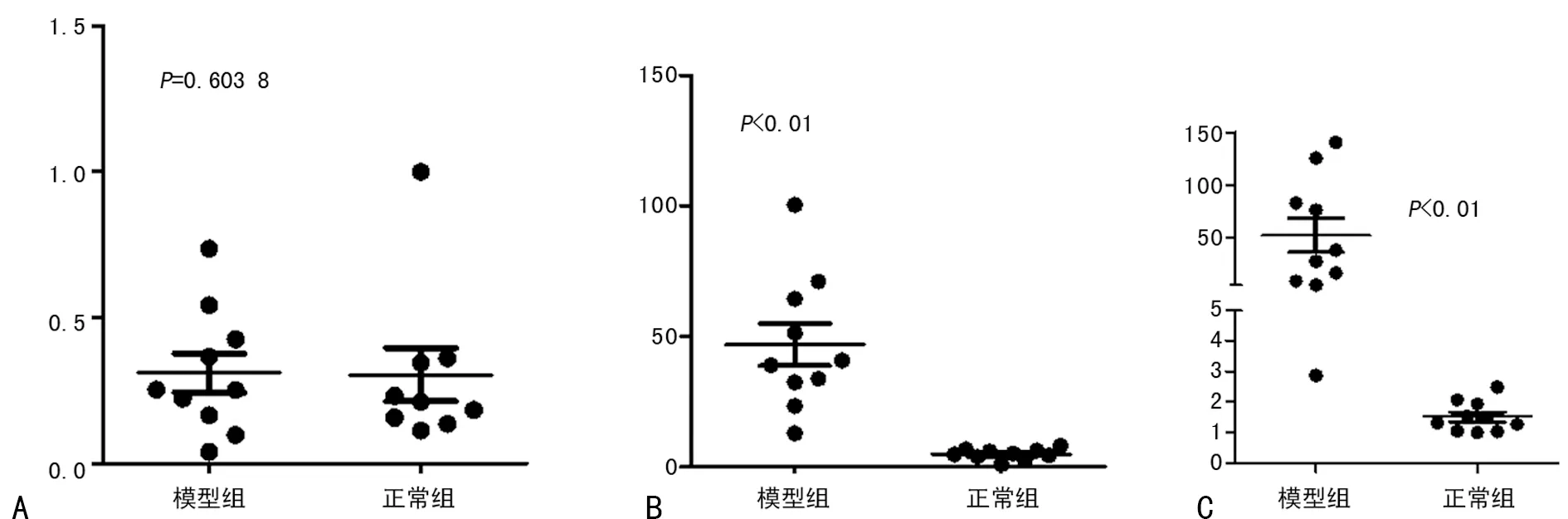
A:ANGPT1;B:ANGPT2;C:VEGF。
图3 ANGPT1、ANGPT2、VEGF mRNA在两组中的相对表达量
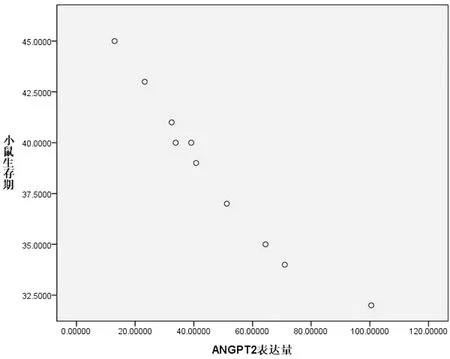
图4 ANGPT2 mRNA表达量与小鼠生存期的相关分析图
3 讨论
ANGPT是血管生成的一类因子,是一个家族体系。ANGPT家族与VEGF在血管的增生、稳定以及退化中具有协同作用,促进肿瘤性新生血管的形成,并在肿瘤的生长、侵袭、转移中发挥重要作用[1]。近年研究逐渐发现血管新生的程度可以成为预测肿瘤预后的一项重要指标。血管新生指的是在原有血管的基础上形成新的毛细血管网,即内皮细胞增殖、迁移和毛细血管形成的过程。Padro 等[2]研究发现新确诊的AML患者的微血管密度(microvessel density,MVD)是正常对照组的2倍,经过化疗达完全缓解且骨髓处于抑制期时骨髓微血管密度下降了60%,而未达到完全缓解者仅下降了17%。对于完全缓解的骨髓与正常对照组MVD无显著差异。表明血管新生在AML的发病机制中可能起着重要的作用,而MVD的增高通常伴随来源于白血病细胞的血管生长因子的分泌,其中最重要的是ANGPTs及VEGF[3]。Muller等[4]、Tarai等[5]发现与正常对照组比较,新确诊的和复发的AML患者中ANGPT1、ANGPT2有较高的阳性表达率,并且与幼稚细胞的数量呈正相关。Schliemann等[6]用免疫组织化学法分析了AML患者骨髓活检标本的ANGPT1、ANGPT2、TIE2的表达情况,证实了ANGPT2在AML患者的骨髓中高表达,而ANGPT1与正常对照组无显著差异,进一步证明了ANGPT2与AML的预后呈负相关。Schliemann等[7]用ELISA检测68例新确诊AML患者血浆中ANGPT2水平,发现高水平ANGPT2者预后不良。
目前临床实验中大多仅限于用AML患者的骨髓和外周血等进行相关检测,大量的研究只是证实了ANGPT2在AML的骨髓、外周血及血浆中高表达且与AML患者的预后呈负相关,但是还没有用ANGPT2的特异性单克隆抗体进行临床治疗的报道,并且其相关的实验动物模型研究也很少。
本研究采用NOD/SCID小鼠成功构建AML模型,并利用RQ-PCR检测建模成功的AML小鼠的肿瘤组织,研究发现ANGPT2、VEGF mRNA的表达水平较对照组显著增高,差异有统计学意义(P<0.05),而ANGPT1 mRNA的表达水平与对照组无显著差异(P>0.05),这与文献[4-6]临床研究的结果一致,提示ANGPT2 mRNA高表达在AML的发病中有重要意义。在研究中同时还发现,高表达ANGPT2的小鼠其生存期比ANGPT2表达低的小鼠短,采用Spearman相关分析显示ANGPT2基因mRNA表达量与小鼠生存期有高度的相关关系,且为负相关,由此可推论出高表达的ANGPT2与AML的预后呈负相关,高表达ANGPT2的AML预后不良。
针对ANGPT2的研究在实体瘤中也有大量的报道,研究发现ANGPT2高表达与大肠癌[8]、鼻咽癌[9]、胃癌[10]等多种实体瘤侵袭转移及预后相关。但目前研究的热点是靶向治疗且已取得了初步结果。Hashizume等[11]应用ANGPT2选择性地抑制性L1~L7融合蛋白治疗人结肠癌异体移植的小鼠模型,发现该方法能有效抑制肿瘤生长和血管增生,当与抗VEGF合用时其作用更为明显。有学者[12-13]应用3.19.3单克隆ANGPT2抗体,有效地抑制了侵袭性的MMTV-PyMT乳腺癌和胰腺胰岛瘤的血管增生和疾病进展,局部性地降低了巨噬细胞(TIE-2-expressing macrophages,TEMs)的TIE2的表达,也有效降低了肿瘤的血管增生。
本研究成功建立了AML NOD/SCID小鼠模型,并在mRNA水平利用特异性强、灵敏度高、重复性好、定量准确的RQ-PCR进行了ANGPT2、VEGF及ANGPT1基因的相关检测,发现ANGPT2、VEGF mRNA的表达水平较正常组显著增高,而ANGPT1 mRNA的表达水平与正常组无显著差异,且高表达ANGPT2的小鼠其生存期比ANGPT2表达低的小鼠短,说明了高表达的ANGPT2与AML的预后呈负相关。作为ANGPT2靶向治疗的前期试验,这对于下一步的分子靶向治疗研究奠定了良好的实验及理论基础。接下来需要在AML小鼠模型的基础上进一步深入研究用特异性的ANGPT2单克隆抗体治疗AML小鼠,观察小鼠的生存期及肿瘤生长情况,同时还需进一步探讨VEGF抗体与ANGPT2抗体在AML中的协同治疗效果,为临床靶向ANGPT2治疗AML奠定坚实的理论和实验基础。
[1]Shim WS,Ho IA,Wong PE.Angiopoietin:a TIE(d) balance in tumor angiogenesis[J].Mol Cancer Res,2007,5(7):655-665.
[2]Padro T,Ruiz S,Bieker R,et al.Increased angiogenesis in the bone marrow of patients with acute myeloid leukemia[J].Blood,2000,95(8):2637-2644.
[3]Fiedler W,Schuch G,Loges S,et al.Prognostic implication of expression of angiopoietin-2 in acute myeloid leukemia[J].Leuk Res,2008,32(6):843-844.
[4]Muller A,Lange K,Gaiser T,et al.Expression of angiopoietin-1 and its receptor TEK in hematopoietic cells from patients with myeloid leukemia[J].Leuk Res,2002,26(2):163-168.
[5]Tarai M,Miwa H,Shikami M,et al.Expression of endothelial cell associated molecules in AML cells[J].Leukemia,2002,16(1):112-119.
[6]Schliemann C,Bieker R,padro T,et al.Expression of angiopoietins and their receptor Tie2 in the bone marrow of patients with acute myeloid leukemia[J].Haematologica,2006,91(9):1203-1211.
[7]Schliemann C,Bieker R,Thoennissen N,et al.Circulating angiopoietin-2 is a strong prognostic factor in acute myeloid leukemia[J].Leukemia,2007,21(9):1901-1906.
[8]刘新兰,李亦功,魏健敏,等.Ang-2,Tie-2和VEGFR-2表达在大肠癌血管生成和预后中的作用[J].南方医科大学学报,2012,32(11):1658-1662.
[9]赵萍萍,皱容,屈元娇,等.Ang-1和Ang-2及其受体Tie-2在鼻咽癌患者血循环中的表达及临床意义[J].第三军医大学学报,2012,34(13):1289-1292.
[10]刘少平,董卫国,胡钦勇,等.外周血血管生成素-2表达与胃癌淋巴结微转移及预后的关系[J].武汉大学学报:医学版,2013,34(2):285-292.
[11]Hashizume H,Falcón BL,Kuroda T,et al.Complementary actions of inhibitors of angiopoietin-2 and VEGF on tumor angiogenesis and growth[J].Cancer Res,2010,70(6):2213-2223.
[12]Mazzieri R,Pucci F,Moi D,et al.Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J].Cancer cell,2011,19(4):512-526.
[13]Lewis CE,Ferrara N.Multiple effects of angiopoietin-2 blockade on tumors[J].Cancer Cell,2011,19(4):431-433.
A study of the expression of ANGPT1,ANGPT2 and VEGF in mouse model of acute myeloid Leukemia*
YangHong1,TianFengying2,ZhouZeping1,ShaoLiang3,ZhangYou1△
(1.DepartmentofHematology,theSecondAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650101,China;2.DepartmentofPediatrics,KunmingYan′anHospital,Kunming,Yunnan650051,China;3.DepartmentofHematology,theAffiliatedZhongnanHospitalofWuhanUniversity,Wuhan,Hubei430071,China)
Objective To construct mouse model of acute myeloid leukemia and detect the expression of ANGPT1,ANGPT2 and VEGF gene on the cells its as well as the clinical significance.Methods The HL-60 cells were transfected to NOD/SCID mouse through abdominal injection to construct mouse model of acute myeloid leukemia.Then identify mouse model by histopathology and Flow Cytometry.The expression of ANGPT2,ANGPT1 and VEGF mRNA in the tumor tissues of mouse model was detected by real-time fluorescence quantitative PCR.The expression of ANGPT2 will be analyzed on the survival time of mouse model by Spearman′s correlation method.Results Mouse model has been successfully identified by histopathology and Flow Cytometry.The expression of ANGPT2 and VEGF in mouse mode was significantly detected,which was that of higher than normal group (P<0.05).The expression of ANGPT1 was lower than that of ANGPT2 and VEGF,there was no significant difference between ANGPT1 and normal groups (P>0.05).The higher expression of ANGPT2 in mouse model had a short survival time in mouse with acute myeloid leukemia.Conclusion This study showed that ANGPT2 mRNA was over-expressed in acute myeloid leukemia.The increasing expression of ANGPT2 mRNA may lead to poor prognosis in mouse with acute myeloid leukemia.
acute myeloid leukemia;mouse model;ANGPT;vascular endothelial growth factor
10.3969/j.issn.1671-8348.2015.05.004
云南省应用基础研究计划项目-联合专项(2011FB198)。 作者简介:杨红(1977-),主治医师,硕士,主要从事血液系统疾病的临床研究。△
,E-mial:youzhangmd@aliyun.com。
R733.7
A
1671-8348(2015)05-0586-04
2014-11-10
2014-12-10)

