米诺环素对PC12细胞缺氧缺糖损伤后神经突生长的影响*
陶 涛,秦新月,冯金洲,罗 华,李小刚
(1.重庆医科大学附属第一医院神经内科 400016;2.泸州医学院附属医院神经内科,四川泸州 646000)
论著·基础研究
米诺环素对PC12细胞缺氧缺糖损伤后神经突生长的影响*
陶 涛1,秦新月2△,冯金洲1,罗 华2,李小刚2
(1.重庆医科大学附属第一医院神经内科 400016;2.泸州医学院附属医院神经内科,四川泸州 646000)
目的 探讨米诺环素对大鼠嗜铬细胞瘤细胞(PC12)缺氧缺糖(OGD)损伤后细胞存活率及神经突生长的影响。方法 分别缺氧缺糖2、4、6 h及8 h建立PC12细胞OGD损伤模型,将细胞分为正常对照组,OGD组和不同浓度的(0.1、1.0 μM和10.0 μM)米诺环素治疗组,在缺氧缺糖/复氧24 h后,用CCK-8法检测细胞存活率,免疫荧光法标记MAP-2并在荧光显微镜下观察神经突的生长,Western blot法检测各组GAP-43蛋白的表达水平。结果 与OGD组比较,米诺环素能显著提OGD后PC12细胞的存活率[(46.1±2.9)%vs.(77.0±2.5)%,P<0.01],促进PC12细胞OGD损伤后神经突的生长,同时上调轴突再生蛋白GAP-43的表达[(0.34±0.04)vs.(2.11±0.10),P<0.01]。结论 米诺环素能减轻OGD损伤所致PC12细胞的死亡,并促进细胞神经突的生长。
米诺环素;神经突生长;氧糖剥夺;PC12细胞
缺血性卒中是严重危害人类健康的疾病之一,其已成为成人致残最主要的原因。成人中枢神经系统损伤后神经功能不能完全恢复是因为受损的神经元不能形成正确的轴突和树突连接[1]。因此,不断开发新的神经保护剂促进中枢神经系统损伤后神经元轴突的再生,是目前医学界研究的热点问题。米诺环素是一种高脂溶性的第二代四环素类抗菌药物,除了抗菌作用以外,还具有抗炎症、抗凋亡及抗氧化应激等神经保护作用[2]。近期一项研究表明米诺环素能强化神经生长因子诱导PC12细胞神经突的生长[3]。但是米诺环素是否能促进PC12细胞缺氧缺糖损伤后神经突的生长,目前尚无相关报道。本研究通过体外培养PC12细胞,建立细胞缺氧缺糖(oxygen glucose deprivation,OGD)模型,观察米诺环素对PC12细胞OGD损伤的保护作用及神经突生长的影响。
1 材料与方法
1.1 材料与试剂 PC12高分化细胞株购于中国科学院上海细胞库;DMEM培养基、胎牛血清、DMEM无糖培养基购自美国Gibico公司;盐酸米诺环素购自Sigma公司;GAP-43抗体和MAP-2抗体购自Santa Cruz公司;β-actin抗体购自北京四正柏公司;全蛋白提取试剂盒购自南京凯基生物公司;Dylight594标记的羊抗兔抗体、BCA蛋白浓度测定试剂盒、ECL-Plus显影试剂盒及CCK-8试剂盒均购于碧云天生物技术研究所。另有仪器Thermo Forma3131 CO2培养箱,Nikon SMZ-10A和FDX-35荧光倒置显微镜和荧光显微照相系统。
1.2 细胞培养及实验分组 PC12细胞用DMEM完全培养基(含10%的胎牛血清,100 U/mL青霉素和100 μg/L链霉素),置于37 ℃,5% CO2及饱和湿度的孵箱中常规培养。隔天换液,待细胞铺满瓶底80%~90%时,用0.25%胰蛋白酶消化,按1∶3传代,收获第5~8代PC12细胞用于以下实验。取处于对数生长期的PC12细胞以2×105/mL,每孔100 μL接种在96孔板(CCK-8实验),每孔1 mL接种在24孔板(神经突测定),以1×106/mL密度接种于75 cm2培养瓶(Western blot检测)。细胞分为3组:正常对照组、OGD组、米诺环素治疗组。
1.3 细胞OGD模型的建立及药物干预 参照并改进本课题组前期报道的培养方案。当细胞培养12 h后,用PBS清洗3遍,加入无血清无糖DMEM培养基,并将细胞置于含5% CO2,94% N2,1% O2,37 ℃的三气培养箱中培养6 h,然后加入无血清的高糖DMEM培养液,置于恒温孵箱中继续培养24 h模拟缺糖缺氧再灌注。正常对照组全过程加入无血清高糖DMEM培养基,置于正常培养箱培养。不同浓度的米诺环素(0.1、1.0、10.0 μM)在OGD及再复氧的全过程加入。
1.4 CCK-8法检测PC12细胞存活率 复氧24 h后,在96孔培养板每孔加入10 μL CCK-8溶液,置于37 ℃,5% CO2培养箱中继续孵育4 h,在ELX-800全自动酶标仪(Bio-TEK)上测定各孔在450 nm波长处的吸光度(OD)值。每组6孔,重复3次实验。以正常对照组CCK-8吸光值为基数100%,OGD组及药物干预组细胞存活率按公式计算:细胞存活率(%)=处理组平均OD值/正常对照组平均OD值×100%。
1.5 免疫细胞荧光测定神经突长度 将盖玻片置于24孔板中,每组设置3个复孔。室温下使用2% 多聚甲醛固定10 min,0.1% Triton X-100破膜30 min,山羊血清封闭30 min,兔抗大鼠MAP-2多克隆抗体(1∶100)4 ℃孵育过夜,PBS清洗3遍后加入Dylight 594山羊抗兔(1∶150),37 ℃避光孵育1 h,DAPI(1∶50)避光反应5 min,50% 甘油封片后在荧光显微镜下观察并拍照。使用Image-Pro Plus 6.0软件对PC12细胞神经突长度进行测定,每次实验在200倍荧光显微镜下随机选取10个视野,每组至少选取50个细胞进行测量,实验重复3次,计算各组神经突长度的平均值。
1.6 蛋白免疫印迹(Western blot)检测GAP-43蛋白表达 复氧24 h 后,收集各组细胞,按照凯基全蛋白提取试剂盒说明书提取细胞蛋白,同时用BCA试剂盒测定蛋白浓度。取等量蛋白经二十烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,采用湿转法将蛋白转移至0.45 μM聚偏氟乙烯(PDVF)膜上(250 mA恒流,1 h),5 %脱脂牛奶封闭1.5 h后加入兔抗GAP-43(1∶200),小鼠抗β-actin(1∶1 000),4 ℃孵育过夜,TBST洗膜后加入辣根过氧化物酶标记的羊抗兔或羊抗小鼠(1∶3 000),37 ℃孵育1.5 h。采用ChemiDocTM凝胶扫描成像系统显微拍照,Quantity One图像分析软件测定各条带的灰度值,蛋白的相对含量以目的蛋白与内参灰度值的比值表示。
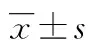
2 结果
2.1 不同缺氧缺糖时间对PC12细胞存活率的影响 CCK-8法测得OGD(2、4、6、8 h)后,PC12细胞的存活率呈时间依赖性下降。OGD 2 h及8 h时,PC12细胞的存活率分别为(80.2±2.7)%,(7.3±1.9)%,OGD 6 h时,PC12细胞的存活率为(46.1±2.9)%,接近50%。因此,本实验选取OGD 6 h作为体外PC12细胞OGD时间,用于探讨米诺环素对PC12细胞OGD损伤的保护作用。见图1。
2.2 米诺环素对PC12细胞OGD损伤后细胞存活率的影响 CCK-8结果显示,不同浓度米诺环素(0.1、1.0、10.0 μM)可提高OGD损伤后PC12细胞的存活率(70.7±2.9)%、(77.0±2.5)%、(55.8±2.5)%,与OGD组[(46.1±2.9)%]比较差异有统计学意义(P<0.01),其中1.0 μM作用最明显,用于后续的研究。米诺环素对正常培养细胞的存活率无促进作用。见图2。
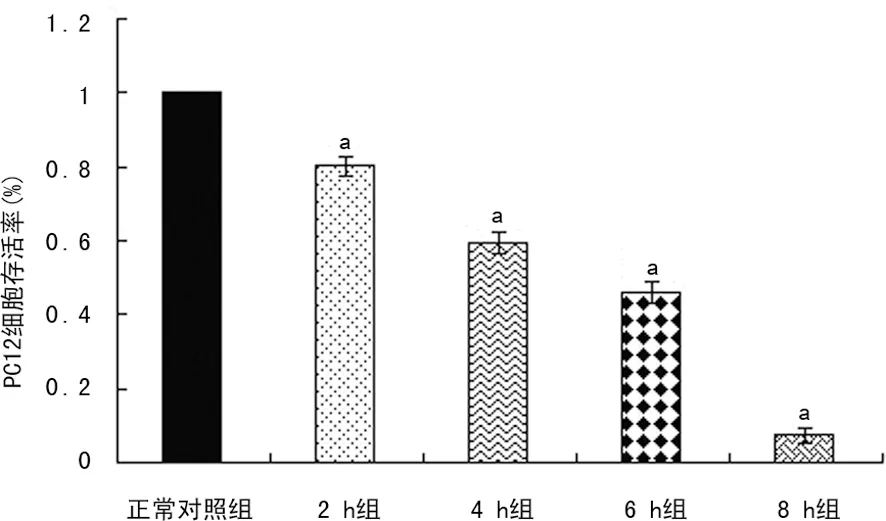
a:P<0.01,与正常对照组比较。
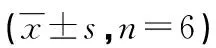
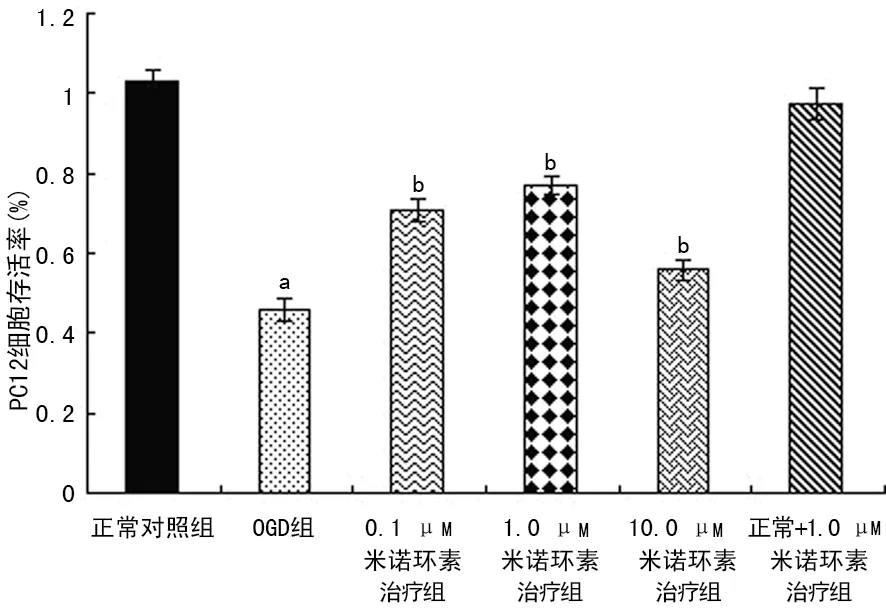
a:P<0.01,与正常对照组比较;b:P<0.01,与OGD组比较。
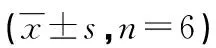
2.3 米诺环素促进PC12细胞神经突的生长 荧光显微镜下观察可见,正常对照组PC12细胞呈梭形,细胞两极有明显的突起,OGD组PC12细胞呈梭形,神经突回缩,而各浓度米诺环素治疗组相对于OGD组,PC12细胞神经突长度增加(P<0.01),其中1.0 μM米诺环素对PC12细胞神经突生长的促进作用最强。见图3。

A:正常对照组;B:OGD组;C:米诺环素组(1.0 μM)。
图3 米诺环素对PC12细胞OGD损伤后神经突生长的影响(200×)
2.4 米诺环素促进PC12细胞GAP-43蛋白的表达 为进一步验证米诺环素对PC12细胞OGD损伤后神经突生长的影响,Western blot法测定轴突再生相关蛋白GAP-43的结果显示,正常对照组PC12细胞GAP-43蛋白呈基础表达(0.40±0.04),0.1、1.0、10.0 μM米诺环素治疗组GAP-43的表达水平(1.17±0.08、2.11±0.10、1.94±0.11)均明显高于OGD组(0.34±0.04),差异有统计学意义(P<0.01),见图4。
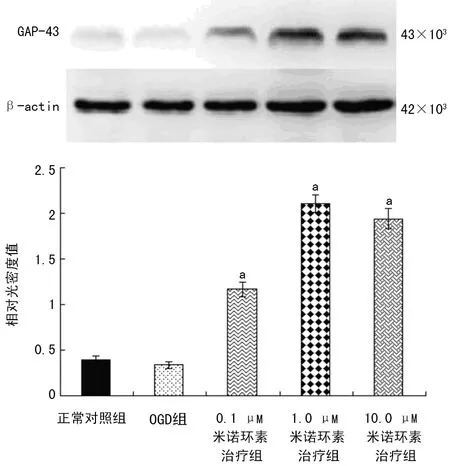
a:P<0.01,与OGD组比较。
图4 各组PC12细胞GAP-43蛋白的表达水平
3 讨论
本研究发现,采取OGD 6 h再复氧复糖法能有效模拟脑缺血再灌注损伤的体外模型。低剂量米诺环素(0.1、1.0、10.0 μM)能有效提高PC12细胞OGD损伤后的存活率,同时能显著促进PC12细胞的轴突生长。
成年哺乳动物中枢神经系统损伤后轴突再生困难,导致严重而持久的神经功能缺损。缺血损伤后促进神经元的轴突再生,形成新的突触联系和神经环路,促进神经网络的重建从而改善神经功能。本研究首先建立PC12 细胞OGD模型,CCK-8法测得OGD 6 h后PC12细胞的病死率约为54%。米诺环素是一种第二代四环素类衍生物,它具有抗菌和抗炎活性并被临床实践证实为一种治疗粉刺和关节炎的安全药物。米诺环素具有高脂溶性,能有效地通过血脑屏障从而在颅脑损伤,卒中,脊髓损伤,神经退行性疾病如肌萎缩性侧索硬化、帕金森病、亨廷顿病及多发性硬化等疾病的动物模型中发挥神经保护作用。大量研究表明米诺环素具有抗炎、抗凋亡、抗氧化应激及血管保护作用[4-5]。米诺环素在神经疾病的病理生理过程中具有以下生物活性:抑制小胶质细胞的增殖及活化,从而使细胞因子如TNF-α、IL-1、IL-6的分泌降低,同时还可以抑制脂质的分泌和基质金属蛋白酶的活性[6];通过caspases非依赖途径上调抗凋亡因子Bcl-2的表达[7-8]及调控环氧化酶2(COX-2),诱导一氧化氮合酶(iNOS)和烟酰胺腺嘌呤二核苷酸磷酸(NADP)的活性[9]。本研究发现米诺环素能缓解OGD对PC12细胞的损伤,使细胞存活率提高达56%~77%。与Chen等[10]研究结果类似,而米诺环素(0.1~10.0 μM)对正常PC12细胞存活率无影响(数据未发布)。
近期研究表明米诺环素能强化神经生长因子诱导PC12细胞神经突的分化[3],并且促进大鼠局灶性脑缺血后皮质神经元轴突的再生,改善大鼠神经功能[11]。2007年,Lampl等[12]开展的一项临床研究表明急性缺血性卒中患者,早期给予口服米诺环素治疗可以改善患者的神经功能缺失评分和生活能力状态分级评分。本研究发现,OGD损伤使PC12细胞神经突回缩,而米诺环素能促进OGD损伤后的细胞神经突长度增加。GAP-43广泛表达在神经组织,被认为是神经元发育和再生的一种标志蛋白,对轴突生长和突触形成具有重要作用。本实验进一步发现,米诺环素能上调PC12细胞OGD损伤后GAP-43蛋白的表达。
综上所述,米诺环素对PC12细胞OGD损伤具有神经保护作用,可促进细胞神经突长度的增加,并能上调轴突再生相关蛋白GAP-43的表达,为缺血性脑血管病的神经康复治疗提供新的途径,但具体机制尚需进一步研究。
[1]Papadopoulos CM,Tsai SY,Cheatwood JL,et al.Dendritic plasticity in the adult rat following middle cerebral artery occlusion and Nogo-a neutralization[J].Cereb Cortex,2006,16(4):529-536.
[2]Fagan SC,Cronic LE,Hess DC.Minocycline development for acute ischemic stroke[J].Transl Stroke Res,2011,2(2):202-208.
[3]Hashimoto K,Ishima T.A novel target of action of minocycline in NGF-induced neurite outgrowth in PC12 cells:translation initiation factor eIF4AI[J].PLoS One,2010,5(11):e15430.
[4]Plane JM,Shen Y,Pleasure DE,et al.Prospects for minocycline neuroprotection[J].Arch Neurol,2010,67(12):1442-1448.
[5]Yong VW,Wells J,Giuliani F,et al.The promise of minocycline in neurology[J].Lancet Neuro,2004,3(12):744-751.
[6]Fan X,Lo EH,Wang X.Effects of minocycline plus tissue plasminogen activator combination therapy after focal embolic stroke in type 1 diabetic rats[J].Stroke,2013,44(3):745-752.
[7]Matsukawa N,Yasuhara T,Hara K,et al.Therapeutic targets and limits of minocycline neuroprotection in experimental ischemic stroke[J].BMC Neurosci,2009,10:126.
[8]Ossola B,Lantto TA,Puttonen KA,et al.Minocycline protects SH-SY5Y cells from 6-hydroxydopamine by inhibiting both caspase-dependent and-independent programmed cell death[J].J Neurosci Res,2012,90(3):682-690.
[9]Kalonia H,Mishra J,Kumar A.Targeting neuro-inflammatory cytokines and oxidative stress by minocycline attenuates quinolinic-acid-induced Huntington′s disease-like symptoms in rats[J].Neurotox Res,2012,22(4):310-320.
[10]Chen X,Chen S,Jiang Y,et al.Minocycline reduces oxygen-glucose deprivation-induced PC12 cell cytotoxicity via matrix metalloproteinase-9,integrin β1 and phosphorylated Akt modulation[J].Neurol Sci,2013,34(8):1391-1396.
[11]Tao T,Xu G,Si Chen C,et al.Minocycline promotes axonal regeneration through suppression of RGMa in rat MCAO/reperfusion model[J].Synapse,2013,67(4):189-198.
[12]Lampl Y,Boaz M,Gilad R,et al.Minocycline treatment in acute stroke:an open-label,evaluator-blinded study[J].Neurology,2007,69(14):1404-1410.
Effects of minocycline on neurite outgrowth of PC12 cells following oxygen glucose deprivation*
TaoTao1,QinXinyue2△,FengJinzhou1,LuoHua2,LiXiaogang2
(1.DepartmentofNeurology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China;2.DepartmentofNeurology,theAffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
Objective To investigate the effects of minocycline on cell viability and neurite outgrowth of pheochromocytoma cells(PC12) after oxygen-glucose deprivation(OGD) injury.Methods PC12 cells were exposed to OGD insult for 2,4,6,8 h to establish a cerebral ischemia model in vitro.High-differentiated PC12 cells were cultivated and randomly divided into three groups:control group,OGD group and various doses of minocycline(0.1,1.0,10.0 μM) treated group.24 h after OGD-reperfusion,PC12 cells viability was assessed by CCK-8 assay,the neurite was labeled with MAP-2 by immunofluorescence and neurite length was measured by the Image-Pro Plus 7.0 software,GAP-43 protein expression was determined by Western blotting.Results Compared to the OGD groups,minocycline induced a concentration-dependent increase in cells viability[(46.1±2.9)%vs.(77.0±2.5)%,P<0.01],improved neurite outgrowth and increased the expression of GAP-43 protein in PC12 cells after OGD injury([(0.34±0.04)vs.(2.11±0.10),P<0.01].Conclusion Minocycline could protect against oxygen glucose deprivation injury and promote neurite outgrowth.This finding suggests minocycline may be a novel therapy for cerebral ischemia.
neurite outgrowth;minocycline;oxygen glucose deprivation;PC12 cell
10.3969/j.issn.1671-8348.2015.05.009
四川省卫生计生委资助项目(140032);泸州市科技计划项目(2014S4506);泸医附院青年基金(博士)资助项目(14046)。作者简介:陶涛(1984-),讲师,博士,主要从事脑血管疾病的基础与临床研究。△
,E-mail:qinxinyue2011@sina.com。
R743.31
A
1671-8348(2015)05-0605-03
2014-10-12
2014-12-15)

