小鼠子宫蜕膜基质细胞促进树突状细胞的增殖
李 娜 高美华
(青岛大学医学院免疫学教研室,山东青岛266071)
小鼠子宫蜕膜基质细胞促进树突状细胞的增殖
李 娜 高美华
(青岛大学医学院免疫学教研室,山东青岛266071)
目的建立小鼠子宫蜕膜基质细胞(DSC)和小鼠骨髓来源的树突状细胞(DC)细胞共培养体系,探讨DSC对DC增殖的影响。方法应用白细胞介素-4(IL-4)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)诱导小鼠骨髓细胞分化为DC,FACS检测细胞表面分子和细胞增殖,ELISA检测其分泌的细胞因子,构建DSC和DC共培养体系模型,动态观察DSC对DC增殖的影响。结果小鼠骨髓来源DC高表达CD11c,共刺激分子CD80和CD86,MHCⅡ类分子Ia和MHCⅠ类分子H-2Kb。经LPS刺激的DC分泌细胞因子IL-12(p70)、IL-6、TNF-α和IL-1β的水平明显上调(P<0.05),并能够促进抗原肽特异性T淋巴细胞增殖反应能力(P<0.05)。在DSC和DC共培养10天后观察到DSC明显促进DC增殖。结论小鼠子宫蜕膜基质细胞能够促进树突状细胞的增殖能力。
蜕膜基质细胞;树突状细胞;共培养;细胞增殖
妊娠是一个复杂的生理过程,母体免疫系统不排斥同种异基因移植物的胚胎,且保护其正常发育、直至分娩,是母胎免疫耐受建立的体现,表明母体对胚胎存在着精细的免疫应答和免疫调控机制。母胎耐受与母胎界面细胞组成有关,母胎界面细胞组成相当复杂,根据其来源大致可分为三类:第一类是蜕膜免疫活性细胞(decidual immunocompetent cell,DIC);第二类为蜕膜基质细胞(decidual stromal cell,DSC)及蜕膜腺上皮细胞(decidual epithelial cell, DEC);第三类为侵入蜕膜的绒毛外滋养细胞(extravillous cytotrophoblast,EVCT)。妊娠早期,母体内大量的免疫细胞迁移至子宫蜕膜,参与维持母胎免疫耐受和抗感染免疫。DSC具有广泛的生物学功能,除参与蜕膜营养供应外,还能分泌多种激素、细胞因子和酶类,表达孕激素受体,调节胚泡着床及参与胎盘形成[1-3]。机体免疫应答反应的主体是免疫细胞,而树突状细胞(dendritic cells,DC)作为专职抗原提呈细胞是免疫应答的中心环节[4-5]。因此研究母胎界面细胞微环境对DC生物学功能的影响对生殖免疫学具有重要意义。
1 材料与方法
1.1 材料
1.1.1 主要试剂小鼠重组IL-4、GM-CSF购自PerproTech公司,分装(10 ng/μl),-80°C保存备用。RPMI1640完全培养基由RPMI1640(PAA Laboratories)、10%胎牛血清(PAA Laboratories)组成,4℃保存备用;LPS购自Sigma公司;小鼠抗兔PRL单克隆抗体购自武汉博士德生物工程有限公司,即用型免疫组化超敏SABC试剂盒,DAB显色试剂盒,抗体稀释液及PBS缓冲液购自中山生物技术开发有限公司;I型胶原酶、胰蛋白酶、透明质酸酶和DMEM+F12培养基均购自Gibco公司;mIL-12 (p70)、mIL-6、mTNF-α和mIL-1 ELISA检测试剂盒均购自R&D公司;抗CD4磁珠,抗CD11b磁珠和抗CD11c磁珠均购自Miltenyi Biotec;荧光素标记的大鼠抗小鼠单抗CD4、CD8a、CD11b、CD11c、CD40、CD80、CD86、Ia、H2-Kb、以及同型对照抗体和7-AAD均购自eBioscience公司。
1.1.2 主要仪器流式细胞仪(BD FACS calibur),Auto MACS为德国Miltenyi Biotec公司,全波长多功能酶标仪(Tecan),磁珠分选器(MACS QuadroMACS),冷冻离心机(Thermo,Multifuge× 1R),生物安全柜(NUAIRE),CO2培养箱(力康,HF240),超低温冰箱(Thermo,FORMA 700),倒置显微镜(Olympus,1×2-SLP)。
1.1.3 实验动物C57BL/6(H-2Kb)近交系小鼠,1~6周,雌性;由北京维通利化实验动物技术有限公司提供。MHCⅡ类分子限制的OVA323-339抗原肽特异的TCR转基因B6.Cg-Tg(TcraTcrb)425Cbn/J (H-2Kb)小鼠即OT-Ⅱ,4~6周,雌性;C57BL/6-Tg (CAG-EGFP)131Osb/LeySopJ(H-2Kb)小鼠即GFP小鼠,4~6周,雌性;购自Jackson Laboratory(Bar Harbor,ME),饲养于泰山医学院SPF级的动物房中。
1.2 方法
1.2.1 小鼠骨髓来源的树突状细胞的培养颈椎脱臼法处死C57BL/6小鼠,无菌取股骨,冲洗出骨髓细胞,加Tris-NH4Cl裂解液室温作用3~5分钟,溶除去红细胞,Hanks液洗二次,收集细胞。用含10%胎牛血清的RPMI-1640培养基配制成1×106/ ml的细胞悬液,接种于6孔培养板,加rmGM-CSF 10 ng/ml、rmIL-4 1 ng/ml,每孔4 ml。置在37℃、5%CO2、饱和湿度的培养培养箱中培养3天后,吸弃培养基及悬浮细胞,重新加入新鲜RPMI1640完全培养基及mGM-CSF、mIL-4,继续培养3天后,加入低剂量的LPS(10 ng/ml),2天后,收集悬浮细胞即为富集的骨髓来源的树突状细胞(bone marrowderived dendritic cell,BMDC),经CD11c单抗磁珠标记后,过MiniMACS分选柱,去除阴性细胞,收集的阳性细胞为CD11c+DC。
1.2.2 形态学观察和电镜分析光学相差显微镜动态观察DC培养过程中形态学变化,收取第8天DC,用PBS(0.01 M,pH7.2)轻轻离心洗涤一遍,用新鲜配置的固定剂(2%多聚甲醛+2%的戊二醛)固定后,电镜观察DC的超微结构。
1.2.3 细胞表面表型分析收集培养体系中不同发育阶段的细胞,用PBS悬浮为1×106细胞/ml,加入离心管,100 μl/管,分别加入荧光标记抗体包括CD11c、CD86、CD40、CD80、Ia、CD40、H-2Kb,终浓度为2 μg/ml,置4℃标记30分钟,PBS洗2遍,以荧光标记的同型Ig作为对照;用流式细胞仪检测,Cell Quest软件分析。
1.2.4 细胞因子的检测1 ml 1×106培养6天DC中加入10 ng LPS或PBS对照,48小时后收集培养上清,按ELISA试剂盒说明,检测其中IL-12 (p70)、IL-6、TNF-α和IL-1 β的水平。
1.2.5 CD4+T细胞制备无菌分离OT-Ⅱ小鼠脾脏;用无菌针芯将脾脏磨碎,经400目钢网滤过并收集单细胞;Tris-NH4Cl裂解红细胞,PBS洗涤2遍; CD11c和CD11b磁珠4℃标记15 min;AutoMACS阴性选择;收集阴性细胞,再用CD4磁珠4℃标记15 min,AutoMACS阳性选择,收集的阳性细胞为CD4+T细胞。
1.2.6 DC刺激抗原肽特异性T细胞增殖反应取OT-Ⅱ小鼠CD4+T细胞,用含OVA323~339抗原肽200 nM的培养基配成2×106/ml的细胞悬液(反应细胞);收取第8天DC用RPMI1640完全培养基配成2×105/ml的细胞悬液(刺激细胞);分别将刺激细胞和反应细胞按1:10混合并加入96孔圆底培养板共培养5天。同时取OT-Ⅱ小鼠CD4+T细胞单独培养作为对照组。共培养5天细胞后弃上清,加入含有CD4-FITC和7-AAD的标记液,10 μl/孔,4℃标记15 min,然后补液体至200 μl,FACS高速上样40秒,计活细胞数。
1.2.7 蜕膜基质细胞培养及鉴定妊娠第6~8天时C57BL/6孕鼠,取出子宫剥除胎盘和胎鼠取得蜕膜组织,小鼠蜕膜基质细胞细胞培养按文献进行[6],免疫组化鉴定催乳素染色呈阳性为DSC。
1.2.8 DC与DSC的共培养预先将小鼠蜕膜基质细胞接种24孔培养板,分别接种GFP来源的第8天DC,置37℃,5%CO2饱和湿度的培养箱中培养,每2天半量换液,光学相差显微镜动态观察共培养过程DC的增殖情况。
1.3 统计学分析
采用PEMS3.1软件进行数据统计分析,组间比较采用方差分析,两两比较采用q检验,以P≤0.05为有统计学意义。各实验组每次实验使用5只 C57BL/6小鼠,同样的实验重复3次。
2 结果
2.1 小鼠骨髓树突状细胞形态学变化培养过程中每天2次观察细胞的形态,在2~3天时见有树突状细胞集落形成,第4~5天,且有部分树突状细胞从集落脱落下来,悬浮于培养基中,到第5~8天,有大量树突状细胞悬浮。LPS刺激后,典型的树突状细胞为低密度大细胞,圆形或不规则形,表面有丰富的伸长的毛刺,悬浮不贴壁(图1)。电镜分析示DC有大量伸展的突起,有不规则形核,胞浆中线粒体丰富。

图1 光学显微镜下小鼠骨髓树突状细胞形态学变化
2.2 小鼠骨髓树突状细胞表面分子的检测培养了6天的树突状细胞接受LPS刺激后2天,树突状细胞高水平表达特异性标志CD11c,表达MHCⅠ类分子、MHCⅡ类分子中共刺激分子CD40、CD80、CD86(图2)。
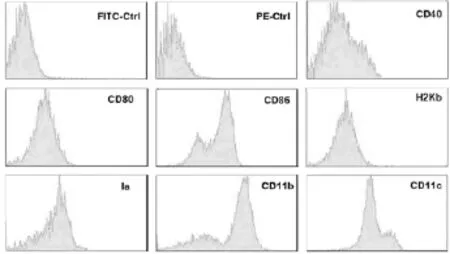
图2 LPS刺激后第8天的树突状细胞表型
2.3 小鼠骨髓树突状细胞细胞因子的检测培养了6天的树突状细胞接受LPS刺激后2天,分泌IL-1 β、IL-6、TNF-α和IL-12(p70)水平均明显上调(P<0.05)(图3)。

图3 LPS刺激后第8天的树突状细胞上清中IL-1、IL-6、TNF和IL-12(p70)的水平
2.4 小鼠骨髓树突状细胞刺激抗原肽特异性CD4+T细胞的增殖DC能刺激OVA323-339抗原肽特异反应的CD4+T淋巴细胞增殖(图4),表明树突状细胞具有抗原提呈功能。

图4 树突状细胞刺激抗原肽特异性T细胞增殖反应
2.5 树突状细胞在常规培养液中不能长期存活培养了8天的GFP小鼠树突状细胞,在体外常规培养基培养5天后,细胞开始死亡,10天几乎全部死亡,小鼠骨髓树突状细胞不能在体外长期存活(图5)。
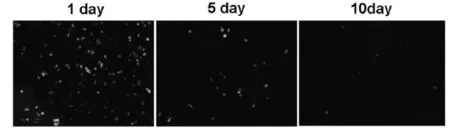
图5 树突状细胞不能在体外长期存活
2.6 小鼠蜕膜基质细胞培养小鼠蜕膜基质细胞贴壁生长,呈较细长的成纤维型和不规则的内皮型,核呈卵圆形,位于细胞中央,核仁清晰,有丰富的胞质颗粒。DSC具有合成催乳素的特性,合成的催乳素存在于胞质内,可用此特性鉴定DSC。免疫组化显示催乳素染色呈阳性,染色特点为胞质内可见细小的棕色颗粒,且越近胞核染色越深。2.7子宫蜕膜基质细胞支持骨髓来源的树突状细胞增殖既然DC在常规培养基中培养体外不能长期存活,那么在DC与DSC共培养体系中,DC是否能够存活并增殖呢?实验结果发现体外共培养DC与DSC 5天后,DC仍能存活并有少量增殖;共培养10天后,小鼠子宫蜕膜基质细胞能够明显促进树突状细胞的增殖(图6)。

图6 小鼠子宫蜕膜基质细胞能够促进树突状细胞的增殖(200×)
3 讨论
目前,体外培养的基质细胞是研究微环境的重要模型,原代培养基质细胞可能有别于体内基质细胞组分,不能完全模拟体内微环境的复杂性。所以,在蜕膜基质细胞进行体外培养过程中应尽量保存其原有组织细胞组分,使体外培养细胞的模式与生理状态下基本相似,这需要建立一个稳定的DSC体外培养体系,为模拟母胎界面微环境提供一个体外研究模型。母胎耐受与母胎界面细胞组成有关[7-10],DC作为专职抗原提呈细胞(APC)是免疫应答的中心环节和诱导免疫耐受的重要细胞,因此要研究树突状细胞在母胎免疫耐受中的作用,建立DC体外培养技术获得足够数量的有功能的DC就显得非常重要。DC通过形态学特征、组合性细胞表面标志分子和能否刺激初始型T细胞增殖等多个方面加以综合判断,即具有典型树突状形态、膜表面高表达MHCⅡ类分子、能移行至淋巴器官和刺激初始型T细胞增殖活化,并具有一些相对特异性表面标志的一类细胞,才能称为树突状细胞。本研究应用IL-4和GM-CSF诱导培养的骨髓来源的DC,光镜下为低密度大细胞,圆形或不规则形,表面有丰富的伸长的毛刺,悬浮不贴壁。电镜分析显示DC有大量伸展的突起,有不规则形核,胞浆中线粒体丰富。发现DC高水平表达CD11c、MHC分子和共刺激分子。DC接受LPS刺激后,分泌IL-12(p70)和促炎因子水平增强,并能够促进抗原肽特异性T淋巴细胞增殖反应,符合DC的生物学特性。
近年来免疫微环境与免疫细胞的相互作用成为免疫学研究的热点。曹雪涛等发现成熟DC并非终末细胞,在脾脏基质微环境下通过Fibronectin和TGF-β的作用可以分化为一种免疫表型独特的新型树突状细胞亚群,通过释放NO可显著抑制T细胞的增殖以发挥免疫调控作用[11]。O’Neill及Randolph的工作亦证实免疫微环境可影响DC的发育,Svensson等则用成纤维细胞和巨噬细胞组成的脾脏基质细胞诱导造血前体细胞分化为分泌IL-10的CD11cloCD45RB+调节性DC[12],这些结果表明在免疫微环境的影响下DC的分化可能会成为机体一种重要的免疫调节方式。本实验建立了以妊娠早期子宫蜕膜基质细胞为主体的免疫微环境/树突状细胞相互作用的体外研究模型,发现妊娠早期子宫DSC能够支持骨髓来源的GM-CSF和IL-4诱导培养了8天的CD11c+树突状细胞的生长,可使DC发生大量的增殖。那么,DSC为主体的微环境诱导增殖的DC具有何种免疫调节功能呢,这需要在相应的实验模型中进一步深入研究。本研究有助于深刻理解机体是如何调控免疫应答、维持自身的稳定,为诠释妊娠过程中耐受形成提供新思路。
[1]Shechter R,London A,Schwartz M.Orchestrated leukocyte recruitment to immune-privileged sites:absolute barriers versus educational gates[J].Nat Rev Immunol,2013,13(3):206-218.
[2]Erlebacher A.Immunology of the maternal-fetal interface[J].Annu Rev Immunol,2012,31:387-411.
[3]Guo PF,Du MR,Wu HX,et al.Thymic stromal lymphopoietin from trophoblasts induces dendritic cell-mediated regulatory TH2 bias in the decidua during early gestation in humans[J].Blood,2010,116(12):2061-2069.
[4]Artis D,Spits H.The biology of innate lymphoid cells[J].Nature,2014,517:293-301.
[5]Kambayashi T,Laufer TM.Atypical MHC class II-expressing antigen-presenting cells:can anything replace a dendritic cell[J]?Nat Rev Immunol,2014,14:719-730.
[6]徐英萍,王家富,李伟,等.小鼠子宫蜕膜基质细胞原代培养[J].中国组织工程研究与临床康复,2008,25(12):4887-4890.
[7]Xu Y,He H,Li C,et al.Immunosuppressive effect of progesterone on dendritic cells in mice[J].J Reprod Immunol,2011,91(1-2):17-23.
[8]Matthiesen L,Kalkunte S,Sharma S.Multiple pregnancy failures: an immunological paradigm[J].American Journal of Reproductive Immunology,2012,67:334-340.
[9]Azzaoui I,Yahia SA,Chang Y,et al.CCL18 differentiates dendritic cells in tolerogenic cells able to prime regulatory T cells in healthy subjects[J].Blood,2011,118:3549-3558.
[10]He Y Y,He X J,Guo P F,et al.The decidual stromal cells-secreted CCL2 induces and maintains decidual leukocytes into Th2 bias in human early pregnancy[J].Clinical Immunology,2012,145:161-173.
[11]Zhang M,Tang H,Guo Z,et al.Splenic stroma drives mature dendritic cells to differentiate into regulatory dendritic cells[J].Nat Immunol,2004,5:1124-1133.
[12]Svensson M,Maroof A,Ato M,et al.Stromal cells direct local differentiation of regulatory dendritic cells[J].Immunity,2004,21(6):805-816.
The mouse decidual stroma cells inducing the proliferation of dendritic cells in vitro
LI Na GAO Mei-hua
(Dept.of Immunology,Medical College of Qingdao University,Qingdao 266071,China)
Objective:To investigate the effects of decidual stroma cell(DSC)on the proliferation of dendritic cells (DC)by developing a co-culture system with the two cells.Methods:Cells isolated from the mice bone marrow were cultured with GM-CSF and IL-4 cytokines,then cell surface markers and cell proliferation were detected by FACS,and cytokines were assayed by ELISA.Moreover,we developed a co-culture system with DSC and DC,and dynamically observed the effects of DSC on the proliferation of DC.Results:Bone marrow derived DC expressed high levels of CD11c,CD80,CD86,MHC-II,and MHC-I molecules.The secretion of IL-12(p70),IL-6,TNF-α and IL-1 were increased significantly treated by LPS(P<0.05),and the ability to stimulate antigen specific T cell proliferation was also enhanced(P<0.05).In addition,the proliferation of DC was increased after we cocultrued DSC and DC for 10 days.Conclusion:The proliferation of DC increases when induced by the mice DSC in vitro.
decidual stroma cell;dendritic cell;coculture;cell proliferation
R392
A
1004-7115(2015)05-0481-05
10.3969/j.issn.1004-7115.2015.05.001
2015-01-08)
国家自然科学基金项目(30872322)。
李娜(1981-),女,山东潍坊人,主治医师,在读硕士生,主要从事生殖免疫学研究。
高美华,E-mail:meihuagao66@163.com。

