隐丹参酮对骨髓来源巨噬细胞功能的影响
游 艳, 周 春, 李翠限, 李 东, 邵薇薇, 彭 锦, 李婉贞, 刘培庆, 沈晓燕,2
(1. 中山大学药学院药理与毒理学实验室,广东 广州 510006;2.复旦大学药学院药理学教研室,上海 201203)
隐丹参酮对骨髓来源巨噬细胞功能的影响
游 艳1, 周 春1, 李翠限1, 李 东1, 邵薇薇1, 彭 锦1, 李婉贞1, 刘培庆1, 沈晓燕1,2
(1. 中山大学药学院药理与毒理学实验室,广东 广州 510006;2.复旦大学药学院药理学教研室,上海 201203)
目的 研究隐丹参酮对骨髓巨噬细胞功能的影响。方法 激光共聚焦检测巨噬细胞吞噬功能;庆大霉素保护法检测巨噬细胞杀菌能力;q-PCR法检测TNF-α、IL-6、IL-10的表达水平;Western blot检测NF-κB通路;LPS(lipopolysaccharides)及IL-4刺激检测巨噬细胞分型。结果 隐丹参酮能够增强巨噬细胞吞噬功能及杀菌能力;促进抗炎因子IL-10并抑制促炎因子TNF-α及IL-6的表达;阻断NF-κB信号通路;诱导巨噬细胞向M2型分化。结论 隐丹参酮能促进巨噬细胞向M2型分化,并上调骨髓巨噬细胞的免疫功能。
隐丹参酮;巨噬细胞;吞噬;杀菌;TNF-α;分化
中药丹参是唇形科鼠尾草植物丹参(salviamiltiorrhizabunge)的干燥根及根茎,有活血化瘀的功效,临床上用于治疗心血管疾病,如冠心病、缺血性脑血管疾病等。隐丹参酮[(R)-1, 2, 6, 7, 8, 9-Hexahydro-1, 6, 6-trimethyl-phenanthro (1,2-b)furan-10, 11-dione, cryptotanshinone, CTS]是中药丹参的脂溶性成分之一,属二萜醌类化合物,具有抗氧化、抗肿瘤活性[1-2]。Tang等[3]发现CTS可抑制ERK1/2、p38MAPK等MAPKs,这部分解释了CTS发挥抗炎作用的机制。众所周知,巨噬细胞是机体不可或缺的抗原呈递细胞,通过吞噬病原微生物、呈递抗原及产生多种细胞因子参与机体免疫应答。巨噬细胞按照极化类型可统分为两种,M1型和M2型。机体免疫功能多样性的需要导致了巨噬细胞极化分型的产生,M1 / M2型比例的改变,可反映局部组织的微环境炎症状态。
本研究拟通过测定骨髓来源巨噬细胞功能相关指标,即:吞噬能力、杀菌能力及分泌TNF-α、IL-6、IL-10等细胞因子能力,研究CTS对巨噬细胞功能的影响,并在巨噬细胞极化的两种条件下,研究CTS对巨噬细胞分型的影响,以期进一步解释CTS发挥抗菌消炎作用的具体机制,为治疗多种免疫疾病提供新的治疗方案。
1 材料与方法
1.1 材料
1.1.1 动物与试剂 CTS、荧光微球及LPS购自美国Sigma-Aldrich公司;人源重组巨噬细胞集落刺激因子M-CSF、IL-4购自Peprotech公司;DMEM、胎牛血清、抗生素购自Gibco公司;TRIzol、引物购自于Invitrogen公司;逆转录试剂盒、Real-time PCR试剂盒购自TaKaRa公司,抗体p65、GAPDH、β-actin、IκB购自CST公司。FVB纯系小鼠, 8~10周, 体质量22~25 g,购自中山大学实验动物中心。
1.1.2 仪器 双人单面超净工作台(苏州净化设备有限公司);二氧化碳培养箱(Thermo Electron);PL303型电子天平(Mettler Toledo);激光共聚焦系统(Zeiss 710,ZEISS);定量PCR仪(BIORAD)。
1.2 方法
1.2.1 小鼠骨髓巨噬细胞的制备与培养 将小鼠颈椎脱臼处死,于75%酒精中浸泡3~5 min,剪下股骨,剥离肌肉,用1ml注射器将骨髓冲出,过筛,1 000×g离心5 min,弃上清,台盼蓝染色计数活细胞>0.95,用含10%血清的RPMI 1640培养液调整细胞浓度至1×108个cell·L-1,并加入10-5mg·L-1M-CSF,种板,于5%CO2,37℃孵箱中培养7 d,每2天换1次液。
1.2.2 吞噬实验 接种细胞于含有玻片的小皿中,分3组,M-CSF刺激7 d后,无血清培养12 h,根据文献[4],采用10 μmol·L-1CTS预处理后3或6 h,预冷的PBS洗涤3次,根据使用说明加入荧光微球,于冰上放置5 min后,置于37℃孵箱孵育30 min,激光共聚焦系统拍照。
1.2.3 庆大霉素保护实验 接种细胞于12孔板,分两组,即control组及CTS组,每组3个复孔。 CTS处理6 h后,参照Laroux FS[5]法进行。步骤如下:细菌与细胞按10 ∶1比率于37℃共同孵育1 h;弃去培养液,用100 mg·L-1庆大霉素作用1 h,清除胞外细菌;随后,改用10 mg·L-1庆大霉素37℃分别孵育2、6、24 h,于相应时间点,收集细胞裂解液。即:PBS洗涤细胞3次,用0.5%的Triton X-100室温裂解15 min,用无菌PBS稀释不同倍数,涂皿,37℃倒置24 h,计数菌落数。
1.2.4 TNF-α、IL-6,IL-10的测定方法 采用实时定量PCR(real time PCR)。接种细胞于6孔板,于d 8用10 μmol·L-1CTS分别处理3和6 h后,加入1 mg·L-1LPS刺激15 min,提细胞总RNA,进行RT-PCR。具体操作方法按照TaKaRa试剂盒说明书进行。Real Time PCR反应体系为:RNase Free dH2O 8.5 μl;上下游引物各1 μl;SYBY Premix Ex Taq II 12.5 μl;cDNA模板2 μl。反应程序:95 ℃,5 min;95 ℃,30 s,60 ℃,30 s(40个循环)。
1.2.5 Western blot检测细胞蛋白变化 按照1.2.4种细胞于6孔板,采用不同剂量的CTS作用6 h,给予1 mg·L-1LPS刺激15 min后,用预冷PBS洗涤2次,提核蛋白和总蛋白,分别用Bradford法和BCA法定量。分装蛋白,SDS-PAGE电泳。5 %脱脂牛奶室温封闭1 h,4℃孵育一抗过夜。d 2回收一抗,TBST洗3次,每次5 min。室温孵育二抗(1 ∶10 000)1 h,TBST洗3次,显影。显影结果采用Quantity One软件进行半定量分析。
1.2.6 巨噬细胞分型检测 采用实时定量PCR。接种细胞于6孔板,于d 8用10 μmol·L-1CTS预处理6 h后,在两种不同的极化条件下[6],即:LPS(1 mg·L-1)作用3 h或IL- 4(10-5mg·L-1)作用24 h,提细胞总RNA,进行RT-PCR,检测巨噬细胞各分型marker的表达情况,具体操作方法参见1.2.4。
1.3 统计学分析实验数据采用SPSS 13统计软件进行统计处理。采用单因素方差分析进行统计学分析。两两比较用q检验。
2 结果
2.1 CTS对巨噬细胞吞噬功能的影响吞噬识别是巨噬细胞发挥功能的前提,本研究首先检测CTS对巨噬细胞吞噬功能的影响。由Fig 1可见,在有CTS作用下,小鼠骨髓巨噬细胞吞噬功能有上调趋势。经10 μmol·L-1CTS处理后,与对照组相比,巨噬细胞的吞噬功能增强,即单个细胞吞噬的荧光微球增多。说明CTS可促进巨噬细胞吞噬外源异物。
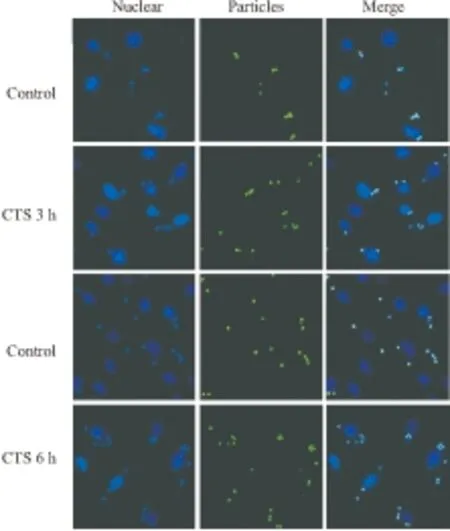
Fig 1 Effect of CTS on the phagocytosis of bio-particles
For fluorescence microscopic observation of phagocytosis, bone marrow macrophages were seeded at 2×105cells/well in 8-well Lab-Tek chamber glass slides and incubated over night in complete medium. The wells were washed with phosphate-buffered saline (PBS), fluorescent particles were added and the slides were observed using fluorescence microscopy at the indicated times. Experiments showed that numbers of particles phagocytosed by single cell were increased in the presence of CTS.
2.2 CTS对巨噬细胞杀菌能力的影响已证实CTS可以促进巨噬细胞吞噬异物,进一步研究CTS对巨噬细胞清除胞内异物能力的影响。由Fig 2可知,10 μmol·L-1CTS预处理6 h,可明显增强巨噬细胞杀菌功能,差异有显著性。
2.3 CTS对小鼠骨髓巨噬细胞分泌TNF-α、IL-6、IL-10的影响巨噬细胞的重要功能之一是分泌细胞因子,本研究进一步检测了主要由巨噬细胞分泌的几种细胞因子。由Fig 3发现,LPS刺激15 min,可显著升高TNF-α、IL-6(P<0.01),并抑制IL-10(P<0.01)的表达。与LPS组相比,CTS处理组IL-10表达明显上调(P<0.01),而TNF-α和IL-6的表达明显下调(P<0.01),且CTS处理时间越长,这种作用越明显。结果表明,CTS可抑制LPS诱导的巨噬细胞分泌的促炎因子的表达。
2.4 CTS对巨噬细胞NF-κB通路的影响NF-κB通路在炎症反应等病理过程中发挥重要作用,调控某些炎性因子如IL-6、TNF-α的活性,因此本实验检测IκB蛋白水平以及p65入核情况。由Fig 4A发现,10 μmol·L-1CTS可有效抑制LPS诱导的P65入核(P<0.01)。同时,Fig 4B表明LPS引起的IκB降解被CTS逆转,且这种作用呈剂量依赖性。

Fig 2 Effect of CTS on the killing ability of bone marrow macrophages
2.5 巨噬细胞分型检测大量研究表明,M2型巨噬细胞主要发挥抗炎功能,因此本研究下一步检测CTS是否影响巨噬细胞极化。LPS和IL-4可分别诱导巨噬细胞向M1型和M2型分化。已知精氨酸酶1(Arg1)、CD206及CD163是M2型的标志[7],而iNOS2、TNF-α、IL-6是M1型特异性标志,因此作为本实验的研究指标。由Fig 5A可知,CTS预处理6 h能够有效抑制巨噬细胞向M1型分化,这一结果与2.3相符合。从Fig 5B可看出,先给与CTS,可增强巨噬细胞对IL-4的反应性。与IL-4组相比,CTS处理组Arg1、CD163、CD206表达大幅度增加,差异均有意义。

Fig 3 Effect of CTS on the expression of TNF-α, IL-10 and IL-6 released from bone marrow macrophages
Measurement of TNF-α, IL-6 and IL-10 secretion by q-PCR after treatment with LPS for 15 min in the presence or absence of CTS for 3 h and 6 h.**P<0.01vsnormal control;##P<0.01vsmodel control.
3 讨论
巨噬细胞是机体重要的免疫细胞,通过吞噬病原微生物、呈递抗原,在抵抗细菌入侵、防止机体感染、抗肿瘤等方面发挥重要作用[8-10]。 巨噬细胞根据其功能可以分为两种极化类型,即:经典活化的M1型和替代活化(选择性活化)的M2型。前者可由IFN-γ、LPS等诱导产生,主要分泌一些促炎因子,如TNF-α、IL-12、IL-1β等,在炎症反应初期发挥宿主免疫功能,常见表面标志有HLA-DR、CD197。后者可由IL-4、IL-10及IL-13诱导形成,不分泌或低分泌促炎因子,主要降低炎症反应、促进组织修复,在炎症反应后期发挥重要作用,其特异性表面标志有CD163、CD206、CD209等。不同微环境下,这两种极化类型可发生转换,从而呈现出不同的功能。因此,深入研究巨噬细胞分型的具体机制,对理解多种免疫相关疾病的发生发展并提出治疗方案具有重要意义。
CTS是丹参的主要脂溶性成分之一,在治疗心血管疾病方面得到广泛应用。相对于其它药理作用,目前尚未见关于CTS对巨噬细胞功能方面的报道。本研究证实CTS能够促进巨噬细胞吞噬并清除病原微生物,抑制炎症因子TNF-α和IL-6表达的同时促进抗炎因子IL-10的表达,这与之前报道相符合[3]。此外,本研究发现CTS可影响巨噬细胞极化平衡,明显促进巨噬细胞向M2型分化。NF-κB信号途径是调控炎症因子表达的关键途径,最新研究表明这一信号途径也是M2型巨噬细胞的关键调节因子[11]。我们据此推测,CTS的上述药理活性很可能是通过抑制NF-κB信号途径实现的。
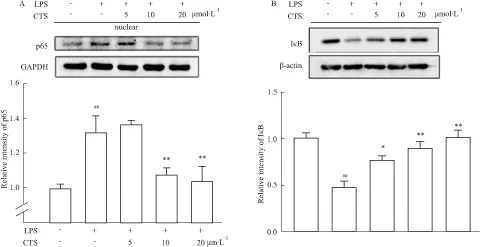
Fig 4 Effect of CTS on the NF-κB signaling pathways
A: Detection of the amount of p65 in the nuclei by western blot after treatment with LPS for 15 min in the presence or absence of CTS for 6 h.##P<0.01vsnormal control;**P<0.01vsthe group treated with LPS only;B: Detection of IκB after treatment with LPS for 15 min in the presence or absence of CTS for 6 h.##P<0.01vsnormal control;*P<0.05,**P<0.01vsthe group treated with LPS only

Fig 5 Effect of CTS on the polarization of bone marrow macrophages
A: Measurement of TNF-α, IL-6 and iNOS2 secretion by q-PCR after treatment with LPS for 3 h in the presence or absence of CTS for 6 h.**P<0.01vsnormal control;##P<0.01vsthe group treated with LPS only; B: Measurement of Arg1, CD206 and CD163 secretion by q-PCR after treatment with IL-4 for 24 h in the presence or absence of CTS for 6 h.**P<0.01vsnormal control;##P<0.01vsthe group treated with IL-4 only
已有研究表明M1 / M2平衡失调在多种疾病,如肿瘤、心血管疾病、肥胖中广泛存在,直接影响着这些炎症性疾病的发生发展。如在肾脏、消化道等疾病发病过程中巨噬细胞M1 / M2比例升高,此时清除M1,活化M2型巨噬细胞成为消除炎症、修复损伤的有效手段。目前已用于应用的有治疗胃肠道疾病的罗格列酮[12],抗肥胖的替米沙坦[13]等。因此,以M2为靶点的药物研发已成为目前的研究热点。
综上所述,CTS可增强巨噬细胞免疫功能,其抗菌消炎作用可能与其影响巨噬细胞极化过程有关。同时,研究结果表明CTS可用于干预巨噬细胞极化,扭转巨噬细胞已偏移的极化平衡,将有可能从新的角度在多种免疫相关性疾病中发挥重要作用。
[1] 毛 莹, 袁 媛, 何希荣, 等. 不同元素对丹参毛状根生长及丹参酮类成分积累的影响[J]. 中国实验方剂学杂志, 2009, 11(15): 6.
[1] Mao Y, Yuan Y, He X R, et al. The effects of different element on the growth of salvia miltiorrhiza hairy roots and the accumulate of tanshinones in salvia miltiorrhiza[J].ChinJExperimentalTraditMedFormul, 2009, 11(15): 6.
[2] Wu C Y, Hsieh C Y, Huang K E, et al. Cryptotanshinone down-regulates androgen receptor signaling by modulating lysine-specific demethylase 1 fuction[J].IntJCancer, 2012, 131(6):1423-34.
[3] Tang S, Shen X Y, Huang H Q, et al. Cryptotanshinone suppressed inflammatory cytokines secretion in RAW264.7 macrophages through inhibition of the NF-κB and MAPK signaling pathways[J].Inflammation, 2011, 34(2):111-8.
[4] 孟 茜. 隐丹参酮对IGF-1促PCI2细胞存活的作用及机制探讨[J]. 中国实验方剂学杂志, 2013, 19(10):195-7.
[4] Meng Q. Influence and possible mechanisms of Cryptotanshinone on the survival of PCI2 cells promoted by IGF-1[J].ChinJExperimentalTraditMedFormul, 2013, 19(10):195-7.
[5] Laroux F S, Romero X, Wetzler L, et al. Cutting edge: MyD88 controls phagocyte NADPH oxidase function and killing of gram-negative bacteria[J].JImmunol, 2005, 175(9):5596-6000.
[6] Byles V, Covarrubias AJ, Ben-Sahra I, et al. The TSC-mTOR pathway regulates macrophage polarization[J].Natcommun, 2013, 4: 2834-42.
[7] Fujin K, Manabe I, Nagai R. Renal collecting duct epithelial cells regulate inflammation in tubulointerstitial damage in mice[J].JClinInvest, 2011, 12(9): 3425-41.
[8] Lewis C E, Pollard J W. Distinct role of macrophages in different tumor micro-environments [J].CancerRes, 2006, 66(2):605-12.
[9] Bingle L, Brown N J, Lewis C E, et al. The role of tumour-associated macrophages in tumour progression: implications for new anticancer therapies[J].JPathol, 2002, 196(3):254-65.
[10] Mosser D M. The many faces of macrophages activation[J].JLeukocBiol, 2003, 73 (2): 209-12.
[11] Martinez F O. Regulators of macrophage activation[J].EurJImmunol, 2011, 41(6):1531-34.
[12] Lefevre L, Gales A, Olangnier D, et al. Telmisartan improves insulin resistance and modulates adipose tissue macrophage polarization in high-fat-fed mice[J].PLosOne, 2010, 5(9):12828.
[13] Porta C, Rimoldi M, Raes G, et al. Tolerance and M2 (alternative) macrophage polarization are related processes orchestrated by p50 nuclear factor kappaB[J].ProcNatlAcadSciUSA, 2009, 106 (35):14978-83.
Effects of cryptotanshinone on the function of bone marrow macrophages
YOU Yan1, ZHOU Chun1, LI Cui-xian1, LI Dong1, SHAO Wei-wei1,PENG Jin1, LI Wan-zhen1, LIU Pei-qing1, SHEN Xiao-yan1,2
(1.LaboratoryofPharmacologyandToxicology,SchoolofPharmaceuticalSciences,SunYat-SenUniversity,Guangzhou510006,China;2.DeptofPharmacology,SchoolofPharmacy,FudanUniversity,Shanghai201203,China)
Aim To investigate the role of cryptotanshinone in the fuction of bone marrow macrophages. Methods The role of cryptotanshinone in phagocytosis of bacterial components and sterilization by macrophages were assessed. The levels of TNF-α, IL-6 and IL-10 were measured by q-PCR. IL-4 and LPS were used to analyze the polarization of macrophages. Finally, the NF-κB signaling pathway was evaluated by western blot. ResultsExvivoexperiments showed that cryptotanshinone could enhance both phagocytosis of bio-particles and bactericidal ability and promote the expression of anti-inflammatory factor IL-10 while inhibiting TNF-α and IL-6 in a time-dependent manner. The experiments also demonstrated that macrophages were polarized to M2 in the presence of cryptotanshinone, and this effect might attribute to the NF-κB signaling pathway. Conclusion Cryptotanshinone can effectively enhance the immune function of bone marrow macrophages.
cryptotanshinone; macrophage; phagocytosis; sterilization; TNF-α; polarization
时间:2015-3-3 11:08 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150303.1108.011.html
2014-11-15,
2014-12-25
国家自然科学基金资助项目(No 81371923,81173056);中山大学校级新药研发课题资助项目(No 36000-31650005)
游 艳(1990-),女,硕士生,研究方向:分子免疫学,E-mail: yanyou1990@ 126.com; 沈晓燕(1968-),女,教授,博士生导师,研究方向:分子免疫学、药物药理与毒理学,通讯作者,Tel: 021-65642662,E-mail: shxiaoy@fudan.edu.cn
10.3969/j.issn.1001-1978.2015.03.011
A
1001-1978(2015)03-0346-05
R-332;R284.1;R329.24;R392.12

