大鼠骨髓源神经干细胞的分离培养及鉴定*
陈晓娟 肖宗宇 潘琪 侯倩 才鼎 周有婷
脑血管病是威胁全世界人类生命健康的一类疾病,其中缺血性脑梗死作为神经系统的常见病、多发病,其发病率、病死率和致残率均很高。且随着人口结构的老龄化和吸烟人口的增加,脑血管病的发病率有进一步上升的趋势。传统的治疗方法包括药物、康复理疗和功能锻炼等,但效果均不理想。近年来,随着干细胞(Stem cells,SCs)理论的提出,不少研究者相继报道从神经组织、脂肪组织、骨髓等组织中分离并培养出了各自的干细胞,其中神经系统来源的干细胞被称之为神经干细胞(Neural stem cells,NSCs)[1]。近年来,随着神经干细胞研究的不断深入,部分研究者将骨髓基质细胞(bone marrow mesenchymal stem cells,BMSCs)成功诱导为骨髓源神经干细胞(bone marrow mesenchymal stem cells-derived neural stem cells,BMSCs-NSCs)[2]。BMSCs-NSCs的开发和应用,克服了从成体脑组织中获取神经干细胞和危险性和局限性,也避免了胚胎来源干细胞移植中存在的伦理、免疫排斥、来源有限等问题。骨髓基质细胞源性神经干细胞的移植治疗修复中枢神经系统损害成为了研究重点,这给脑梗死的细胞移植治疗带来了新思路[1-3]。因此,本研究选用Wistar大鼠骨髓基质细胞,运用含bFGF和EGF的无血清DMEM/F12培养基对其进行诱导培养,拟培养Wistar大鼠骨髓源神经干细胞,为骨髓源神经干细胞的进一步研究打下基础,现具体报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年Wistar大鼠,雄性,体重(200±50)g,购于兰州大学实验动物中心,动物合格证号:SCXK(甘)2013-0002。
1.1.2 主要试剂 DMEM/F12培养基及0.25%胰蛋白酶(购自Gibco公司)。胎牛血清(fetal bovine serum,FBS)购自Hyclone公司。B27添加剂购自Invitrogen公司。表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)购自Peprotech公司,小鼠抗Nestin抗体、兔抗GFAP抗体、小鼠抗Galc抗体购自Chemicon公司,小鼠抗MAP2抗体、兔抗β-tubulin Ⅲ抗体购自Abcam公司,兔抗CD133抗体购自Santa Cruz公司。Alexa Fluor 488山羊抗小鼠IgG、Alexa Fluor 594标记羊抗兔IgG和Alexa Fluor 488山羊抗兔IgG购自Molecular Probes公司。DAPI封片剂购自Vector Laboratories公司。
1.2 方法
1.2.1 Wistar大鼠骨髓基质细胞的分离、培养和鉴定 将所选大鼠无菌条件下取双侧股骨和肱骨,取5 mL无菌注射器,用10 mL DMEM/F12培养基冲洗骨髓腔,用吸管将骨髓组织悬液反复吹打均匀,1000 r/min,离心5 min后,以含10% FBS的DMEM/F12含血清培养基重悬,接种于25 cm2培养瓶,37 ℃、5% CO2、饱和湿度条件下培养。骨髓细胞通过直接贴壁法培养,根据大鼠骨髓基质细胞贴壁生长的特征,采用差异贴壁法,定期更换掉不贴壁的细胞,得到贴壁生长的骨髓基质干细胞,48 h后更换培养基,培养条件同前,去除未贴壁细胞,并以PBS缓冲液轻轻冲洗2遍。以后每隔72小时换液1次,待原代细胞达到90%融合后,用0.25%胰酶消化进行传代,通过传代培养进行纯化及扩增。。
1.2.2 Wistar大鼠骨髓源性神经球的诱导培养及鉴定 大鼠骨髓源性神经干细胞的培养方法采用无血清悬浮培养法,选择第四代在含血清培养基中培养呈对数生长期的贴壁骨髓基质细胞,用0.25%胰酶消化,吸管反复吹打制成单细胞悬液,以含20 ng/mL bFGF、20 ng/mL EGF及使用浓度为1∶50的B27添加剂的DMEM/F12培养基重悬,调整活细胞密度为2×105/mL,接种于25 cm2培养瓶中,置37 ℃,5% CO2、饱和湿度培养箱中培养,约2~3 d换半液1次,并添加半量bFGF、EGF、B27等生长因子。
1.2.3 Wistar大鼠骨髓源性神经球的CD133和Nestin检测 (1)选取在无血清培养基中呈悬浮生长的状态良好的大鼠骨髓源神经球,去除培养基,0.01 mol/L PBS冲洗3次,用4%多聚甲醛固定30 min;0.01 mol/L PBS冲洗3次;(2)0.3% Triton X-100破膜,室温10 min;0.01 mol/L PBS冲洗3次;(3)10%正常山羊血清封闭60 min;(4)滴加一抗:兔抗CD133(1∶200)和小鼠抗Nestin(1∶100)置湿盒中4 ℃孵育过夜,去除一抗,0.01 mol/L PBS冲洗3次;(5)滴加二抗:Alexa Fluor 594标记羊抗兔IgG(1∶200)和Alexa Fluor 488标记羊抗小鼠IgG(1∶200),37 ℃孵育1 h,去除二抗后,0.01 mol/L PBS冲洗3次;(6)用含DAPI的封片剂(H-1200,Vector Laboratories)对细胞核进行复染,并封片,荧光显微镜下观察。(7)同时设阴性对照实验,以抗体稀释液代替一抗,结果镜下不显色,为阴性结果。
1.2.4 Wistar大鼠骨髓源性神经球的分化 Wistar大鼠骨髓基质细胞在无血清培养条件下,呈球状聚集生长,选择生长状态良好的大鼠骨髓源神经球,经0.01%胰酶消化制成单细胞悬液或直接将神经球用PBS液清洗,按2×105个活细胞/mL的密度,接种于含血清培养基(DMEM/F12+10%FBS),置37 ℃,5% CO2、饱和湿度恒温培养箱培养。分化7 d后,行免疫细胞荧光检测,具体操作步骤如下:(1)去除培养基,0.01 mol/L PBS冲洗2次,用4%多聚甲醛固定30 min;0.01 mol/L PBS冲洗3次,5 min/次;(2)10%正常山羊血清封闭60 min;(3)滴加一抗:小鼠抗 GFAP(1∶500),小鼠抗 MAP-2(1∶100),小鼠抗 β-tubulin Ⅲ(1∶100),小鼠抗Galc(1∶100)置湿盒中4 ℃孵育过夜,去除一抗,0.01 mol/L PBS冲洗3次;(4)滴加二抗:Alexa Fluor 488标记羊抗小鼠IgG(1∶200)、Alexa Fluor 488山羊抗兔IgG(1∶200),37 ℃孵育1 h,去除二抗后,0.01 mol/L PBS冲洗 3次;(5)用含 DAPI的封片剂(H-1200,Vector Laboratories)对细胞核进行复染,并封片,荧光显微镜下观察。(6)同时设阴性对照实验,以抗体稀释液代替一抗,结果镜下不显色,为阴性结果。
2 结果
2.1 Wistar大鼠骨髓基质细胞的形态学观察 通过倒置相差光学显微镜观察发现,至第三代时骨髓基质细胞形态较为均一,已经得到纯化,细胞形态以长梭形为主,体积较小、大小基本一致,增殖速度较快,经多次传代其细胞形态、大小及增殖方式不会发生改变(图 1)。

图1 显微镜下第四代骨髓基质干细胞图注:细胞呈贴壁生长,梭形,交织成网,放大倍数:×200
2.2 大鼠骨髓源性神经球的诱导培养、鉴定及CD133和Nestin检测结果 DMEM/F12培养基中,大部分细胞呈悬浮生长,形成细胞球,细胞球由几个到几十个细胞组成,大部分细胞球呈圆形,随着培养时间的延长,球体内细胞数量增多,球体增大,但球体内细胞增殖速度较慢,约7~9 d传代1次。经免疫组织化学检测,所形成的细胞球呈CD133和Nesitn阳性(图2)。
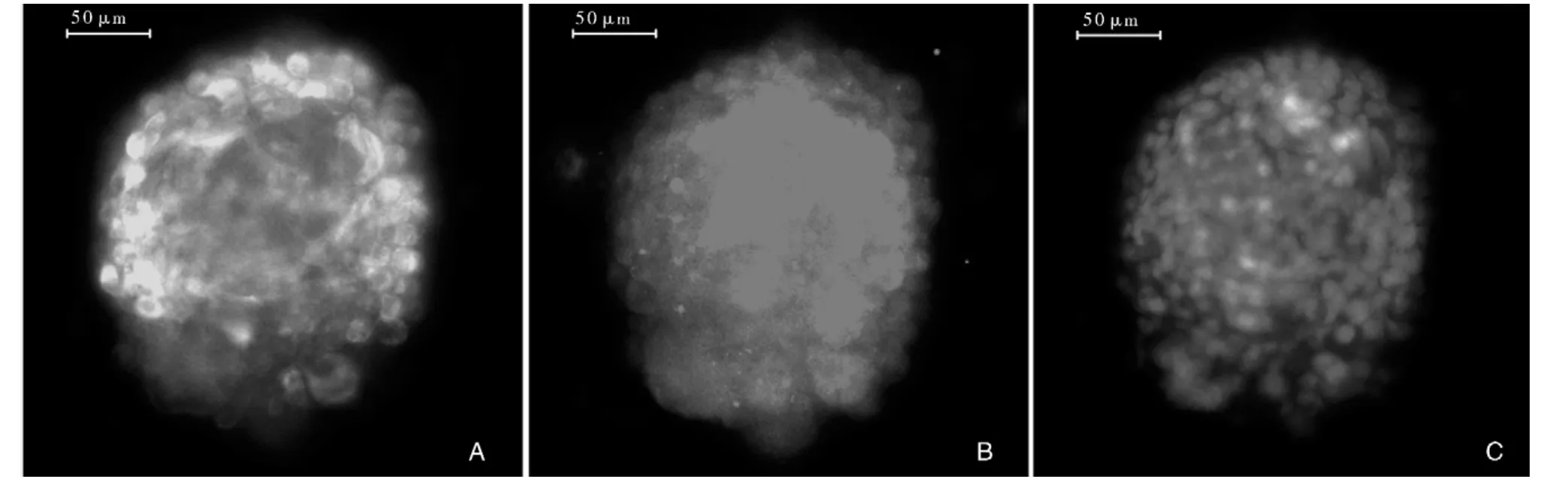
图2 显微镜下大鼠骨髓源神经干细胞图注:大鼠骨髓源神经干细胞呈Nestin(绿色、图2A)、CD133(红色、图2B)阳性,细胞核以DAPI复染(蓝色、图2C),荧光显微镜,标尺为50 μm
2.3 大鼠骨髓源神经干细胞的分化 将大鼠骨髓源神经干细胞去除生长因子,并转入含10%胎牛血清的DMEM/F12培养基培养后,其生长方式再次发生改变,不再呈悬浮生长,而是再次转为贴壁生长,单细胞及神经球很快发生贴壁,贴壁后细胞不再呈圆形,而是伸出突起,呈梭形、多角形及不规则形等,且其增殖速度较在无血清培养基中为快。分化7 d后,行免疫荧光细胞化学检测,可表达星形胶质细胞表面标志物GFAP、神经元标志物MAP-2和β-tubulin Ⅲ,少突胶质细胞表面标志物Galc。其中大部分细胞均呈GFAP阳性,少部分细胞呈MAP-2、β-tubulin Ⅲ及Galc阳性(图3)。

图3 大鼠骨髓源神经细胞球免疫荧光检测图注:大部分细胞均呈GFAP阳性(图3A),少部分细胞呈MAP-2(图3B)、Galc(图3C)及β-tubulin Ⅲ阳性(图3D),荧光显微镜放大倍数:×200
3 讨论
神经干细胞(neural stem cells,NSCs)是指分布于神经系统的,具有无限增殖、自我更新及多向分化潜能的细胞[1],最早由Reynolds等[4]分离得到并提出这一概念,以后的研究发现在中枢神经系统的多个部位存在神经干细胞,如脑室、脑室下区、中脑导水管周围等[1,5],它具备无限增殖、自我更新及多向分化潜能,其增殖方式包括对称分裂和不对称分裂两种分裂方式,通过对称分裂进行自我更新与增殖,产生两个子代神经干细胞;而通过不对称分裂产生一个神经干细胞,另一个为相对成熟的已分化细胞,通过不对称的分裂方式产生神经组织的各类细胞,如神经元细胞、星形胶质细胞和少突胶质细胞等。神经干细胞不仅存在于动物胚胎时期发育的脑组织中,在成年动物脑中也存在。神经干细胞的主要功能是作为一种后备储备,它在一定条件下可以进行增殖、迁移和分化并参与神经系统损伤修复或细胞正常死亡的更新[6-7]。但是成体中枢神经损伤后其自我再生能力有限,远远不能完成神经功能的再生修复的功能,特别是大面积受损的中枢神经组织,仅靠自身的神经干细胞修复是无法实现的。因此,采用外源性干细胞移植治疗中枢神经系统损伤成为目前治疗的主要策略之一[8-11]。
目前干细胞移植修复中枢神经系统损伤的细胞包括胚胎干细胞、神经干细胞、骨髓基质细胞、脂肪源神经干细胞、骨髓源神经干细胞等[12-13]。其中,胚胎干细胞及中枢来源的神经干细胞虽在理论上有较高的评价,但用于异体移植时有较大的免疫排斥反应,并且存在伦理上的限制,故其不适宜用于临床。脑源性神经干细胞直接从中枢神经组织取材,其来源受限,扩增培养困难;胚胎干细胞来源于发育早期阶段的胚胎,能分化成全身的所有组织细胞,是全能干细胞,但是由于伦理的限制和具有诱发同种异体免疫以及有致瘤性的可能性,目前尚无法临床推广应用。相比而言,骨髓基质细胞(bone marrow mesenchymal stem cells,BMSCs)作为移植修复治疗用细胞则具显著优势[12]。
骨髓基质细胞是一种增殖能力较强的、存在于骨髓非造血组织中的多能干细胞,它来源丰富,取材简单,培养增殖容易,并且自体移植没有伦理争议和免疫排斥的问题。在中枢神经系统损伤的细胞移植治疗研究中,骨髓基质细胞已成为较理想的种子细胞来源之一[14]。目前分离纯化骨髓基质细胞的方法主要有以下四种:全骨髓贴壁培养法、密度梯度离心法、荧光激活细胞分选(fluorescence-activated cell sorting,FACS)和磁珠分离法(magnetic-activated cell sorting,MACS)[15]。由于目前尚无BMSCs的特异性表面标志物,FACS及MACS方法的应用十分局限。袁斌等[16]研究发现,采用密度梯度离心法分离出的BMSCs增殖速度显著慢于全骨髓贴壁培养法。在本实验的预实验中,采用梯度离心法进行细胞,亦发现骨髓细胞的增殖显著慢于全骨髓贴壁法,且采用梯度离心法分离出的骨髓细胞在培养过程中其形态不规则,细胞内易出现空泡,分析原因,可能系梯度离心分离液对骨髓细胞的生物学活性有一定的抑制作用,故在本实验中,采用了全骨髓贴壁培养法。实验发现,若接种后24 h进行换液,部分骨髓基质细胞贴壁不牢,经换液时细胞量损失较大;若延期至72 h进行换液,培养基内营养成分减少,细胞培养基的酸度增大,细胞的活性会受到一定程度的抑制,因此,本实验采用首次接种后48 h换液,换液时轻轻晃动培养瓶,并采用PBS缓冲液将未贴壁的杂细胞去除,然后多次传代处理,骨髓基质细胞形态逐渐变得均一,细胞形态以长梭形为主,体积较小、大小一致、增殖速度较快,经多次传代其细胞形态及增殖方式不会发生改变。
近年来研究表明,骨髓基质细胞于体外通过诱导分化可获得骨髓源性神经干细胞[2]。无限增殖和自我更新能力是神经干细胞的主要特征之一。本实验发现,将Wistar大鼠骨髓基质细胞转入含bFGF、EGF的无血清培养基中后,其生长方式发生改变,呈悬浮或半悬浮状态,呈球状聚集生长,从生长速度来看,其增殖速度相对较慢,呈现未分化的幼稚状态。CD133和Nestin为目前公认的神经干细胞特异性标志物,通过免疫荧光检测,发现呈球状聚集生长的细胞球呈CD133和Nestin阳性。多向分化潜能是神经干细胞的另一主要特征,其可分化为中枢神经系统内神经元、星形胶质细胞、少突胶质细胞等细胞。在本实验中,将Wistar大鼠骨髓源细胞球转入含血清培养基中后,其生长方式再次发生改变,不再呈悬浮生长,而是再次转为贴壁生长,单细胞及神经球很快发生贴壁,贴壁后细胞不再呈圆形,而是伸出突起,呈梭形、多角形及不规则形等。分化7 d后,行免疫荧光细胞化学检测,大部分细胞表达星形胶质细胞表面标志物GFAP,表达星形质细胞表面标志物GFAP、神经元标志物MAP-2和β-tubulin Ⅲ,少突胶质细胞表面标志物Galc。由此可见,成年Wistar大鼠骨髓源神经细胞球具多向分化能力,具备类似神经干细胞的多向分化能力,可分化为星形胶质细胞、神经元及少突胶质细胞样细胞。
综上所述,采用含bFGF和EGF的无血清培养法,可成功将成年Wistar大鼠骨髓基质细胞诱导为骨髓源神经干细胞,这为大鼠骨髓源神经干细胞的进一步研究提供了实验基础。
[1] Breunig J J,Haydar T F,Rakic P.Neural stem cells:historical perspective and future prospects[J].Neuron,2011,70(4):614-625.
[2] Tang Y,Cui Y C,Wang X J,et al.Neural progenitor cells derived from adult bone marrow mesenchymal stem cells promote neuronal regeneration[J].Life Sci,2012,91(19-20):951-958.
[3] Wang Y Z,Plane J M,Jiang P,et al.Concise review:quiescent and active states of endogenous adult neural stem cells:identification and characterization[J].Stem Cells,2011,29(6):907-912.
[4] Reynolds B A,Weiss S.Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell[J].Dev Biol,1996,175(1):1-13.
[5] Sathananthan A H.Neural stem cells in neurospheres,embryoid bodies,and central nervous system of human embryos[J].Microsc Microanal,2011,17(4):520-527.
[6] Mothe A J,Tator C H.Review of transplantation of neural stem/progenitor cells for spinal cord injury[J].Int J Dev Neurosci,2013,31(7):701-713.
[7] Neirinckx V,Coste C,Rogister B,et al.Concise review:adult mesenchymal stem cells,adult neural crest stem cells,and therapy of neurological pathologies: a state of play[J].Stem Cells Transl Med,2013,2(4):284-296.
[8] Lu D,Li Y,Mahmood A,et al.Neural and marrow-derived stromal cell sphere transplantation in a rat model of traumatic brain injury[J].J Neurosurg,2002,97(4):935-940.
[9] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[10] Weissman I L.Translating stem and progenitor cell biology to the clinic:barriers and opportunities[J].Science,2000,287(5457):1442-1446.
[11] Volarevic V,Erceg S,Bhattacharya S S,et al.Stem cell-based therapy for spinal cord injury[J].Cell Transplant,2013,22(8):1309-1323.
[12] Luo J,Zhang H T,Jiang X D,et al.Combination of bone marrow stromal cell transplantation with mobilization by granulocyte-colony stimulating factor promotes functional recovery after spinal cord transection[J].Acta Neurochir (Wien),2009,151(11):1483-1492.
[13] Kim B G,Hwang D H,Lee S I,et al.Stem cell-based cell therapy for spinal cord injury[J].Cell Transplant,2007,16(4):355-364.
[14] Chen C J,Ou Y C,Liao S L,et al.Transplantation of bone marrow stromal cells for peripheral nerve repair[J].Exp Neurol,2007,204(1):443-453.
[15]杨进.流式细胞仪工作原理及临床应用[J].医疗设备信息,2002,2(1):15-29.
[16]袁斌,马樱,闫铭,等.大鼠骨髓基质干细胞的改良培养方法及Hoechst体外标记研究[J].细胞与分子免疫学杂志,2011,27(1):61-63.

