Cu/γ-Al2O3的制备及其对纯甘油常压氢解制备1,2-丙二醇的催化性能
安华良,范立攀,耿艳楼,赵新强,王延吉
(河北工业大学 绿色化工与高效节能河北省重点实验室, 天津 300130)
Cu/γ-Al2O3的制备及其对纯甘油常压氢解制备1,2-丙二醇的催化性能
安华良,范立攀,耿艳楼,赵新强,王延吉
(河北工业大学 绿色化工与高效节能河北省重点实验室, 天津 300130)
采用H2-TPR、XRD、CO化学吸附、N2吸附-脱附等方法表征了等体积浸渍法制备的Cu/γ-Al2O3催化剂,并评价了其催化甘油氢解制备1,2-丙二醇(1,2-PDO)反应的性能。结果表明,Cu/γ-Al2O3的适宜Cu负载量为15%(质量分数),适宜的制备条件为,采用纯H2还原、升温速率2℃/min、还原温度250℃、还原时间2 h。在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL和反应温度190℃的条件下,甘油转化率为100%,1,2-PDO选择性为92.9%;反应运行36 h,1,2-PDO选择性仍高于85%,说明Cu/γ-Al2O3催化剂的稳定性较好。Cu/γ-Al2O3催化剂表面以高分散的Cu微粒为主,Cu粒子的粒径和分散度是影响其活性的主要因素;Cu粒子的粒径越小、分散度越大,催化活性越高。甘油脱水生成丙酮醇的反应只有在酸性中心和金属共同作用下才能进行,丙酮醇加氢合成1,2-丙二醇是反应控制步骤。
甘油;氢解;铜基催化剂;1,2-丙二醇;分散度;控制步骤
1,2-丙二醇(1,2-PDO)是一种重要的化工原料,广泛用于食品、医药和化妆品工业中。1,2-PDO的工业生产普遍采用环氧丙烷水合法,虽然具有技术成熟、产物收率高等优点,但丙烯等石化原料价格的不断上涨导致生产成本较高,同时石油资源不可再生,迫切需要开发新的原料来源和合成路线。甘油是酯交换法生产生物柴油的主要副产物,每生产9 kg生物柴油就会副产1 kg甘油[1-2]。生物柴油产业的迅速发展导致甘油生产严重过剩[3]。因此,以生物质甘油为原料合成高附加值的化工产品1,2-PDO,不仅环境友好,而且有利于稳定甘油市场和延长生物柴油产业链,更重要的是可以使1,2-PDO的生产摆脱石化行业的限制。
甘油氢解制备1,2-PDO的催化剂主要有贵金属催化剂[4-6]、Ni基催化剂[7-8]和Cu基催化剂[9-16]。其中,贵金属催化剂和Ni基催化剂对C—C键断裂的催化活性较高,导致产物丙二醇的选择性较低[6-7];Cu基催化剂对于C—C键断裂的催化活性很低,但对C—O键的氢解却表现出良好的催化活性[9]。因此,在甘油氢解制备1,2-PDO的反应中,Cu基催化剂的应用最为广泛。Balaraju等[10]采用Cu-ZnO催化剂,以质量分数为20%的甘油溶液为原料,在反应温度200℃和氢压为20 MPa条件下反应24 h,得到1,2-PDO的选择性在90%以上,但甘油的转化率只有45%。Bienholz等[11]报道了Cu/SiO2催化甘油氢解制备1,2-PDO的结果。以质量分数为40%的甘油水溶液为原料,在1.5 MPa氢气和255℃下,甘油的转化率为100%,1,2-PDO的选择性为87%。Zheng等[12]使用离子交换树脂SBA-15负载Cu催化剂和固定床反应器研究了甘油氢解反应。同样采用甘油水溶液为原料,在氢压为4 MPa和255℃下进行反应,甘油转化率为96%,1,2-PDO的选择性为92.4%。郝顺利等[13]以质量分数为10%的甘油水溶液为原料、Cu/γ-Al2O3为催化剂研究了甘油氢解反应。在240℃和6 MPa氢压条件下反应6 h,得到88.4%的甘油转化率和86.2%的1,2-PDO选择性。上述研究都是在高压H2条件下进行,与低压甚至常压相比,存在对设备材质要求高、安全隐患大等缺点。此外,上述研究均使用溶剂,增加了后续分离费用。因此,研究人员在降低反应压力以及减少溶剂使用方面作了许多努力。Akiyama等[14]以Cu/γ-Al2O3为催化剂,质量分数为30%的甘油水溶液为原料,在固定床反应器中采用梯度控温方式(200℃和120℃)实现了环境压力下甘油氢解反应,甘油转化率达100%,1,2-PDO选择性为96.9%。Huang等[15]采用Cu/ZnO/Al2O3为催化剂,在固定床反应器中实现了以纯甘油为原料制备1,2-PDO的反应,避免了溶剂的使用,但96.2%的甘油转化率和92.2%的1,2-PDO选择性需要在0.64 MPa H2压力下取得;一旦H2压力降至0.1 MPa时,甘油转化率和1,2-PDO选择性分别降为93.0%和65.3%。目前尚未见到同时解决H2压力高和使用溶剂两个问题,并取得较高1,2-PDO收率的研究报道。此外,关于催化剂在甘油氢解反应中稳定性的研究也鲜有报道。郑静[16]采用固定床考察了Cu/SiO2催化剂对甘油氢解制备1,2-PDO反应的催化性能随反应时间的变化情况。结果显示,反应至120 h,甘油的转化率和1,2-PDO的选择性均下降较多,分别由开始的99.6%和88.4%下降至85%和77.8%。
郝顺利等[13]和Akiyama等[14]的研究结果表明,Cu/γ-Al2O3对于甘油氢解反应催化性能较佳,但未详细考察催化剂的制备条件及结构对其催化性能的影响。笔者采用等体积浸渍法制备了Cu/γ-Al2O3催化剂,通过优化催化剂制备条件,制得高分散的Cu/γ-Al2O3催化剂,实现了纯甘油常压加氢制备1,2-PDO,同时解决了H2压力高和使用溶剂问题。对催化剂的结构与催化性能之间的关系和甘油氢解反应历程也作了必要的讨论。
1 实验部分
1.1 原料与试剂
甘油,分析纯,利安隆博华(天津)医药化学有限公司产品;1,2-丙二醇,分析纯,天津市化学试剂有限公司产品;硝酸铜,分析纯,国药集团化学试剂有限公司产品;氢气,体积分数≥99.9%,天津市四知气体有限公司产品;γ-Al2O3,分析纯,天津市光复精细化工研究所产品。
1.2 催化剂的制备
采用等体积浸渍法制备甘油氢解用Cu/γ-Al2O3催化剂。将市售γ-Al2O3破碎至20~40目,于马福炉中300℃焙烧4 h;称取5.698 g Cu(NO3)2·3H2O配成10 mL水溶液,将其浸渍于10 gγ-Al2O3上;经老化、干燥后,于马福炉中300℃下焙烧4 h,即可得到CuO/γ-Al2O3;将制得的CuO/γ-Al2O3装填于固定床中,在常压、250℃下,通入60 mL/min H2还原2 h,即可得到Cu负载量为15%(质量分数,下同)的Cu/γ-Al2O3催化剂。
按上述方法共制备了Cu负载量分别为5%、10%、15%和20%的Cu/γ-Al2O3催化剂,分别记为0.05Cu/γ-Al2O3、0.10Cu/γ-Al2O3、0.15Cu/γ-Al2O3和0.20Cu/γ-Al2O3。采用ICP测定了Cu/γ-Al2O3催化剂中Cu的含量,得出Cu的实际负载量分别为4.7%、9.5%、14.3%和19.1%。可知Cu负载量略低于其对应的理论负载量。
1.3 催化剂的表征与评价
采用美国PerkinElmer公司Optima 7300V型电感耦合等离子体原子发射光谱仪(ICP-AES)测定催化剂的Cu含量。
采用日本理学D/MAX-2500型X射线衍射仪分析催化剂物相。Cu靶,石墨单色滤光片,狭缝SS/DS=1°,RS 0.15 mm,工作电压40 kV,电流100 mA,2θ扫描范围10°~80°,扫描速率8°/min。
采用美国Micromeritics公司ASAP2020M+C型比表面和孔隙度分析仪分析催化剂的比表面积及孔结构。试样0.2 g左右,首先在150℃下真空脱气4 h,液氮冷肼中进行N2吸附及脱附实验。
采用美国Micromeritics公司AutoChem Ⅱ 2920型化学吸附仪进行H2程序升温还原(H2-TPR)和CO化学吸附实验。
1.4 甘油氢解制1,2-PDO的反应及产物分析
在内径为8 mm的固定床反应器中进行甘油氢解反应。Cu/γ-Al2O3催化剂装填体积3 mL。反应原料甘油从反应器顶端进入,经石英砂床层预热并气化,然后进入催化剂床层进行反应。反应产物经冷却后进入储罐,每隔2 h取样分析。采用北京北分瑞利分析仪器有限责任公司SP3420A型气相色谱仪测定产物组成。PEG20M色谱柱,程序升温控制柱温,初温80℃,保持3 min,然后以10℃/min升温到220℃,保持10 min;氢火焰检测器,温度280℃;气化室温度280℃。内标法定量,以正丁醇为内标物。
2 结果与讨论
2.1 催化剂制备条件对其催化性能的影响
2.1.1 Cu负载量的影响
以H2和N2的混合气(体积比1)为还原气氛,在升温速率10℃/min、还原温度300℃和还原时间4 h的条件下,分别对0.05Cu/γ-Al2O3、0.10Cu/γ-Al2O3、0.15Cu/γ-Al2O3和0.20Cu/γ-Al2O3催化剂进行还原。然后,在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,考察了不同Cu负载量Cu/γ-Al2O3对甘油氢解的催化性能,结果列于表1。从表1可见,Cu负载量较低(5%)时,由于催化剂表面的活性中心数量不足,导致甘油的转化率和1,2-PDO的选择性均较低;随着Cu负载量的增加,甘油的转化率增至100%,1,2-PDO的选择性不断增加;当Cu负载量为15%时,1,2-PDO的选择性增加到82.1%;继续提高Cu负载量,1,2-PDO的选择性没有明显变化。所以负载量15%为该反应条件下的最佳Cu负载量。

表1 Cu负载量对Cu/γ-Al2O3催化甘油氢解反应性能的影响
1) Enthylene glycol
Reaction conditions:Pure glycerol; Atmospheric H2pressure;n(H2)/n(Glycerol)=100;3 mL of Cu/γ-Al2O3; LHSV=0.20 h-1; Reaction temperature of 190℃
2.1.2 还原升温速率的影响
在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,分别评价了还原升温速率为2、5和10℃/min时所得0.15Cu/γ-Al2O3的催化性能,结果列于表2。从表2可见,随着还原升温速率的提高,1,2-PDO的选择性呈逐渐降低的趋势,升温速率为2℃/min时,1,2-PDO的选择性最高。因此,确定0.15Cu/γ-Al2O3催化剂适宜的还原升温速率为2℃/min。
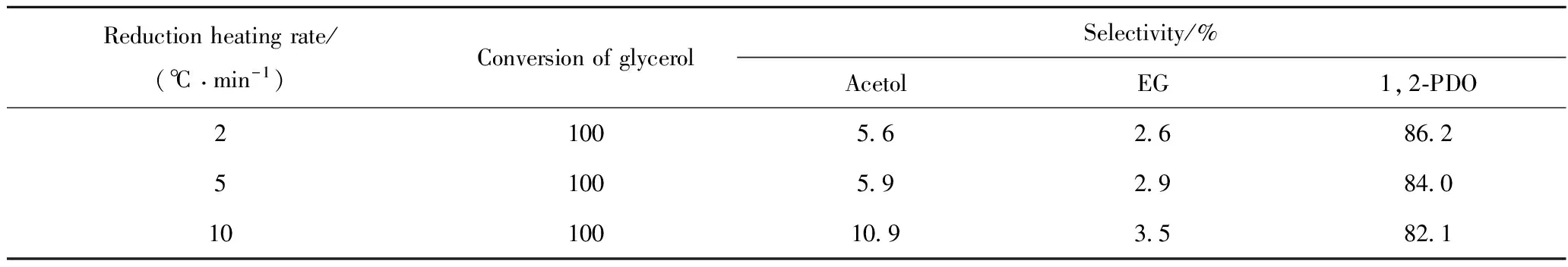
表2 还原升温速率对0.15Cu/γ-Al2O3催化甘油氢解反应性能的影响
Same legends as that in Table 1
为了分析还原升温速率对0.15Cu/γ-Al2O3催化性能的影响原因,对不同升温速率所得0.15Cu/γ-Al2O3催化剂进行了CO化学吸附表征,结果列于表3。从表3可见,随着还原升温速率的提高,催化剂表面Cu粒子的分散度逐渐减小,粒径逐渐增大,金属比表面积逐渐减小。在所考察的升温速率范围内,当还原升温速率为2℃/min时,催化剂表面金属Cu的分散度和比表面积最大,粒径最小,因此催化剂表面的有效活性中心最多,其催化活性也最高。综合分析表2和表3中所列结果可知,Cu粒子的分散度和比表面积越大、粒径越小,越有利于1,2-PDO选择性的提高。

表3 不同还原升温速率所得0.15Cu/γ-Al2O3催化剂的CO化学吸附分析结果
1)Specific surface area of Cu per gram catalyst;2)Specific surface area of Cu per gram metal
2.1.3 还原气氛的影响
在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,考察了制备0.15Cu/γ-Al2O3催化剂的还原气氛(H2和N2体积比为1的混合气、纯H2)对其催化性能的影响,结果列于表4。从表4可见,在纯H2气氛下还原所得0.15Cu/γ-Al2O3催化剂对甘油氢解反应的催化活性较高,1,2-PDO的选择性可达到90.5%。因此,选择纯H2为0.15Cu/γ-Al2O3催化剂的还原气氛。

表4 还原气氛对0.15Cu/γ-Al2O3催化甘油氢解反应性能的影响
Same legends as that in Table 1
采用CO化学吸附对不同还原气氛所得0.15Cu/γ-Al2O3催化剂进行了表征,结果列于表5。从表5可见,与混合气还原所得0.15Cu/γ-Al2O3催化剂相比,纯H2还原所得催化剂的Cu分散度及比表面积均比较大,而Cu粒子的粒径比较小。推测是由于还原过程的升温速率比较慢、还原温度比较低,纯H2还原不会引起Cu粒子的团聚。

表5 不同还原气氛所得0.15Cu/γ-Al2O3催化剂的CO化学吸附分析结果
1)Specific surface area of Cu per gram catalyst;2)Specific surface area of Cu per gram metal
2.1.4 还原温度的影响
在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,考察了0.15Cu/γ-Al2O3催化剂的还原温度(200、250和300℃)对其催化活性的影响,结果列于表6。从表6可见,0.15Cu/γ-Al2O3催化剂的还原温度由200℃升至250℃时,1,2-PDO的选择性提高;当还原温度为300℃时,1,2-PDO的选择性与还原温度为250℃时相当,为90.5%。因此,选择250℃作为0.15Cu/γ-Al2O3催化剂适宜的还原温度。

表6 还原温度对0.15Cu/γ-Al2O3催化甘油氢解反应性能的影响
Same legends as that in Table 1
对经不同还原温度还原所得0.15Cu/γ-Al2O3催化剂进行了比表面积与孔结构分析,结果表明,不同还原温度制备的催化剂的比表面积、孔体积和平均孔径非常接近,说明在所考察还原温度范围内,温度变化对催化剂的比表面积及孔结构基本没有影响。
图1为不同Cu负载量CuO/γ-Al2O3样品的H2-TPR曲线。由图1看出,0.15Cu/γ-Al2O3被还原完全的温度为245℃。当还原温度为200℃时,可能有部分CuO未被还原,因而导致催化剂活性偏低。
2.1.5 还原时间的影响
制备Cu/γ-Al2O3催化剂时采取的还原方式为升温过程中即通入H2,升温至还原温度后再保持一段时间(记为还原时间)以确保催化剂能够还原完全。为了确定适宜的还原时间,在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,考察了还原时间(0,2,4 h)对0.15Cu/γ-Al2O3催化性能的影响,结果列于表7。从表7可见,0.15Cu/γ-Al2O3催化剂的催化活性随还原时间延长,先逐渐升高后略有降低;还原时间为2 h时,1,2-PDO选择性达到最高,为92.9%。还原初始,催化剂活性组分前驱体氧化物未被完全还原,从而导致催化剂催化活性较低;还原时间为4 h时,由于还原过程生成的水蒸气具有氧化性,与已还原得到的金属接触时间过长,易造成金属的反复氧化和还原,引起晶粒长大,导致催化剂催化活性下降[17]。所以最佳的还原时间为2 h。

图1 不同Cu负载量CuO/γ-Al2O3样品的H2-TPR曲线

表7 还原时间对0.15Cu/γ-Al2O3催化甘油氢解反应性能的影响
Same legends as that in Table 1
2.2 Cu/γ-Al2O3催化剂的稳定性
在常压氢气、甘油液时空速0.20 h-1、氢气/甘油摩尔比100、催化剂装填量3 mL及反应温度190℃的条件下,考察了0.15Cu/γ-Al2O3催化甘油氢解反应的稳定性,结果示于图2。从图2可见,在整个催化剂稳定性测试过程中甘油的转化率均为100%;反应开始时,1,2-PDO的选择性比较稳定,当反应时间长于26 h时,1,2-PDO的选择性呈现出缓慢降低的趋势,与此同时丙酮醇的选择性缓慢升高,直至反应运行36 h结束,1,2-PDO的选择性仍然在85%以上。采用ICP方法测定了新鲜和回收催化剂的Cu负载量,得出Cu的质量分数分别为14.3%和12.6%。采用NH3-TPD测定了新鲜和回收催化剂的酸量,NH3的吸附量分别为3.58 mmol/g和3.85 mmol/g,可见使用后催化剂的酸量略有增加,这可能是由于活性组分Cu少量流失使得γ-Al2O3空出部分酸性位所致。因此,推测活性组分Cu的流失是反应过程中催化剂活性略有降低的原因。

图2 0.15Cu/γ-Al2O3催化甘油氢解反应的稳定性
2.3 Cu/γ-Al2O3催化剂上Cu的形态
0.05 Cu/γ-Al2O3和0.10 Cu/γ-Al2O3的H2-TPR曲线均只有1个低温还原峰(见图1),且后者的峰顶温度较低。该低温还原峰归属为高分散在载体表面的CuO微粒的还原[13,16,18],负载量低时,CuO的分散情况更好,更加稳定,因此还原温度较高[19-20]。0.15Cu/γ-Al2O3和0.20Cu/γ-Al2O3Cu的H2-TPR曲线中,除了低温还原峰外,还有1个高温还原峰,归属为较大CuO晶粒的还原[16,18]。各催化剂的H2-TPR曲线还原峰对应的耗氢量列于表8。从表8可见,随着Cu负载量的增加,低温还原峰对应的耗氢量逐渐增大,说明高分散CuO的含量逐渐增加。当Cu负载量增至20%时,低温还原峰对应的耗氢量减小,而高温还原峰对应的耗氢量迅速增大,说明由于负载量过大,CuO在γ-Al2O3表面分散不均匀,较大晶粒CuO的量增多。
图3为不同Cu负载量Cu/γ-Al2O3催化剂的XRD谱。由图3看出,当Cu负载量小于15%时,没有出现金属Cu的特征衍射峰;当Cu负载量为15%时,开始出现金属Cu的特征衍射峰(2θ=43.40°,PDF-04-0836);当Cu负载量为20%时,在2θ为43.40°、50.37°、74.24°处均出现了Cu的特征衍射峰,并且衍射峰的强度明显增大,说明当负载量过大时,容易形成较大Cu晶粒。与H2-TPR的表征结果一致。
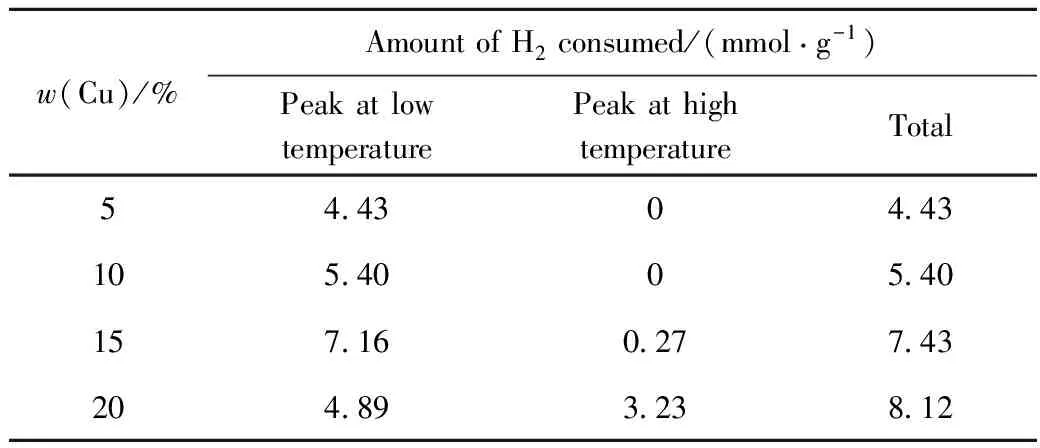
表8 不同Cu负载量Cu/γ-Al2O3的H2-TPR分析结果
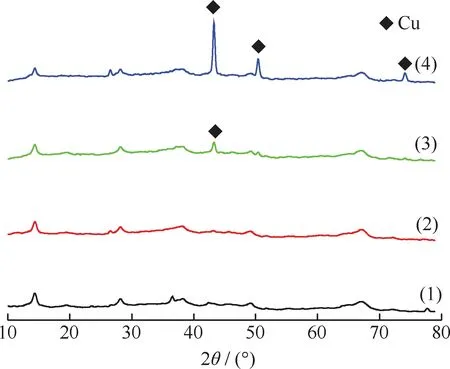
图3 不同Cu负载量Cu/γ-Al2O3催化剂的XRD谱
综合分析Cu/γ-Al2O3催化剂的活性评价结果(见表1)及其H2-TPR表征结果(见表8)发现,如果只有高分散的Cu具有催化活性,则0.15Cu/γ-Al2O3的催化活性高于0.20Cu/γ-Al2O3催化剂;如果高分散Cu和较大晶粒Cu的催化活性相当,则0.15Cu/γ-Al2O3的催化活性应低于0.20Cu/γ-Al2O3催化剂;实际实验结果是二者的催化活性相当,因此,高分散的Cu和大晶粒的Cu对甘油氢解反应都具有催化活性,且高分散Cu的催化活性明显高于大晶粒Cu的催化活性。
2.4 Cu/γ-Al2O3催化甘油氢解的反应历程
2.4.1 反应的控制步骤
普遍认为,酸性载体负载Cu催化剂催化甘油氢解制备1.2-PDO的反应按丙酮醇为中间产物的反应历程进行[14-15,21],见式(1)和式(2)。分别估算了不同温度下甘油氢解制备1,2-PDO的2个分步反应的平衡常数,结果示于图4。由图4可见,甘油脱水生成丙酮醇的热力学平衡常数K1和丙酮醇加氢生成1.2-PDO的热力学平衡常数K2均随反应温度的升高逐渐降低;在反应温度为190℃时,K1和K2分别为6.2×109和0.65,说明丙酮醇加氢为甘油氢解合成1.2-PDO反应的控制步骤。这也正是甘油氢解反应中即使氢气/甘油摩尔比较大(100),仍有部分丙酮醇没有转化为1.2-PDO的原因。

(1)

(2)

图4 甘油氢解分步反应的平衡常数随反应温度的变化
2.4.2 活性组分的作用
为了阐明甘油氢解2个分步反应具体需要的活性组分,设计实验分析了催化剂活性组分在该合成反应分步反应中的具体作用,实验方案及结果列于表9。从表9可见,无论在N2气氛,还是在H2气氛条件下,γ-Al2O3对甘油氢解反应均无催化活性。在N2气氛下,以Cu/γ-Al2O3为催化剂时,甘油的转化率为41.2%,丙酮醇的选择性为55.3%,说明甘油脱水反应需在酸性中心和金属共同作用下才能进行。赵静等[22]在研究甘油脱水生成丙酮醇反应时也给出了相同的结论。在Entry 3中,除了丙酮醇,还可以检测到少量1,2-PDO。说明在进行甘油脱水反应的同时,伴随着甘油脱氢反应,进而发生丙酮醇加氢生成1,2-PDO反应[21,23]。
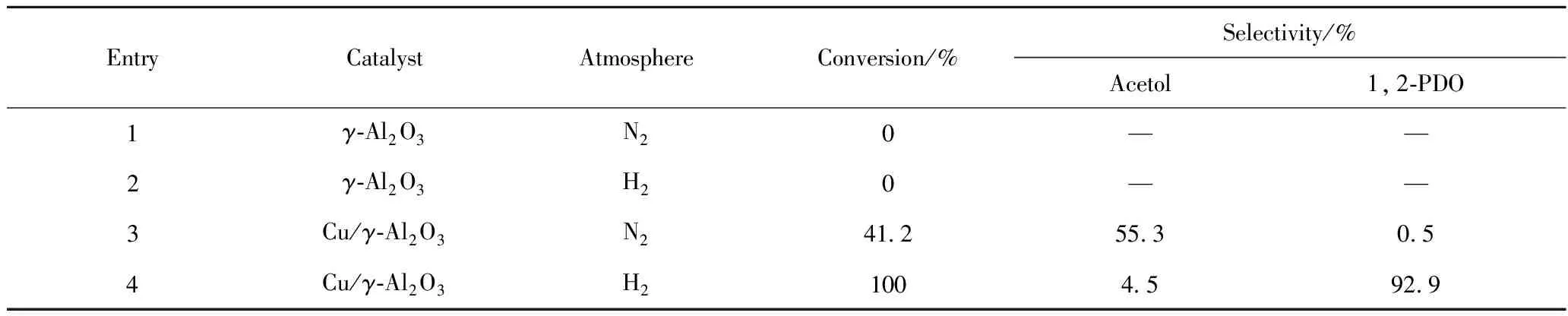
表9 活性组分在甘油氢解反应中的作用
Reaction conditions: Pure glycerol; Atmospheric pressure;n(H2or N2)/n(Glycerol)=100;V(Catalyst)=3 mL; LHSV=0.20 h-1; Reaction temperature of 190℃
比较Entry 3和Entry 4的实验结果可知,向反应体系中通入H2后,不仅生成了1,2-PDO,更重要的是甘油的转化率大大提高。甘油脱水生成丙酮醇的反应为非平衡限制反应(见图4),所以甘油转化率提高并非生成1,2-PDO消耗丙酮醇所致,可能是由于H2气氛的原因。赵静等[22]研究发现,H2在Cu0表面吸附解离原位生成了部分酸中心,这些酸中心有利于甘油转化。由此推测,在γ-Al2O3、Cu0以及H2在Cu0表面吸附解离原位生成酸中心的共同作用下,甘油高选择性地生成丙酮醇,进而加氢生成1,2-PDO。
3 结 论
以在纯H2还原、升温速率2℃/min、还原温度250℃和还原时间2 h条件下制得的Cu负载量15%的Cu/γ-Al2O3为催化剂,在常压条件下催化纯甘油氢解制备1,2-PDO反应,甘油的转化率为100%,1,2-PDO的选择性为92.9%。Cu/γ-Al2O3催化剂表面以高分散的Cu微粒为主,Cu粒子的粒径越小、分散度越大,催化活性越高。
反应历程分析结果表明,甘油脱水合成丙酮醇反应需在酸性中心和金属共同作用下才能进行,丙酮醇加氢生成1,2-PDO是甘油氢解反应的控制步骤。
[1] SUPPES G J, DASARI M A, DOSKOCIL E J, et al. Transesterification of soybean oil with zeolite and metal catalysts[J]. Applied Catalysis A: General, 2004, 257(2): 213-223.
[2] HUBER G W, IBORRA S, CORMA A. Synthesis of transportation fuels from biomass:Chemistry, catalysts, and engineering[J]. Chemical Reviews, 2006, 106(9): 4044-4098.
[3] BEHR A, EILTING J, IRAWADI K, et al. Improved utilization of renewable resources: New important derivatives of glycerol[J]. Green Chemistry, 2008, 10(1): 13-30.
[4] RODRIGUES R, ISODA N, GONCALVES M, et al. Effect of niobia and alumina as support for Pt catalysts in the hydrogenolysis of glycerol[J]. Chemical Engineering Journal, 2012, 198-199: 457-467.
[5] FURIKADO I, MIYAZAWA T, KOSO S, et al.Catalytic performance of Rh/SiO2in glycerol reaction under hydrogen[J]. Green Chemistry, 2007, 9(6): 582-588.
[6] MIWAZAWA T, KUSUNOKI Y, KUNIMORI K, et al. Glycerol conversion in the aqueous solution under hydrogen over Ru/C+an ion-exchange resin and its reaction mechanism[J]. Journal of Catalysis, 2006, 240(2): 213-221.
[7] ZHAO J, YU W Q, CHEN C, et al.Ni/NaX:A bifunctional efficient catalyst for selective hydrogenolysis of glycerol[J]. Catalysis Letters, 2010, 134(1/2): 184-189.
[8] HOSGUN H L, YILDIZ M, GERCEL H F. Hydrogenolysis of aqueous glycerol over Raney nickel catalyst: Comparison of pure and biodiesel by-product[J]. Industrial & Engineering Chemistry Research, 2012, 51(10): 3863-3869.
[9] 赵兰兰, 陈吉祥. P 对 Cu/Al2O3催化剂结构及其催化甘油氢解反应性能的影响[J]. 催化学报,2012,33(8): 1410-1416. (ZHAO Lanlan, CHEN Jixiang. Effect of phosphorus on structure and performance of Cu/Al2O3catalysts for hydrogenolysis of glycerol[J]. Chinese Journal of Catalysis, 2012, 33(8): 1410-1416.)
[10] BALARAJU M, REKHA V, SAI PRASAD P S, et al. Selective hydrogenolysis of glycerol to 1,2-propanediol over Cu-ZnO catalysts[J]. Catalysis Letters, 2008, 126(1/2): 119-124.
[11] BIENHOLZ A, HOFMANN H, CLAUS P. Selective hydrogenolysis of glycerol over copper catalysts both in liquid and vapour phase: Correlation between the copper surface area and the catalyst’s activity[J]. Applied Catalysis A: General, 2011, 391(1/2): 153-157.
[12] ZHENG J, ZHU W C, MA C X, et al. Hydrogenolysis of glycerol to 1,2-propanediol on the high dispersed SBA-15 supported copper catalyst prepared by the ion-exchange method[J]. Reaction Kinetics, Mechanisms and Catalysis, 2010, 99(2): 455-462.
[13] 郝顺利,彭伟才, 赵宁,等. 不同载体负载Cu 催化剂上甘油氢解制1,2-丙二醇催化性能的研究[J]. 燃料化学学报,2012, 40(5): 594-600. (HAO Shunli, PENG Weicai, ZHAO Ning, et al. Hydrogenolysis of glycerol to 1,2-propanediol over various supported Cu catalysts[J]. Journal of Fuel Chemistry and Technology, 2012, 40(5): 594-600.)
[14] AKIYAMA M, SATO S, TAKAHASHI R, et al. Dehydration-hydrogenation of glycerol into 1,2-propanediol at ambient hydrogen pressure[J]. Applied Cataslysis A: General, 2009, 371(1/2): 60-66.
[15] HUANG L, ZHU Y L, ZHENG H Y, et al. Continuous production of 1,2-propanediol by the selective hydrogenolysis of solvent-free glycerol under mild conditions[J]. Journal of Chemical Technology and Biotechnology, 2008, 83(12): 1670-1675.
[16] 郑静. 甘油氢解反应中铜基催化剂的研究[D]. 长春:吉林大学,2009:6.
[17] 赵光, 邓启刚. 工业催化基础[M]. 哈尔滨: 哈尔滨工程大学出版社, 1999:286.
[18] LOPEZ-SUAREZ F E, BUENO-LOPEZ A, ILLAN-GOMEZ M J. Cu/Al2O3catalysts for soot oxidation: Copper loading effect[J]. Applied Catalysis B: Environmental, 2008, 84(3/4): 651-658.
[19] 尹元根. 多相催化剂的研究方法[M]. 北京:化学工业出版社,1988:112-115.
[20] 刘钰,杨向光, 张忠良,等. 以水滑石为前体的Mg-Al-M复合氧化物对催化消除NOx的活性[J]. 催化学报,1999, 20(4):450-454. (LIU Yu, YANG Xiangguang, ZHANG Zhongliang, et al. Synthesis and characterization of composite oxide Mg-Al-M from hydrotalcite and its catalytic activity for NOxremoval[J]. Chinese Journal of Catalysis, 1999, 20(4):450-454.)
[21] WU Z J, MAO Y Z, SONG M, et al. Cu/boehmite: A highly active catalyst for hydrogenolysis of glycerol to 1,2-propanediol[J]. Catalysis Communications, 2013, 32: 52-57.
[22] 赵静, 于维强, 李德财, 等. 常压两步法催化丙三醇脱水-加氢制备1,2-丙二醇[J]. 催化学报,2010,31(2): 200-204. (ZHAO Jing, YU Weiqiang, LI Decai, et al. Catalytic dehydration-hydrogenation of glycerol to 1,2-propylene glycol at ambient hydrogen pressure[J]. Chinese Journal of Catalysis, 2010,31(2): 200-204.)
[23] HU J Y, LIU X Y, WANG B, et al. Reforming and hydrogenolysis of glycerol over Ni/ZnO catalysts prepared by different methods [J]. Chinese Journal of Catalysis, 2012, 33(8): 1266-1275.
Preparation of Cu/γ-Al2O3Catalyst and Its Catalytic Performance in Hydrogenolysis of Pure Glycerol to 1,2-Propanediol at Ambient Pressure
AN Hualiang, FAN Lipan, GENG Yanlou, ZHAO Xinqiang, WANG Yanji
(HebeiProvincialKeyLaboratoryofGreenChemicalTechnologyandEfficientEnergySaving,HebeiUniversityofTechnology,Tianjin300130,China)
The physicochemical properties of Cu/γ-Al2O3catalyst prepared by incipient impregnation method were studied by means of H2-TPR, XRD, CO chemisorption, N2adsorption-desorption measurement. The catalytic performance of Cu/γ-Al2O3for glycerol hydrogenolysis to 1,2-propanediol (1,2-PDO) was evaluated. The results showed that the suitable Cu loading of Cu/γ-Al2O3was 15%, and the suitable preparation conditions were reduction atmosphere of pure hydrogen, temperature rising rate of 2℃/min, reduction temperature of 250℃ and reduction time of 2 h. Under the reaction conditions of pure glycerol, atmospheric pressure,n(H2)/n(Glycerol)=100, Cu/γ-Al2O3volume of 3 mL, LHSV=0.20 h-1and reaction temperature of 190℃, the conversion of glycerol was 100%, and the selectivity of 1,2-PDO was 92.9%. Furthermore, the selectivity of 1,2-PDO was not less than 85% during the 36 h stability test, demonstrating that Cu/γ-Al2O3catalyst exhibited a good stable activity. In Cu/γ-Al2O3catalyst Cu particles were highly dispersed on the surface ofγ-Al2O3. The particle size and dispersion of Cu were the main factors influencing the catalytic performance of Cu/γ-Al2O3. The smaller the particle size and the higher the dispersion of Cu, the better the catalytic performance of Cu/γ-Al2O3was. The conversion of glycerol to acetol required both acid sites and metal sites, and the hydrogenation of acetol to 1,2-PDO was the rate controlling step of glycerol hydrogenolysis to 1,2-PDO.
glycerol;hydrogenolysis;copper-based catalyst;1,2-propanediol;dispersion;rate-controlling step
2014-01-09
国家自然科学基金项目(21236001和21076059)、天津市自然科学基金项目(12JCYBJC12800)和河北省应用基础研究计划重点基础研究项目(12965642D)资助
安华良,男,博士研究生,从事绿色过程工程与工艺方面的研究
赵新强,男,教授,从事绿色过程工程与工艺方面的研究;Tel:022-60202427;E-mail:zhaoxq@hebut.edu.cn
1001-8719(2015)03-0711-09
TQ032
A
10.3969/j.issn.1001-8719.2015.03.015

