右美托咪定联合丙泊酚在机械通气患者中的应用
胡子龙,张志成,李大伟,帅维正,邹剑峰
右美托咪定联合丙泊酚在机械通气患者中的应用
胡子龙,张志成,李大伟,帅维正,邹剑峰
目的 探讨在机械通气患者镇静中应用咪达唑仑、丙泊酚及丙泊酚联合右美托咪定的有效性及安全性。方法 纳入2012年3月-2014年9月海军总医院ICU机械通气时间>24h的患者76例,随机分为3组,即咪达唑仑组(n=23)、丙泊酚组(n=27)和右美托咪定联合丙泊酚组(n=26),分别采用相应药物对患者进行镇静。统计各组患者总评估次数中达到Richmond烦躁-镇静评分(RASS)目标分值和达到非言语疼痛评估表(CPOT)目标分值的比例,采用ICU患者意识模糊评估表(CAM-ICU)评估谵妄阳性比例,比较各组机械通气时间,分析各组镇静有效性,统计心血管不良事件比例、控制通气比例、每日平均动脉压以及心率极差。结果 右美托咪定+丙泊酚组达到RASS评分目标分值的比例(86.54%)高于咪达唑仑组(69.32%,P<0.05),但与丙泊酚组(79.37%)比较差异无统计学意义。右美托咪定+丙泊酚组达到CPOT评分目标分值的比例(63.1%)高于咪达唑仑组(51.2%,P<0.05)和丙泊酚组(49.5%,P<0.05),而后两组之间差异无统计学意义。右美托咪定+丙泊酚组谵妄阳性、控制通气比例、机械通气时间均低于咪达唑仑组和丙泊酚组(P<0.05)。三组心血管不良事件比例、平均动脉压极差、心率极差等比较差异均无统计学意义(P>0.05)。结论 在机械通气患者镇静治疗中应用右美托咪定联合丙泊酚的有效性及安全性优于单独应用咪达唑仑或丙泊酚。
呼吸,人工;催眠药和镇静药;二异丙酚;咪达唑仑
呼吸衰竭是ICU危重症患者的常见疾病,除了针对原发病的病因治疗外,应用机械通气进行生命支持的对症治疗也是重要措施。由于机械通气的非生理性、侵入性,常导致患者与机械通气治疗的冲突。因此,镇静在机械通气过程中具有重要作用。然而,当前临床应用的镇静药物较多,在镇静过程中的安全性及有效性各不相同。本研究对3种不同镇静药物的安全性及有效性进行评估,以期为机械通气患者镇静药物的选择提供依据。
1 资料与方法
1.1 研究对象 纳入2012年3月-2014年9月海军总医院ICU收治的年龄>18岁、观察前机械通气时间<12h、预计机械通气时间>24h且需要进行持续镇静治疗的患者。排除标准:妊娠、中枢神经系统疾病、急性肝炎或重症肝病(Child-Pugh分级C级)、痴呆或心理疾病、神经肌肉疾病、需进行肾脏替代治疗的肾功能不全、应用血管活性药物仍无法维持血压的休克、基础心率小于55次/min或未安装起搏器存在Ⅲ度房室传导阻滞的患者。
1.2 一般资料 共纳入76例患者,将其随机分为3组:咪达唑仑组(n=23)、丙泊酚组(n=27)、右美托咪定联合丙泊酚组(n=26)。各组患者的基础资料及一般情况见表1。
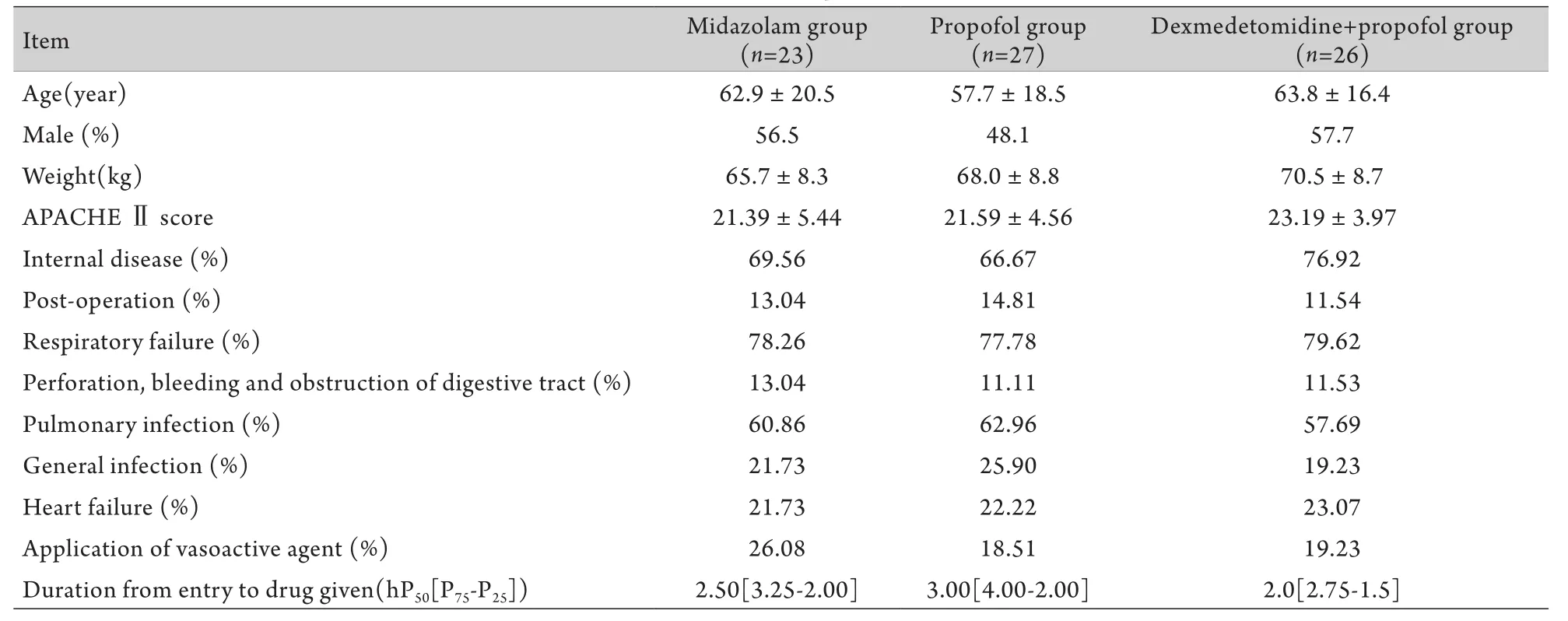
表1 各组患者的一般资料Tab.1 General data of patients enrolled
1.3 方法 咪达唑仑组以0.06mg/(kg.h)为维持剂量,调整剂量0.01~0.05mg/(kg.h);丙泊酚组以2.5~10µg/(kg.min)为维持剂量,调整剂量5µg/ (kg.min);右美托咪定+丙泊酚组以右美托咪定0.2µg/(kg.h)、丙泊酚2.5µg/(kg.min)为维持剂量,从0.2µg/(kg.h)开始逐步调整右美托咪定剂量,直至总量为1µg/(kg.h)。若仍无法达到镇静效果,以5µg/(kg.min)增加丙泊酚维持剂量。镇静方面,各组目标为Richmond烦躁-镇静评分(Richmond agitation-sedation scale,RASS)-2~+1[1]。镇痛方面,以非言语疼痛评估表(critical care pain observation tool,CPOT)评分0~1分为目标,未达镇痛目标时应用芬太尼50µg/h微量泵入镇痛,以10µg/h调整维持剂量。治疗期间每日对达镇静目标的患者完成一项日常唤醒评估,要求患者完成4项遵嘱运动(根据声音命令睁眼,眼光追随研究人员,握拳及伸舌),在此期间应用ICU患者意识模糊评估表(CAMICU量表)对患者进行谵妄评定[2]。
1.4 观察指标 每4h评估镇静、镇痛效果,根据效果增加或减少镇静、镇痛维持剂量。收集当时RASS评分、CPOT评分,机械通气是否为控制模式,是否存在心血管不良事件,若评估当时患者(平均动脉压-基础平均动脉压)/基础平均动脉压和(或)(心率-基础心率)/心率>15%,即评定为存在心血管不良事件。每日收集患者平均动脉压、心率极差,是否存在谵妄以及机械通气时间。以停用镇静药物、死亡或持续镇静镇痛至研究第7天定义为观察终点,至观察终点时,统计每组评估过程中RASS评分及达到目标镇静评分、CPOT评分达到目标镇痛评分次数,谵妄阳性例数,控制通气次数以及心血管不良事件次数占总评估次数的比例。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析。计量资料以±s表示,多组间比较采用方差分析,进一步两两比较采用q检验(Newman-Keuls 法);计数资料以率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 有效性评估 至观察终点,咪达唑仑组进行RASS评分、CPOT评分、是否为控制通气模式和心血管不良事件共414次,丙泊酚组378次,右美托咪定+丙泊酚组260次。咪达唑仑组评估是否存在谵妄共115次,其中因当日RASS评分无法达到目标评分,无法评估谵妄18次;丙泊酚组评估是否存在谵妄81次,因上述原因无法评估谵妄11次;右美托咪定+丙泊酚组评估是否存在谵妄52次,因上述原因无法评估谵妄4次。
2.1.1 RASS评分 咪达唑仑组达RASS量表目标镇静分值287次,<–2分85次,>+1分42次;丙泊酚组达到目标镇静分值300次,<–2分42次,>+1分36次;右美托咪定+丙泊酚组达目标镇静分值225次,<–2分85次,>+1分42次(图1)。咪达唑仑组达目标镇静分值的次数占总评估数的69.32%,丙泊酚组为79.37%,右美托咪定+丙泊酚组为86.54%,咪达唑仑组与其他两组比较,差异有统计学意义(P<0.05),而丙泊酚组与右美托咪定+丙泊酚组之间差异无统计学意义(表2)。

图1 各组RASS评分结果Fig.1 Comparison of RASS assessment in each group
2.1.2 CPOT评分 3组患者均存在加用芬太尼微量泵入镇痛的情况,咪达唑仑组平均每人每日芬太尼微量泵入剂量为24.30±6.70µg/h,丙泊酚组为23.53±6.43µg/h,右美托咪定+丙泊酚组为24.46±7.35µg/h,3组间差异无统计学意义(P>0.05)。3组达CPOT量表目标镇痛分值的次数:咪达唑仑组为212次,丙泊酚组为187次,右美托咪定+丙泊酚组为164次,其中右美托咪定+丙泊酚组与前两组比较差异均有统计学意义(P<0.05),而咪达唑仑组与丙泊酚组之间差异无统计学意义(表2)。
2.1.3 谵妄 咪达唑仑组谵妄阳性次数42次,丙泊酚组32次,右美托咪定+丙泊酚组10次。右美托咪定+丙泊酚组与前两组比较差异有统计学意义(P<0.05),而前两组之间差异无统计学意义(表2)。
2.1.4 机械通气时间 咪达唑仑组机械通气时间为105.95±31.71h,丙泊酚组为89.55±24.66h,右美托咪定+丙泊酚组为51.92±27.77h,各组之间差异均有统计学意义(P<0.05,表2)。
2.2 安全性评估
2.2.1 控制通气比例 右美托咪定+丙泊酚组控制通气次数(92次)明显少于咪达唑仑组(201次)和丙泊酚组(176次),差异有统计学意义(P<0.05),但咪达唑仑组与丙泊酚组之间差异无统计学意义(P>0.05,表2)。
2.2.2 心血管不良事件比例 咪达唑仑组发生心血管不良事件52次(12.56%),丙泊酚组33次(8.73%),右美托咪定+丙泊酚组20次(7.92%),3组之间差异无统计学意义(P>0.05)。咪达唑仑组平均动脉压极差(26.34±7.41mmHg)、心率极差(26.69±4.69 次/min)与丙泊酚组(分别为27.43±8.70mmHg和25.37±5.87次/min)和右美托咪定+丙泊酚组(分别为24.57±8.12mmHg和25.84±5.48次/min)比较差异均无统计学意义(P>0.05)。
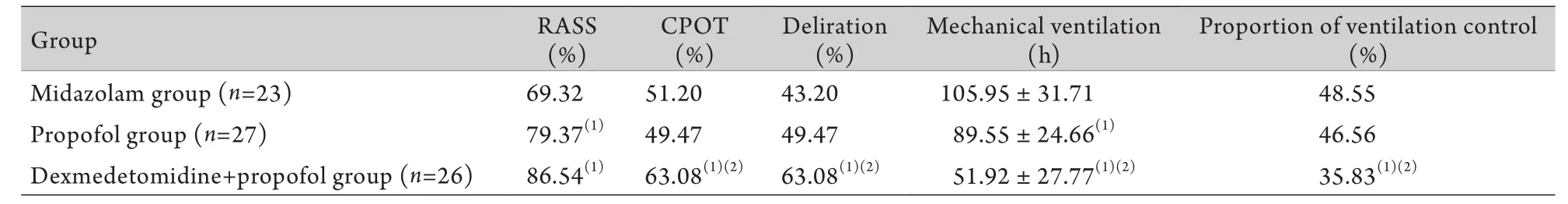
表2 各组有效性及安全性指标评估Tab.2 Assessment of effectiveness and safety data
3 讨 论
当前人口老龄化问题日渐严重,如何改善甚至纠正多器官功能衰竭已成为重症医学科面临的严峻问题。呼吸衰竭是重症患者常见的器官功能障碍之一,肺部感染、慢性阻塞性肺疾病急性发作、感染性休克、颅脑损伤等多种肺内、肺外疾病均可导致呼吸衰竭。机械通气的发明及进步使呼吸衰竭患者的生存率及生存期大为改善,但同时人机对抗、呼吸机相关性肺炎、呼吸机相关性肺损伤等一系列因应用机械通气而产生的问题也亟待医务工作者们关注和解决[3]。
大部分呼吸衰竭患者在应用机械通气时存在烦躁不合作的情况,其原因主要包括原发病因素、机械通气因素及环境因素等,从而进一步阻碍机械通气应用的协同[4-5]。研究显示,这种烦躁不合作的精神状态会导致上述多种机械通气并发症的发生,并增加脱管风险[6-7]。因此,在积极治疗原发病以及应用机械通气纠正呼吸衰竭症状的同时,应用镇静、镇痛措施缓解患者的烦躁、疼痛、谵妄亦是机械通气治疗中不可分割的一部分。
目前临床上有多种镇静药物应用于机械通气中,这些药物可增加患者与机械通气的协同性,减少多种机械通气并发症的发生,但过量的镇静药物可导致不良反应增多,对呼吸、循环系统造成抑制,从而引发或加重呼吸机相关性肺炎以及循环灌注不足,影响机械通气患者的预后[8-9]。所以,应用各种量表评价镇静效果,维持机械通气患者处于浅镇静状态是镇静治疗策略中的核心问题[10]。目前临床常用的镇静药物主要有咪达唑仑、丙泊酚和右美托咪定[11-13],但上述药物特点各不相同,选用何种镇静药物以及采用怎样的治疗剂量能够安全有效地达到镇静目标,至今仍未有统一标准[14]。
本研究从有效性及安全性方面对咪达唑仑、丙泊酚及右美托咪定+丙泊酚3组镇静策略进行分析。结果显示,丙泊酚组、右美托咪定+丙泊酚组维持浅镇静的效果优于咪达唑仑组,其原因为咪达唑仑半衰期明显长于其他两种药物,量效反应周期较长,不易通过镇静量表达到及时调控。镇痛方面,有研究显示在应用芬太尼镇痛剂量无差异的前提下,右美托咪定+丙泊酚组的效果优于咪达唑仑组及丙泊酚组,考虑与右美托咪定独特的药理作用及其对镇痛药物的协同作用有关[12,15-16]。目前文献明确指出,与谵妄发生呈正相关的因素包括预先存在的老年痴呆症、高血压和(或)酗酒史、入院时较高的疾病严重程度,此外,苯二氮类的使用也可能是诱发谵妄的危险因素[17-20]。虽然目前未有明确证据提示右美托咪定能预防谵妄的发生[21-22],但有研究指出应用右美托咪定镇静的患者中出现谵妄的概率较低[17,20],与本研究结果相同。不同于咪达唑仑和丙泊酚,右美托咪定对呼吸的抑制较轻,减少了镇静药物对患者呼吸功能恢复的阻碍。因此右美托咪定+丙泊酚组患者机械通气时间、控制通气比例均低于应用咪达唑仑及丙泊酚的患者[17,20-21,23]。有文献观察到应用右美托咪定会发生低血压[24],但在本研究中并没有观察到此种现象,本研究中,3组镇静药物对患者的循环系统均产生了一定影响,但并无明显差异,这与Venn等[25]关于右美托咪定应用负荷剂量可能是导致血压剧烈下降的主要原因的观点一致。
综上所述,我们认为右美托咪定因其不同于其他镇静药物的药理作用,呼吸抑制轻、谵妄发生少的特点,在以浅镇静为目标的镇静治疗策略中具有较好的安全性和有效性。近期较多文献也阐述了同样的观点。但需指出的是,这些文献的观察对象多为外科术后患者,尤其是心血管外科术后患者,且多为单独应用右美托咪定对比其他镇静药物[24]。由于部分文献描述应用右美托咪定镇静的过程中无法达到镇静效果,需要加用其他药物[26-27],结合在临床上对右美托咪定镇静作用的观察,我们认为右美托咪定的镇静效果低于其他镇静药物,因此本研究选择了联合丙泊酚进行镇静治疗,结果显示基于右美托咪定本身的药物特点,与丙泊酚联合应用在机械通气患者镇静治疗中的效果优于其他镇静药物。
[1]Sessler CN, Gosnell MS, Grap MJ, et al. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients[J]. Am J Respir Crit Care Med, 2002, 166(10): 1338-1344.
[2]Ely EW, Inouye SK, Bernard GR, et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit.(CAM-ICU)[J]. JAMA, 2001, 286(21): 2703-2710.
[3]Cox CE, Martinu T, Sathy SJ, et al. Expactations and outcomes of prolonged mechanical ventilation[J]. Crit Care Med, 2009, 37(11): 2888-2894.
[4]Kress JP, Hall JB. Sedation in the mechanically ventilated patient[J]. Crit Care Med, 2006, 34(10): 2541-2546.
[5]O'Brien JM, Philips GS, Ali NA, et al. The association between body mass index processes of care, and outcomes from mechanical ventilation: A prospective cohort study[J]. Crit Care Med, 2012, 40(5): 1456-1463.
[6]Chanques G, Jaber S, Barbotte E, et al. Impact of systematic evaluation of pain and agitation in an intensive care unit[J]. Crit Care Med, 2006, 34(6): 1691-1699.
[7]Girard TD, Shintani AK, Jackson JC, et al. Risk factors for posttraumatic stress disorder symptoms following critical illness requiring mechanical ventilation: a prospective cohort study[J]. Crit Care, 2007, 11(1): R28.
[8]Patel SB, Kress JP. Sedation and Analgesia in the mechanically ventilated patient[J]. Am J Respir Crit Care Med, 2012, 185(5): 486-497.
[9]Jackson DL, Proudfoot CW, Cann KF, et al. The incidence of suboptimal sedation in the ICU: a systematic review[J]. Crit Care, 2009, 13(6): R204.
[10]Treggiari MM, Romand JA, Yanez ND, et al. Randomized trial of light versus deep sedation on mental health after critical illness[J]. Crit Care Med, 2009, 37(9): 2527-2534.
[11]Shehabi Y, Bellomo R, Reade M, et al. Sedation Practise in Intensive Care Evaluation (SPICE) Study Group and the ANZICSCTG: Early intensive care sedation predicts long-term mortality in mechanically ventilated critically ill patients[J]. Am J Resp Crit Care Med, 2012, 186(8): 724-731.
[12]Gerlach AT, Dasta JF. Dexmedetomidine: An updated review[J]. Ann Pharmacother, 2007, 41(2): 245-252.
[13]Tan JA, Ho KM. Use of dexmedetomidine as a sedative and analgesic agent in critically ill adult patients: A meta-analysis[J]. Intensive Care Med, 2010, 36(6): 926-939.
[14]Mehta S, McCullagh I, Burry L. Current sedation practices: lessons learned from international surveys[J]. Crit Care Clin, 2009, 25(3): 471-488.
[15]Szumita PM, Baroletti SA, Anger KE, et al. Sedation and analgesia in the intensive care unit: evaluating the role of dexmedetomidne[J]. Am J Health Syst Pharm, 2007, 64(1): 37-44.
[16]McCutcheon C, Orme R, Scott D, et al. A comparison of dexmedetomidine versus conventional therapy for sedation and hemodynamic control during carotid endarterectomy performed under regional anesthedsia[J]. Anesth Analg, 2006, 102(3): 668-675.
[17]Riker RR, Shehabi Y, Bokesch PM, et al. SEDCOM(Safety and Eifficacy of Dexmedetomidne Compared With Midazolam) Study Group: Dexmedetomidine vs midazolam for sedation of critiacally ill patients: A randomized trial[J]. JAMA, 2009, 301(5): 489-499.
[18]Pisani MA, Murphy TE, Araujo KL, et al. Benzodiazepine and opioid use and the duration of intensive care unit delirium in an older population[J]. Crit Care Med, 2009, 37(1): 177-183.
[19]Van Gool WA, Van de Beek D, Eikelenboom P. Systemic infection an delirium: When cytokines and acetylcholine collide[J]. Lancet, 2010, 27(9716): 773-775.
[20]Shehabi Y, Grant P, Wolfenden H, et al. Prevalence of delirium with dexmedetomidine compared with morphine based therapy after cardiac surgery: A randomized controlled trial(Dexmedetomidine Compared to Morphine-DEXCOM Study)[J]. Anesthesiology, 2009, 111(5): 1075-1084.
[21]Pandharipande PP, Pun BT, Herr DL, et al. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients: The MENDS randomized controlled trial[J]. JAMA, 2007, 298(22): 2644-2653.
[22]Ruokonen E, Parviainen I, Jakob SM, et al. Dexmedetomidine versus propofol/midazolam for long-term sedation during mechanically ventilation[J]. Intensive Care Med, 2009, 35(2): 282-290.
[23]Jakob SM, Ruokonen E, Grounds RM, et al. Dexmedetomidine for long-term sedation investigators: Dexmedetomidines vs midazolam or propofol for sedation during prolonged mechanical ventilation: Two randomized controlled trials[J]. JAMA, 2012, 307(11): 1151-1160.
[24]MacLaren R, Forrest LK, Kiser TH. Adjunctive dexmedetomidine therapy in the intensive care unit:a retrospective assessment of impact on sedative and analgesic requirements,levels of sedation and analgesia, and ventilatory and hemodynamic parameters[J]. Pharmacotherapy, 2007, 27(3): 351-359.
[25]Venn M, Newman J, Grounds M. A phase II study to evaluate the efficacy of dexmedetomidine for sedation in the medical intensive care unit[J]. Intensive Care Med, 2003, 29(2): 201-207.
[26]Reade MC, O'Sullivan K, Bates S, et al. Dexmedetomidine vs haloperidol in delirious, agitated, intubed patients: a randomised open-label trial[J]. Crit Care, 2009, 13(3): R75.
[27]Wunsch H, Kahn JM, Kramer AA, et al. Use of intravenous infusion sedation among mechanically ventilated patients in the United States[J]. Crit Care Med, 2009, 37(12): 3031-3039.
The use of dexmedetomidine combined with propofol in mechanically ventilated patients
HU Zi-long, ZHANG Zhi-cheng, LI Da-wei, SHUAI Wei-zheng, ZOU Jian-feng
Department of Intensive Care Unit, Navy General Hospital of PLA, Beijing 100048, China
ObjectiveTo estimate and compare the efficacy and safety of midazolam, propofol and dexmedetomidine combined with propofol in sedation for mechanically ventilated patients.MethodsSeventy-six patients with mechanical ventilation time >24h in ICU of Navy General Hospital of PLA from Mar. 2012 to Sep. 2014 were randomly divided into midazolam group (n=23), propofol group (n=27) and dexmedetomidine combined with propofol group (n=26), and they were given corresponding drugs for sedation. The proportions in each group which reached the target score of Richmond agitation-sedation scale (RASS) and the nonverbal pain assessment scale (Critical-Care Pain Observation Tool, CPOT) were accounted and recorded, and the positive rate of delirium was assessed with the confusion assessment method in the intensive care unit (CAM-ICU). The mechanical ventilation time and the effectiveness of sedation among the 3 groups were compared, the frequency of adverse cardiovascular events was recorded, and the frequency of controlled ventilation, daily mean arterial pressure as well as the heart rate range were analyzed.ResultsThe proportion of reaching the target score of RASS was higher in dexmedetomidine combined with propofol group (86.54%) than that in midazolam group (69.32%, P<0.05), but there was no significant difference when compared with that in propofol group (79.37%, P>0.05). The proportion of reaching the target score of CPOT was higher in dexmedetomidine combined with propofol group (63.1%) than in midazolam group (51.2%) and propofol group (49.5%, P<0.05), but no significant difference was found between the latter two groups (P>0.05). The positive rate of delirium and the proportion of controlled ventilation were lower, and the time of mechanical ventilation is shorter in dexmedetomidine combined with propofol group than in the other two groups (P<0.05). No significant difference in the proportion of adverse cardiovascular events, mean arterial pressure and heart rate range was found among the three groups (P>0.05).ConclusionThe efficacy and safety of dexmedetomidine combined with propofol is higher than the individual use of midazolam or propofol in producing sedation for mechanically ventilated patients.
respiration, artificial; hypnotics and sedatives; propofol; midazolam
R971.3
A
0577-7402(2015)06-0479-05
10.11855/j.issn.0577-7402.2015.06.12
2015-02-24);
2015-04-13)
(责任编辑:熊晓然)
胡子龙,医学硕士。主要从事重症医学的临床研究
100048 北京 海军总医院重症医学科(胡子龙、张志成、李大伟、帅维正、邹剑峰)

