ABL SH3-T79Y突变体联合伊马替尼对慢性粒细胞白血病细胞增殖的影响
文良雪,刘鑫,李会,黄宁姝,黄峥兰,冯文莉
ABL SH3-T79Y突变体联合伊马替尼对慢性粒细胞白血病细胞增殖的影响
文良雪,刘鑫,李会,黄宁姝,黄峥兰,冯文莉
目的分析慢性粒细胞白血病(CML) BCR-ABL蛋白的SH3结构域突变体(ABL SH3-T79Y)联合伊马替尼(IM)在体内外对CML细胞增殖的影响,并初步探讨其发挥作用的机制。方法构建重组腺病毒载体SH3-T79Y突变体,将其联合IM处理K562/G01细胞后,采用克隆形成实验检测细胞克隆形成率,流式细胞术检测细胞周期,分析K562/ G01细胞体外增殖能力的变化。SH3-T79Y联合IM处理KCL22细胞,构建BALB/c裸鼠皮下实体瘤模型,计算皮下瘤形成率,摘取瘤体进行病理学检查,分析KCL22细胞体内增殖能力的变化。SH3-T79Y联合IM处理K562/G01细胞后,采用Western blotting检测p-BCR-ABL、BCR-ABL、p-CrkL、CrkL、Cyclin D1蛋白的表达水平,分析联合作用影响CML细胞增殖的机制。实验中以PBS、腺病毒空载体及IM单独处理细胞作为对照。结果相较于三个对照组,SH3-T79Y联合IM处理K562/G01细胞后,细胞克隆形成率(28.74%±6.64%)明显降低(P<0.05),细胞周期阻滞于S期。联合处理KCL22细胞后,KCL22-BALB/c裸鼠皮下实体瘤模型成瘤率为16.7%,明显低于IM单独处理组(33.3%)和PBS对照组(100%),瘤体病理学检查见大量增殖的瘤细胞;Western blotting检测结果显示联合处理后K562/G01细胞p-BCR-ABL、p-CrkL、BCRABL、CrkL及Cyclin D1的表达均降低。结论SH3-T79Y联合IM通过抑制BCR-ABL、CrkL磷酸化和降低Cyclin D1表达,在体内、体外发挥了抑制CML细胞增殖的效应。
细胞增殖;白血病,髓系,慢性,BCR-ABL阳性;RIN1蛋白;K562/G01细胞;KCL22细胞
RIN1是Ras蛋白的效应因子[1-3]。RIN1基因定位于11号染色体长臂1区3带2亚带(11q13.2)。在慢性粒细胞白血病(chronic myeloid leukemia,CML)细胞中,RIN1蛋白通过其富含的脯氨酸序列与CML 的BCR-ABL SH3、SH2区域相互作用,直接激活ABL酪氨酸激酶活性,促进ABL下游Crk和CrkL磷酸化,正向调节ABL介导的细胞骨架重组,因此RIN1 是ABL的结合伴侣;激活的ABL引起RIN1 Tyr36磷酸化,两者协同调控细胞黏附和迁移,所以RIN1又是ABL的磷酸化底物[4-6]。因此,寻找一种ABL SH3突变体片段,提高其与RIN1蛋白的结合能力,通过两者相互作用阻滞CML细胞BCR-ABL与RIN1的结合,降低BCR-ABL的酪氨酸激酶活性,可能是一种辅助治疗CML的潜在方案。本课题组前期通过计算机药物设计技术获得ABL SH3突变体SH3-T79Y,相对于野生型SH3,该突变体与RIN1的结合能力大幅提高,同时成功构建了重组腺病毒载体,通过免疫共沉淀验证了SH3-T79Y与RIN1蛋白结合,与计算机模拟结果一致[7]。本研究以CML耐药细胞株K562/G01和KCL22作为研究对象,探讨SH3-T79Y联合伊马替尼(imatinib,IM)对BCR-ABL、CrkL磷酸化和Cyclin D1蛋白表达的影响,及其在体内、外抑制细胞增殖的效应,旨在为CML尤其是耐IM的CML寻找新的治疗方法。
1 材料与方法
1.1 细胞株、重组腺病毒载体与实验动物 慢性粒细胞白血病细胞株K562/G01、KCL22为本室留存。重组腺病毒载体SH3-T79Y突变体(简称M3)与腺病毒空载对照(pAd-Track-CMV-null-Easy-1,简称T )为本课题组前期构建[5]。SPF级Balb/c裸鼠18只,体重17.4~18.0g,3~4周龄,雌性,购自北京华阜康生物科技股份有限公司[SCXK(京)2009-0015]。
1. 2 主要试剂与仪器设备 RPMI 1640培养基、胎牛血清(美国Gibco公司),IM(瑞士Novartis公司),甲基纤维素(美国Sigma公司),5×SDS-PAGE上样缓冲液、封闭蛋白干粉(武汉博士德生物公司),预染蛋白Marker(美国Themo Scientific公司),PVDF膜、ECL发光液(美国Millipore公司),p-c-ABL、p-CrkL、p-Stat5鸡尾酒联合抗体,BCR抗体(美国Cell Signaling公司),CrkL多克隆抗体、Cyclin D1多克隆抗体、β-actin多克隆抗体(美国Bioworld公司),HRP耦联的羊抗兔IgG二抗(美国Santa Cruz公司)。CO2培养箱(Heraeus Heracell-240型,德国Heraeu公司),超净工作台(美国Thermo公司)。
1.3 M3联合IM在体外对K562/G01细胞增殖的影响
1.3.1 K562/G01细胞处理与分组 低代次K562/ G01在37℃、5%CO2条件下于含有10%胎牛血清的RPMI 1640培养基中常规培养。取对数生长期的细胞,按照1×106个/孔铺6孔板,以1:1000体积比加入聚凝胺(ploybrene)与培养基,先加入重组腺病毒处理48h,再加入3µmol/L IM共同作用24h。实验分4组,M3+IM组为干预组,T+IM组或T组、IM组和PBS组为对照组。处理方式:M3+IM组:以1:1000体积比加入聚凝胺与培养基,先加入重组腺病毒M3处理48h,再加入IM(终浓度3µmol/L)共同作用24h。T+IM组或T组:在K562/G01细胞中以1:1000体积比加入聚凝胺与培养基,先加入腺病毒空载对照T处理48h,再加入IM(终浓度3µmol/L)共同作用24h。T+IM组或T组:在K562/G01细胞中以1:1000体积比加入聚凝胺与培养基,先加入腺病毒空载对照T处理48h,再加入IM(终浓度3µmol/L)共同作用24h;T组不加入IM,其余同T+IM组(T+IM组作为IM组的对照,以证实空载病毒T对细胞有无影响;T组作为PBS组的对照,以证实空载病毒T对细胞有无影响)。IM组:在K562/G01细胞中加入IM(终浓度为3µmol/L)作用24h。PBS组:正常培养的K562/ G01细胞加入无菌PBS处理72h。
1.3.2 克隆形成实验检测细胞增殖 收集各组K562/G01细胞,无菌PBS洗涤2次去除病毒和IM。细胞计数后按500个/孔培养于24孔板内,培养基为RPMI 1640培养液(含0.9% 甲基纤维素,20%胎牛血清)。每孔设置3个平行孔。37℃、5%CO2条件下培养10~14d后计数克隆数。1个克隆集落标准定义为其中细胞数目大于50个,将PBS对照组克隆形成率作为100%。
1.3.3 流式细胞术检测细胞周期 收集各组K562/ G01细胞,1500r/min离心10min收集沉淀,经预冷PBS以1500r/min离心5min洗涤2次。加入1ml预冷70%乙醇,转入Epp管,4℃固定过夜。离心弃上清,PBS洗涤去除乙醇,加入50mg/L PI染色(含50mg/L RNAse)室温避光孵育30min,流式细胞术检测细胞增殖周期。
1.4 M3联合IM在体内对KCL22细胞增殖的影响
1.4.1 KCL22细胞处理与BALB/c裸鼠饲养 低代次KCL22细胞在含10%胎牛血清的RPMI 1640培养基中,于37℃、5%CO2条件下常规培养。移植前取对数生长期细胞,用无菌PBS调整细胞浓度。BALB/c裸鼠饲养于重庆医科大学实验动物中心[SYXK(渝)2012-0001]层流架独立通风盒(individually ventilated cages,IVC)实验室,给予标准颗粒饲料喂养,常规饮水、垫料。遵循实验动物使用的“替代、减少、优化”(3R)原则给予人道关怀。
1.4.2 BALB/c裸鼠KCL22细胞移植 将18只BALB/c裸鼠随机分为对照组、IM组、M3+IM组,每组6只。在超净工作台内,将KCL22细胞按每只2×107个/200µl接种于BALB/c裸鼠左后肢腋部皮下。对照组:注射无菌PBS处理的KCL22细胞。IM组:KCL22细胞经3µmol/L IM处理24h,注射接种;M3+IM组:M3处理KCL22细胞48h,再联合3µmol/L IM共同处理24h,注射接种。
1.4.3 KCL22-BALB/c裸鼠皮下实体瘤模型一般情况观察 移植后每日观察动物一般状态,包括荷瘤裸鼠体重、活动力、饮食、大小便和精神状态以及皮下瘤体形成状况。
1.4.4 M3联合IM对KCL22细胞在BALB/c裸鼠皮下实体瘤模型中致瘤能力的影响 观察各组小鼠是否生成皮下实体肿瘤、测量瘤体大小。成瘤率=成瘤小鼠数量/该组小鼠总数×100%
1.4.5 KCL22-BALB/c裸鼠皮下实体瘤模型组织病理学检查 待皮下瘤形成后,以颈椎脱臼法处死小鼠,分别摘取其移植瘤体,以及肝、脾和病变组织标本,石蜡包埋,切片,HE染色,显微镜下观察瘤体组织弥散程度、坏死区及周围炎症细胞浸润情况。
1.5 Western blotting检测M3+IM作用于K562/G01细胞后相关蛋白的表达 取K562/G01细胞,分组及处理同1.3.1。提取细胞总蛋白,取80µg上样,行SDS-PAGE凝胶电泳,转膜至PVDF膜。5%脱脂奶粉,4℃封闭6h;分别加入p-c-ABL、BCR、p-CrkL、CrkL、Cyclin D1、β-actin(上述抗体均为1:1000稀释,β-actin为内参)一抗4℃孵育过夜;TBS-T室温洗3次,每次5min;加入羊抗兔IgG-HRP二抗(1:1000),室温孵育1h;洗膜,ECL显色,BioRad凝胶成像系统检测。
1.6 统计学处理 采用SPSS 18.0软件包进行数据处理与分析,计量资料以表示。数据满足正态、方差齐,多组间比较采用单因素方差分析,两组间比较采用SNK-q分析。P<0.05表示差异具有统计学意义。
2 结 果
2.1 M3联合IM对K562/G01细胞克隆形成率的影响 克隆培养10d后成像结果显示,与对照组(100%)比较,M3+IM组细胞克隆形态较小,克隆数量明显减少(图1)。克隆培养14d后计数,将PBS 组K562/G01细胞克隆形成率计为100%,M3+IM组克隆形成率为28.74%±6.64%,明显低于IM组(68.78%±11.0%,P<0.05),而IM组与T+IM组(65.01%±6.80%)的克隆形成率差异无统计学意义。2.2 M3联合IM对K562/G01细胞周期的影响 流式细胞仪检测结果见图2和表1。T组、IM组、PBS处理组K562/G01细胞S期细胞比例分别为54.18%、51.06%、50.79%,三者间差异无统计学意义(P>0.05),M3+IM组S期细胞比例为64.88%,明显高于其他3组(P<0.05),而G2期细胞比例为0.00%,表明K562/ G01细胞经过M3+IM处理后,周期明显阻滞在S期。
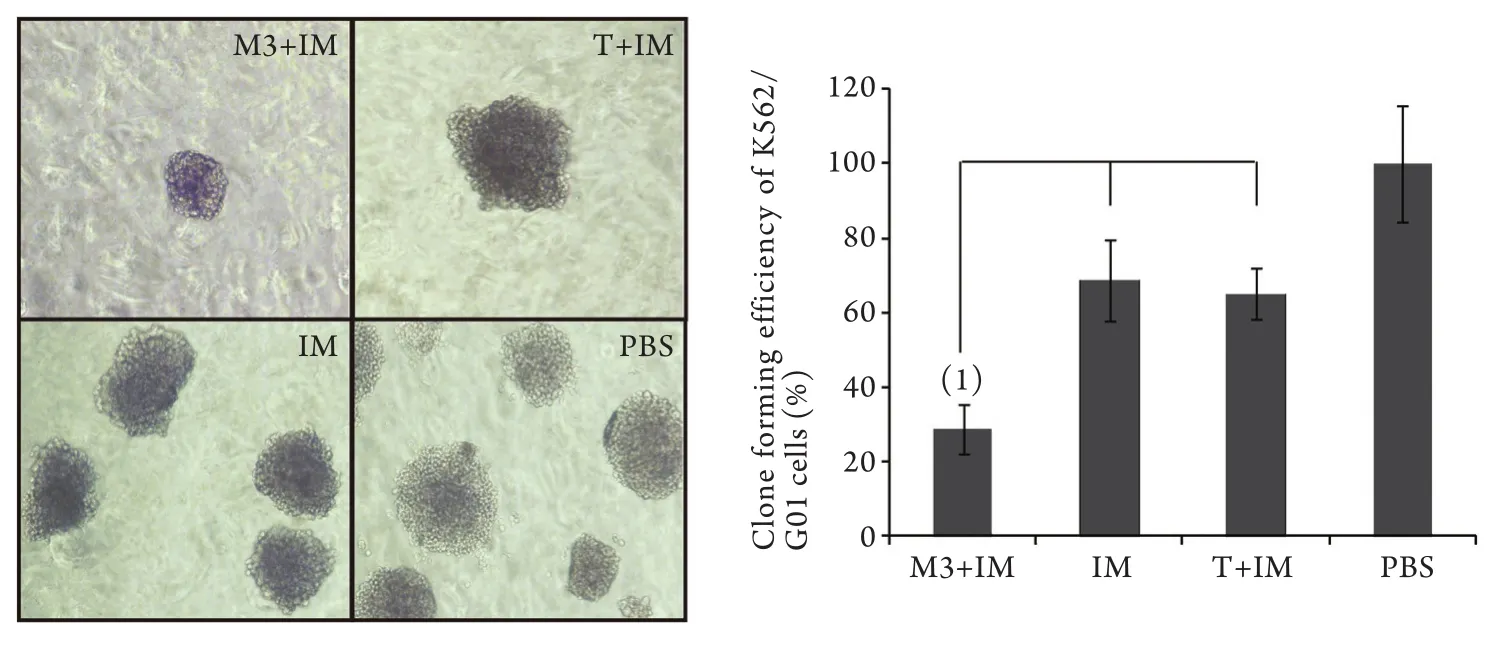
图1 K562/G01细胞克隆形成实验Fig. 1 Clone formation assay of K562/G01 cellsLeft. Colony units of K562/G01 cells under inverted microscope (×100); A. M3+IM group; B. T+IM group; C. IM group; D. PBS group; Right. Clone formation rate of K562/G01 cells; (1)P<0.05 compared IM and T+IM group
2.3 KCL22-BALB/c裸鼠皮下实体瘤模型成瘤情况小鼠接种KCL22细胞后局部皮肤无炎症改变,皮丘于接种第2日消平。肿瘤生长至肉眼可见的潜伏期为4~10d。皮下瘤为圆球形或椭球形实体瘤,质硬,表面光滑,颜色红润。各组皮下瘤形成率见表2。实验中未观察到肿瘤自然缩小或消退者。荷瘤鼠晚期体重下降,消瘦明显,活动力及反应力均低下,最终死亡,部分伴有严重的腹水、脊柱变形(图3)。

图2 流式细胞术检测M3+IM对K562/G01细胞周期的影响Fig. 2 Effects of M3+IM on Cell cycles of K562/01 cells determined by flow cytometry
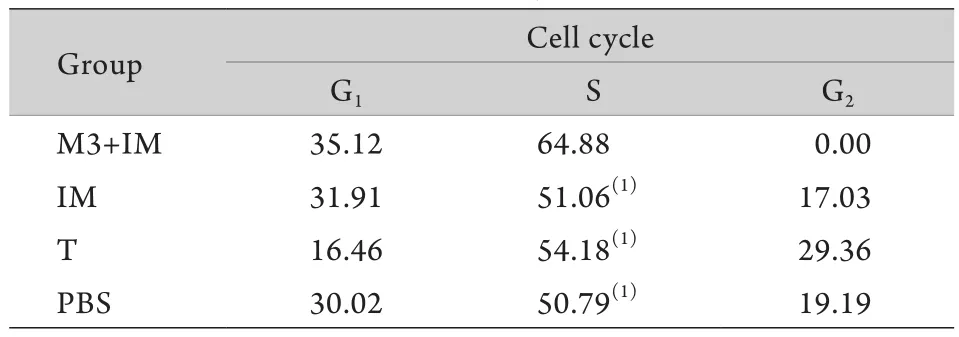
表1 M3+IM对K562/G01细胞周期的影响(%)Tab. 1 Effect of M3+IM on cell cycles of K562/G01 cells(%)

表2 M3+IM对KCL22细胞皮下瘤形成率的影响Tab. 2 Effects of M3+IM on the formation rate of subcutaneous tumor of KCL22 cells
2.4 KCL22-BALB/c裸鼠皮下实体瘤模型病理检查结果 解剖见皮下瘤与周围组织边界清晰,无浸润生长现象,瘤体表层无包膜,切面粉红色。HE染色和瑞氏染色均可见大量增殖的瘤细胞,形态较一致,细胞核深染,呈圆形、椭圆形或杆状,胞质少(图4)。解剖未发现其他组织器官有肿瘤转移,但可见部分荷瘤鼠肝脏有出血、萎缩或长有白色结节,脾脏亦萎缩。HE染色证实脏器有炎症细胞浸润、组织坏死。
2.5 M3联合IM作用于K562/G01细胞后相关蛋白表达 由图5可见,与PBS组、T+IM组、IM组比较,M3+IM可明显抑制BCR-ABL、CrkL磷酸化水平,降低BCR-ABL、CrkL的总蛋白表达,同时减少Cyclin D1蛋白表达,使细胞增殖阻滞。

图3 KCL11-BALB/c裸鼠皮下实体瘤模型成瘤情况Fig. 3 KCL22-BALB/c mice with subcutaneous tumorA. Subcutaneous tumor, B. Deformity of spinal column, C. Ascites
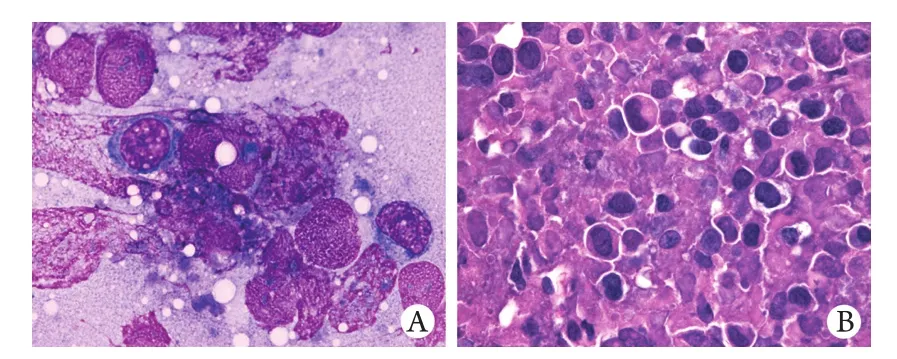
图4 KCL22-BALB/c裸鼠皮下实体瘤模型病理检查Fig. 4 Pathological examination of subcutaneous tumor in KCL22-BALB/c miceA. Wright's staining (×1000); B. HE staining (×400)
3 讨 论
本实验首先选用CML细胞株K562/G01作为研究对象,探讨重组腺病毒载体SH3-T79Y突变体(简称M3)与IM联用在体外抑制细胞增殖的效应。该细胞株是天津血液病研究所以人源性BCR-ABL阳性的K562细胞为亲代细胞,通过IM剂量递增的方法诱导获得,中度表达RIN1蛋白[8]。细胞最重要的生物学特征之一是细胞增殖,细胞增殖包括DNA复制,蛋白质和糖、脂类合成,细胞分裂等行为,体现于细胞周期中[9]。克隆形成实验可定量分析细胞独立生存能力,了解单个细胞增殖潜能。因此本研究利用克隆形成实验并检测细胞周期观察细胞增殖效应。结果表明,M3与IM联合处理K562/G01细胞后,其克隆形成能力明显下降,细胞周期阻滞于S期,证实M3与IM联用能在体外有效抑制CML耐药细胞株K562/G01的增殖。

图5 Western blotting检测M3+IM作用于K562/G01细胞后相关蛋白表达Fig.5 Western blotting determination of expression of related proteins in K562/G01 cells treated by M3+IM
KCL22细胞是人源髓系急变CML细胞株,BCR-ABL阳性,双Ph染色体,体外培养半贴壁生长,特征基本上与K562细胞相似,但其为IM中度耐药株,高表达RIN1蛋白[10-11]。由于BALB/c裸鼠第11对染色体隐性基因发生突变,所以遗传性无胸腺,无毛,缺乏成熟T细胞,但B细胞和NK细胞功能基本正常,广泛应用于肿瘤学、免疫学等研究。因此,本实验构建KCL22-BALB/c裸鼠皮下实体瘤模型,探讨M3联合IM处理对KCL22细胞裸鼠致瘤能力的影响。结果表明,PBS处理对照组成瘤率为100%,瘤体大小不一致,最大可达7mm×10mm,最小3mm×4mm;瑞氏染色和HE染色可见瘤细胞弥漫分布,形态特征与体外培养的KCL22细胞一致;肝脏和脾脏组织病理学检测可见炎症细胞浸润和组织坏死,同时小鼠伴有大量腹水生成,肝硬化,最终死亡,表明KCL22细胞适应于裸鼠皮下的生长环境,所形成的实体瘤能在动物体内持续增殖,并保持原细胞的形态特征。M3+IM组成瘤率为16.7%,瘤体生长速度较慢,瘤块体积较小,至实验结束动物均未死亡,且各项指标均优于IM组,说明M3联合IM处理KCL22细胞后可明显抑制皮下实体瘤的形成,且效果优于单独使用IM。本研究证实联合处理可有效抑制CML细胞株KCL22在小鼠体内的生长和增殖能力。
为了初步探讨突变体M3与IM联用抑制CML细胞增殖的作用机制,本研究采用Western blotting检测了BCR-ABL及其重要底物CrkL磷酸化和总蛋白水平的变化,并分析细胞周期蛋白Cyclin D1的表达。BCR-ABL蛋白是CML的特征性融合蛋白[12-14],具有强烈的酪氨酸激酶活性,可导致自身第177位酪氨酸残基磷酸化,为接头蛋白CrkL等提供连接位点[15],进而调节Jak2/Stat5、PI3K/Akt、MEK/Erk等信号转导通路,传递细胞增殖、凋亡的异常信号[16]。本研究结果显示,M3联合IM可明显抑制BCR-ABL和底物CrkL磷酸化水平,使BCR-ABL、CrkL总蛋白表达水平降低,并减少Cyclin D1的表达。以上结果表明,M3联合IM抑制K562/G01细胞增殖的作用机制与其调节BCR-ABL相关蛋白表达水平有关。
综上所述,本实验证实ABL SH3-T79Y突变体与IM联合作用在体内外均具有抑制耐IMCML细胞株增殖的作用,表明将阻滞RIN1蛋白与BCR-ABL结合的策略用于CML治疗具有可行性,为临床解决CML患者IM耐药提供了实验基础。
[1]Wang Y, Waldron TR, Dhaka A,et al. The Ras effector RIN1 derectly competes with RAF and is regulated by 14-3-3 proteins[J]. Mol Cell Biol, 2002, 22(3): 916-926.
[2]Chen YH, Lan ZP, Hui QY,et al. Expression and significance of RASSF1A and p53 protein in gastric mucosal lesions[J]. Med J Chin PLA, 2012, 37(6): 664-665. [陈雅慧, 兰忠平, 惠起源, 等. RASSF1A及p53蛋白在胃黏膜病变中的表达及意义[J].解放军医学杂志, 2012, 37(6): 664-665.]
[3]Huang HW, Li YX. Expression and clinical significance of EGFR and K-ras in colorectal cancer[J]. J Logist Univ PAPF (Med Sci), 2013, 22(5): 345-347, 359, 461. [黄鸿武, 李永翔. EGFR和K-ras在结直肠癌中的表达及其临床意义[J]. 武警后勤学院学报(医学版), 2013, 22(5): 345-347, 359, 461.]
[4]Bliss JM, Venkatesh B, ColicelliJ. The RIN family of Ras effectors[J]. Methods Enzymol, 2006, 407: 335-344.
[5]Hu H, Bliss JM, Wang Y,et al. RIN1 is an ABL tyrosine kinase activator and a regulator of epithelial-cell adhesion and migration[J]. Curr Biol, 2005, 15(9): 815-823.
[6]Cao X, Tanis KQ, Koleske AJ,et al. Enhancemnt of ABL kinase catalytic efficiency by a direct binding regulator is independent of other regulatory mechanisms[J]. J Biol Chem, 2008, 283(46): 31401-31407.
[7]Liu X. Inhibition of activity of BCR-ABL by competitive binding on RIN1 and enhancement of the sensitivity of Imatinib[D]. Chongqing: Chongqing Medical University, 2014. [刘鑫. 高亲合力ABL SH3片段竞争性结合RIN1抑制BCR-ABL活性和增加伊马替尼敏感性的研究[D]. 重庆: 重庆医科大学, 2014.]
[8]Qi J, Peng H, Gu ZL,et al. Establishement of an imatinib resistant cell line K562/G01 and its characterization[J]. Chin J Hematol, 2004, 25(6): 337-341. [齐静, 彭晖, 顾振纶, 等. 伊马替尼耐药的K562 细胞系的建立及其生物学特性研究[J]. 中华血液学杂志, 2004, 25(6): 337-341.]
[9]Younos IH, Dafferner AJ, Gulen D,et al. Tumor regulation of myeloid-derived suppressor cell proliferation and trafficking [J]. Int Immunopharmacol, 2012, 13(3): 245-256.
[10] Chmine K, Nagai T, Tarumoto T,et al. Analysis of gene expression profiles in an imatinib-resistant cell line, KCL22/ SR[J]. Stem Cells, 2003, 21(3): 315-321.
[11] Thai M, Ting PY, McLaughlin J,et al. ABL fusion oncogene transformation and inhibitor sensitivity are mediated by the cellular regulator RIN1[J]. Leukemia, 2011, 25(2): 290-300.
[12] Tala I, Chen R, Hu T,et al. Contributions of the RhoGEF activity of p210 BCR/ABL to disease progression[J]. Leukemia, 2013, 27(5): 1080-1089.
[13] Shi XP, Chen X, Tan Y,et al. Effects of Garcinia acid by downregulation of Bcr-Abl protein on the proliferation and apoptosis of chronic myelogenous leukemia cell line K562[J]. J Shandong Univ (Health Sci), 2013, 51(7): 10-14. [师宪平, 陈鑫, 谭茵, 等. 藤黄酸下调Bcr-Abl蛋白对慢粒细胞株K562增殖和凋亡的影响[J]. 山东大学学报(医学版), 2013, 51(7): 10-14.]
[14] Xiao H, Wang HX, Tao K,et al. Location of CTP-OD1-HA and CTP-OD2-HA fusion peptide in K562 cells and its interaction with BCR-ABL protein[J]. Med J Chin PLA, 2013, 38(11): 896-899. [肖恒, 王海霞, 陶崑, 等. CTP-OD1-HA和CTP-OD2-HA融合肽在K562细胞中的定位及其与BCR-ABL蛋白的相互作用[J]. 解放军医学杂志, 2013, 38(11): 896-899.]
[15] Patel H, Marley SB, Gordon MY. Detection in primary chronic myeloid leukaemia cells of p210BCR-ABL1 in complexes with adaptor proteins CBL, CRKL, and GRB2[J]. Genes Chromosomes Cancer, 2006, 45(12): 1121-1129.
[16] Cilloni D, Saglio G. Molecular pathways: BCR-ABL[J]. Clin Cancer Res, 2012, 18(4): 930-937.
Effects of ABL SH3-T79Y mutant combined with imatinib on the proliferation of chronic myeloid leukemia cells
WEN Liang-xue, LIU Xin, LI Hui, HUANG Ning-shu, HUANG Zheng-lan, FENG Wen-li*
College of Laboratory Medicine, Key Laboratory of Medical Diagnostics, Ministry of Education, Chongqing Medical University, Chongqing 400016, China
*< class="emphasis_italic">Corresponding author, E-mail: fengwlcqmu@sina.com
, E-mail: fengwlcqmu@sina.com
This work was supported by the National Natural Science Foundation of China (30871102)
ObjectiveTo analyze the influence of SH3 domain mutant (ABL SH3-T79Y) in BCR-ABL protein of chronic myeloid leukemia (CML) in combination with imatinib (IM) on the proliferation of CML cellsin vivoandvitro, and to discuss the mechanism thereof.MethodsRecombinant ABL SH3-T79Y mutant adenovirus vectors which were successfully constructed in previous work was used with IM to treat K562/G01 cells, then the cell-colony forming ability of K562/G01 cells was determined by clone formation assay, and cell cycle was assessed by flow cytometry. KCL22 cells were treated by recombinant SH3-T79Y and IM to construct subcutaneous solid tumor model in Balb/c nude mice, then the formation rate of subcutaneous tumor was estimated, the pathological examination was conducted, and the proliferation ability of KCL22 cells was assayed. K562/G01 cells were treated by SH3-T79Y and IM in combination, and the expression levels of p-BCR-ABL, BCR-ABL, p-CrkL, CrkL and Cyclin-D1 protein were determined by Western blotting. Cells treated with PBS, null recombinant adenovirus vectors or IM alone served as control groups.ResultsCompared to the 3 control groups, clone forming rate of K562/G01 cells decreased significantly (P<0.05) and cell cycles were arrested at S phase after being combined SH3-T79Y and IM treatment. The subcutaneous solid tumor formation rate in KCL22-Balb/c nude mice was 16.7% after combined SH3-T79Y and IM treatment, and large number of tumor cells were observed in tumor pathology examination. Western blotting revealed that the expression levels of p-BCR-ABL, p-CrkL, BCR-ABL, CrkL and Cyclin-D1were decreased in K562/G01 cells.ConclusionCombined treatment of SH3-T79Y and imatinib may inhibit the proliferation of CML cellsin vivoandin vitroby decreasing BCR-ABL and CrkL phosphorylation as well as Cyclin-D1 protein.
cell proliferation; leukemia, myelogenous, chronic, BCR-ABL positive; RIN1proteins; K562/G01cells; KCL22 cells
R733.72
A
0577-7402(2015)08-0616-06
10.11855/j.issn.0577-7402.2015.08.03
2015-01-14;
2014-06-29)
(责任编辑:沈宁)
国家自然科学基金(30871102)
文良雪,硕士研究生。主要从事白血病的分子机制与基因治疗方面的研究
400016 重庆 重庆医科大学检验医学院临床检验诊断学教育部重点实验室(文良雪、刘鑫、李会、黄宁姝、黄峥兰、冯文莉)
冯文莉,E-mail:fengwlcqmu@sina.com

