索拉非尼对胃癌细胞MGC80—3抑制作用实验研究
陈怡 陈烁 郑娟红等
[摘要] 目的 探讨索拉非尼对体外培养人胃癌MGC80-3细胞增殖和凋亡的作用以及作用机制。 方法 采用二苯基四氮唑溴盐比色法(MTT法)检测不同浓度索拉非尼作用人胃癌MGC80-3 细胞的抑制作用;AnnexinV/PI 双染法观察药物处理后细胞凋亡率变化。 结果 索拉非尼对人胃癌MGC80-3细胞增殖具有明显抑制作用,且呈剂量和时间依赖性,与对照组比较差异有统计学意义(P<0.05)。 结论 索拉非尼能够诱导细胞凋亡,并随浓度增高凋亡率增加。
[关键词] 胃癌细胞;索拉非尼;凋亡;增殖
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2015)21-0008-03
[Abstract] Objective To explore the inhibitory effective and mechanism on the proliferation and apoptosis of sorafenib in vitro gastric cancer MGC80-3 cells. Methods The inhibitory effective of sorafenib at different concentrations for gastric cancer cell MGC80-3 were analyzed by MTT assay. Apoptosis rate was observed by AnnexinV/PI staining. Results The proliferation inhibition of sorafenib on gastric cancer MGC80-3 cell was time-dose dependent manner, the difference was statistically significant (P<0.05). Conclusion The apoptosis of gastric cancer MGC80-3 cells is different and the apoptotic rate is increased with the increase of sorafenib concentration.
[Key words] Gastric cancer cell; Sorafenib; Apoptosis; Proliferation
胃癌是最常见的恶性肿瘤之一,其死亡率居所有癌症的第二位[1]。胃癌的早期诊断难,大多数胃癌诊断时已处于进展期,除了手术治疗以及放疗或者保守化疗外,尚无有效的治疗方法。目前,药物治疗作为主要手段用于治疗晚期胃癌。随着胃癌分子生物学技术的发展,针对肿瘤细胞生长、凋亡、细胞周期、浸润以及血管生成等分子靶点提出的靶向治疗成为胃癌综合治疗的重点和热点。研究显示索拉非尼(sorafenib)是小分子多靶点、多激酶抗肿瘤药,能同时抑制存在于细胞内和细胞表面的激酶,包括RAF激酶、血管内皮生长因子-2(VEGFR-2)、血管内皮生长因子-3(VEGFR-3),具有双重抗肿瘤效应[2]。本研究通过观察索拉非尼在体外对胃癌细胞株生物学活性的作用,了解其可能的作用机制,为进一步的临床研究和应用提供依据。
1 材料与方法
1.1 主要材料
人胃癌MGC80-3细胞株购于武汉博士德生物工程有限公司,AnnexinV-FITC和PI检测试剂盒购买于南京凯基生物科技发展有限公司,索拉非尼为德国拜耳公司生产,用10%二甲基亚砜(DMSO)溶解,于-20℃保存,实验时稀释。
1.2 实验方法
1.2.1 胃癌MGC80-3细胞培养 在10%胎牛血清的RPMI-1640培养液中,置于37℃、5%CO2的恒温细胞培养箱中培养,取对数生长期细胞用于实验。
1.2.2 MTT检测索拉非尼作用于MGC80-3细胞的抑制率 将细胞分别接种于96孔平底板,每孔接种5×105个细胞。实验组分别加入不同浓度(S1:5 μmol/L、S2:10 μmol/L、S3:15 μmol/L、S4:20 μmol/L)的索拉非尼100 μL,并设不加药物的对照组。加药后分别培养24 h、48 h、72 h,药物终止作用后常规MTT法测生长抑制率,在自动酶标仪490 nm波长处测定每孔的吸光度(A)值。细胞抑制率(%)=(1-用药组平均A值)/阴性对照组平均A值×100%,实验重复3次。
1.2.3 流式细胞仪检测细胞凋亡率 调整细胞密度为1×105/mL接种于6孔板,每孔2 mL。加入含不同浓度(5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L)索拉非尼的RPMI 1640培养液作为实验组,2 mL/孔,对照组仅加入等量培养液。将培养板置于37℃、5% CO2的恒温细胞培养箱中培养48 h。按流式细胞检测试剂盒说明书处理细胞,进行检测。
1.3 统计学方法
采用SPSS17.0软件包进行统计学分析。计量资料用(x±s)表示,组间比较采用单因素方差分析,以P<0.05为有差异有统计学意义。
2 结果
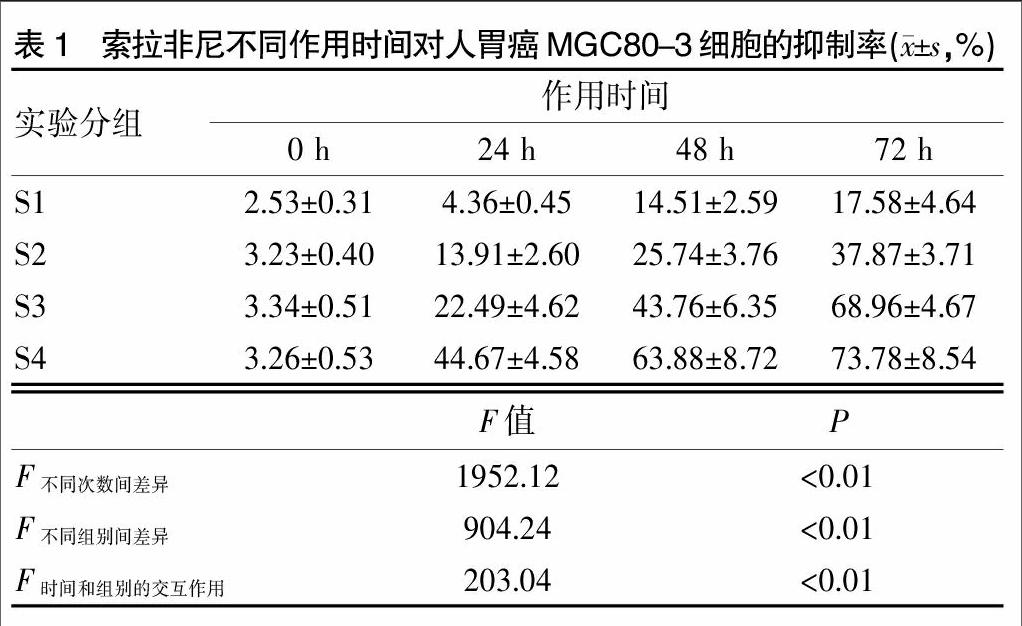
2.1 索拉非尼不同用药方式对MGC80-3细胞的抑制作用
索拉非尼对MGC80-3细胞有抑制作用,抑制作用随着其浓度增高或作用时间延长而增强,呈剂量和时间依赖性(P<0.05)。见表1。
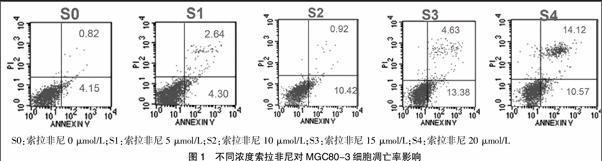
2.2 不同浓度索拉非尼对MGC80-3细胞凋亡率影响
索拉非尼作用48 h后在流式细胞仪得到的AnnexinV-FITC/PI双染双变量散点图,索拉非尼作用MGC80-3细胞48 h出现凋亡呈浓度依赖性,在5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L的索拉非尼组与对照组相比差异有统计学意义(P<0.05)。对照组S0的细胞凋亡率为(4.10±1.48)%,实验组S1、S2、S3、S4的细胞凋亡率分别为(7.71±2.35)%、(13.49±2.10)%、(17.53±2.61)%、(26.15±5.49)%,与对照组相比差异均有统计学意义(P均<0.05),即随着药物浓度的增高,索拉非尼对MGC80-3细胞的促凋亡作用增强。见图1。
3 讨论
胃癌是最常见的恶性肿瘤之一,发病率居世界第四位[3]。目前晚期胃癌的主要治疗手段是化疗,有效的化疗药物包括紫杉醇、蒽环类、铂类等,但是并未从根本上提高化疗有效率,生存期比较短[4],60%的胃癌患者VEGF有表达,高表达者预后较阴性者差,其发生与发展过程由多因素参与完成,与细胞信号转导通路及新生血管增生异常等相关[5]。索拉非尼通过抑制RAF激酶,阻断Raf/MEK/ERK信号传导通路抑制肿瘤细胞增殖[6,7],靶向作用于血管内皮生长因子以及血小板源生长因子而抑制血管形成[8]。信号转导的失调可以促进肿瘤细胞的增殖,血管形成,粘附以及侵袭和转移,并能抑制肿瘤细胞凋亡。目前有多项应用索拉非尼治疗癌症的临床试验正在进行,有临床研究显示,索拉非尼在肺癌等肿瘤治疗中具有较好的治疗效果[9,10]。在治疗肝癌中通过其抑制信号通路延长生存率[11]。在慢性粒细胞白血病等研究中不仅能抑制细胞生长,而且有诱导肿瘤细胞凋亡作用[12,13]。
凋亡是细胞生长和老化过程中的正常现象。不合适的细胞凋亡是引起许多疾病的一个因素包括结肠癌。诱导凋亡通过多种机制介导,比如抗癌药物顺铂能够与核酸起作用,引起复制停止,抑制转录,DNA损坏和凋亡[14]。胃癌的转移途径包括淋巴道转移[15]、腹膜转移[16]、血行转移[17]等。
本实验分析了索拉非尼在不同的浓度及不同时间均对胃癌MGC80-3细胞有抑制作用,呈时间-剂量依赖性。即索拉非尼浓度越高、作用时间越长对细胞增殖的抑制率越高。流式细胞仪检测细胞凋亡的结果显示在给药浓度为20 μmol/L时,细胞凋亡率为26.15%左右,与对照组比较,差异有统计学意义(P<0.05)。提示索拉非尼对MGC80-3细胞具有凋亡诱导作用,且随浓度的增加凋亡率上升。本研究表明索拉非尼在体外可以直接抑制MGC80-3细胞的生长并可诱导细胞凋亡。与相关报道[18,19]基本相似。
总之,体外实验研究表明索拉非尼具有抑制胃癌MGC80-3细胞增殖作用,呈剂量和时间依赖性,还可以诱导肿瘤细胞凋亡而发挥抗肿瘤作用。下一步将深入开展体外和体内研究,进一步探讨其可能的具体作用途径和机制,来证实索拉非尼对胃癌的治疗有效性,为开展临床研究提供可能的理论支持。
[参考文献]
[1] Thun MJ,De Lancey JO,Center MM,et al. The global burden of cancer:Priorities for prevention[J]. Carcinogenesis,2010,31(1):100-110.
[2] Adnane L,Trail PA,Taylor I,et al. Sorafenib(BAY 43-9006,Nexavar),a dual-action inhibitor that targets RAF/MEK/ERK pathway in tumor cells and tyrosine kinases VEGFR/PDGFR in tumor vasculature[J]. Methods Enzymol,2006,407:597.
[3] 孙艺,李凯,任贵,等. 索拉非尼联合顺铂对胃癌SGC7901细胞的抑制作用[J]. 现代生物医学进展,2013,(10):1807.
[4] 曲颜,丽布力,布唐勇. 替吉奥联合紫杉醇治疗进展期胃癌的临床观察[J]. 中国现代医药杂志,2013,15(11):1-4.
[5] Villanueva A,Newell P,Chiang DY,et al. Genomics and signaling pathways in hepatocellular carcinoma[J]. Semin Liver Dis,2007,27:55-76.
[6] Adnane L,Trail PA,Taylor I,et al. Sorafenib(BAY 43-9006,Nexavar),a dual-action inhibitor that targets RAF/MEK/ERK pathway in tumor cells and tyrosine kinases VEGFR/PDGFR in tumor vasculature[J]. Methods Enzymol,2006,407:597-612.
[7] Chang YS,Adnane J,Trail PA,et al. Sorafenib(BAY43-9006)inhibits tumor growth and vascularization and induces tumor apoptosis and hypoxia in RCC xenograft models[J]. Cancer Chemother Pharmocol,2007,59(5):561-574.
[8] Lathia C,Lettieri J,Cihou F,et al. Lack of effect of ketoconazole mediated CYP3A inhibition on sorafenib clinical pharmacokinetics[J]. Cancer Chemother Phamacol,2006, 57(5):685-692.
[9] Escudier B,Eisen T,Stadler WM,et al. Sorafenib for treatment of renal cell carcinoma:Final efficacy and safety results of the phase Ⅲ treatment approaches in renal cancer global evaluation trial[J]. J Clin Oncol,2009,27(20):3312-3318.
[10] Blumenschein GR,Gatzemeier U,Fossella F,et al. Phase II multicenter uncontrolled trial of single-agent sorafenib inpatients with relapsed or refractory,advanced non-small-cell lung cancer[J]. J Clin Oncol,2009,27(26):4274-4280.
[11] Arao T,Ueshima K,Matsumoto K,et al. FGF3/FGF4 amplification and multiple lung metastases in responders to sorafenib in hepatocellular carcinoma[J]. Hepatology,2013, 57(4):1407-1415.
[12] Huber S,Oelsner M,Decker T,et al. Sorafenib induces cell death in chronic lymphocytic leukemia by translational downregulation of Mcl-1[J]. Leukemia,2011,25(5):838-847.
[13] Ramakrishnan V,Timm M,Haug JL,et al. Sorafenib a dual Raf kinase/vascular endothelial growth factor receptor inhibitor has significant anti-myeloma activity and synergizes with common anti-myeloma drugs[J]. Oncogene,2010,29(8):1190-1202.
[14] Blankenberg FG. Apoptosis imaging:anti-cancer agents in medicinal chemistry[J]. Anticancer Agents Med Chem, 2009,9:944-951.
[15] Dong X,Zhao X,Xiao T,et al. Endostar,a recombined humanized endostatin,inhibits lymphangiogenesis and lymphatic metastasis of Lewis lung carcinoma xenograft in mice[J]. Thorac Cardiovasc Surg,2012,59(3):133-136.
[16] Wan YY,Tian GY,Guo HS,et al. Endostatin,angiogenesis inhibitor,ameliorates bleomycin-induced pulmonary fibrosis in rats[J]. Respir Res,2013,14(1):56.
[17] Ma X,Yao W,Yuan D,et al. Recombinant human endostatin endostar suppresses angiogenesis and lymphangio genesis of malignant pleural effusion in mice[J]. PLo S One,2012,7(12):534-539.
[18] Tao CL,Lin H,Chen SQ. The regulation of ERK and p-ERK expression by cisplatin and sorafenib in gastric cancer cells[J]. Gene,2014,552(1):106-115.
[19] Juan LW,En LM,Hao L,et al. Sorafenib regulating ERK signals pathway in gastric cancer cell[J]. Environmental Toxicology and Pharmacology,2014,38(2):438-443.
(收稿日期:2015-01-26)

