真菌毒素在浓香型白酒生产过程中的安全性检测
李 觅,邓 杰,杨跃寰,卫春会*,黄治国,罗惠波,叶光斌,杨晓东,黄志瑜
(1.四川理工学院酿酒生物技术及应用四川省重点实验室,四川自贡643000;2.江安县工业园区管理委员会,四川江安644200;3.四川省酿酒研究所,四川广汉610000)
真菌毒素在浓香型白酒生产过程中的安全性检测
李觅1,邓杰1,杨跃寰1,卫春会1*,黄治国1,罗惠波1,叶光斌1,杨晓东2,黄志瑜3
(1.四川理工学院酿酒生物技术及应用四川省重点实验室,四川自贡643000;2.江安县工业园区管理委员会,四川江安644200;3.四川省酿酒研究所,四川广汉610000)
该研究采用酶联免疫法对浓香型白酒生产过程中的各个样品(大曲、酒醅、丢糟、黄水、基酒、成品酒)中的相关真菌毒素进行了定量分析。结果表明:黄曲霉毒素B1在大曲、酒醅、丢糟和黄水中的含量分别为2.55 μg/kg、1.75 μg/kg、1.95 μg/kg和2.25 μg/kg,在基酒和成品酒中的含量未达到检出水平;赭曲霉毒素A在大曲、酒醅、丢糟和黄水中的含量分别为1.50 μg/kg、1.65 μg/kg、1.80 μg/kg和2.05 μg/kg,在基酒和成品酒中的含量未达到检出水平;桔霉素在6种样品中均未检出。样品中3种真菌毒素均未超过国家发酵食品限量标准。同时,精密度和回收率试验结果表明,酶联免疫法稳定性较高,适用于白酒生产过程中各个样品的定量分析。
酶联免疫法;真菌毒素;浓香型白酒;安全性
真菌毒素作为相关微生物的次级代谢产物,一直以来都是食品行业的安全隐患,以黄曲霉毒素B1(aflatoxins B1)、赭曲霉毒素A(ochratoxin,OTA)、桔霉素(citrinin)最为常见。黄曲霉毒素B1是一种剧毒和强致癌物质,其毒性更胜于氰化钾和砒霜,极易污染粮食作物、肉类以及奶制品等[1-2],黄曲霉毒素的熔点较高(265~269℃),高温条件下结晶状态较为稳定[3]。赭曲霉毒素A广泛存在于各种食物,谷物以及调味品、酒类等副产品中,具备强致癌、致畸和致突变性,微溶于水,极易溶于有机溶剂,对光和空气不稳定,对肾脏和肝脏的危害性极大[4-5]。桔霉素主要由红曲霉代谢产生,易出现在食品行业与粮食作物上,对肾脏毒性比较明显,造成的损伤不可修复。
粮食作为白酒酿造的主要原料,被真菌毒素污染粮食极有可能进入酿酒工业,再考虑到白酒生产涉及面广泛,包括饲料、肥料、食品、板材、曲药等行业[6-7],白酒行业中的真菌毒素应该引起高度重视。目前,快速检测样品中真菌毒素的方法较多,如薄层色谱法(thin layer chromatography,TCL)、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)、胶体金免疫层析法(gold immunochromatography assay,GICA)、免疫生物传感器技术(immunobiosensor technique)、蛋白芯片技术(proteinchiptechnology)和分子印迹技术(molecularimprintingtechnology,MIT)等方法,但有的方法考虑到检测的精确性需要借助于大型检测仪器,如薄层色谱法和胶体金免疫层析法要借助高效液相检测[8],而有的方法成本高,同时对检测条件和技术要求高,如免疫生物传感器技术、蛋白芯片技术和分子印迹技术等方法。酶联免疫法是在免疫酶技术的基础上建立起来的,在疾病诊断大分子检测中广泛使用,在食品安全检测污染小分子也运用广泛[9],特别是在调味品、葡萄酒等行业中已经成熟引入酶联免疫法进行检验。该研究建立了灵敏、准确、快速、高通量的白酒真菌毒素混合污染检测方法,不仅具有学术意义,更是符合社会白酒产品及副产物质量安全检测的需求和应用前景,对保障白酒生产和安全消费具有重要意义。
1 材料与方法
1.1材料与试剂
样品:成品大曲、入窖酒醅、丢糟、黄水、基酒、成品酒,取自泸州老窖40年窖龄窖池的样品编号为:大曲1、酒醅1、丢糟1、黄水1、基酒1、成品酒1;来源于100年窖龄窖池的样品编号为:大曲2、酒醅2、丢糟2、黄水2、基酒2、成品酒2。
氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾、浓盐酸、氢氧化钠、碳酸氢钠、吐温-20、二氯甲烷、甲醇、三氟乙酸等(均为分析纯):成都科龙化工试剂厂。
酶联免疫试剂盒、桔霉素免疫亲和层析柱、赭曲霉毒素A免疫亲和层析柱、玻璃纤维滤纸等:北京华安麦科生物技术有限公司。
1.2仪器与设备
5430高速离心机:德国艾本德公司;SB-350型多功能高速粉碎机:上海广沙工贸有限公司;Precellys 24高速匀质器:法国Bertin公司;AR2140电子分析天平:上海托利多仪器有限公司;BF-2000M氮气吹干仪:北京八方世纪科技有限公司;1500酶标仪:美国Thermo公司。
1.3方法
1.3.1试剂的配制
黄曲霉毒素B1样品提取液:将甲醇和去离子水按体积比2∶3混合,用于提取样品中的黄曲霉毒素B1;
赭曲霉毒素A样品提取液:将甲醇和去离子水按体积比8∶2混合,用于提取样本中的OTA;
磷酸盐缓冲液(phosphate buffered saline,PBS):8 g NaCl,1.2gNa2HPO4,0.2gKH2PO4,0.2gKCl,混合用990mL蒸馏水溶解,调节pH值至7.0,定容至1 000 mL;
清洗缓冲液:25 g NaCl、5 g NaHCO3和0.1 mL吐温-20混合,然后用蒸馏水稀释至1 000 mL;
NaOH溶液:称取80.0 g固体NaOH,用蒸馏水定容至1 000 mL;
三氟乙酸水溶液:取0.5 mL的三氟乙酸,用去离子水定容至1 000 mL,并用NaOH溶液调节pH至2.5;
桔霉素样品稀释液:取500 mL三氟乙酸水溶液,用NaOH溶液调节pH至7.5;
桔霉素洗脱液:将甲醇与三氟乙酸水溶液按体积比7∶3混合配成样品洗脱液。
1.3.2样品前处理
(1)黄曲霉毒素B1的提取[10]
固态样品(大曲、入窖酒醅和丢糟)前处理:在8 mL提取液中加入1 g粉碎样品,混合均匀(大约振荡10 min),然后3 500 r/min常温离心5 min,取1.28 mL上清液,用二氯甲烷提取2次,(每次用量2 mL,振荡5 min,分层后取下层二氯甲烷相),合并二氯甲烷相;将提取步骤中得到的二氯甲烷相于50℃下氮气浓缩吹干,加入0.2 mL甲醇,振荡混匀,用去离子水按1∶7比例稀释(每体积处理后溶液加入7倍体积去离子水),取稀释后液体待测。
液态样品(黄水、蒸馏酒、基酒和成品酒)前处理:需用样品1 mL,直接如样品前处理方法1中两次二氯甲烷提取,然后将提取相于50℃下氮气浓缩吹干,加入甲醇0.4 mL,振荡混匀,用去离子水按1∶9比例稀释(每体积处理后溶液加入9倍去离子水),取稀释后液体待测。
(2)赭曲霉毒素A的提取
固态样品前处理:将10 g粉碎样品和20 mL提取液混合,再加入1 g NaCl,以匀质器高速搅拌2 min(1 000 r/min以上即可),4 000 r/min离心5 min,取10 mL上清液并加入40 mL PBS缓冲液,用玻璃纤维滤纸过滤,得到滤液;
液态样品前处理处理:取5 mL样品脱气后加入2.5 g NaCl与45 mL PBS缓冲液混匀,用玻璃纤维滤纸过滤,得到滤液。
纯化步骤按照国标GB/T 23502—2009《食品中赭曲霉毒素A的测定免疫亲和层析净化高效液相色谱法》的方法进行处理[11]。
(3)桔霉素的提取
固态样品前处理:取10 g粉碎样品溶于20 mL样品提取液,剧烈振荡3 min,4 000 r/min离心5 min,取10 mL上清液并加入40mL样品稀释液,用玻璃纤维滤纸过滤,得到滤液。
液态样品前处理处理:各取5 mL样品液,加入45 mL样品稀释液,振荡混匀后用玻璃纤维滤纸过滤、备用。
纯化步骤按照SN/T 2916—2011《出口食品中桔霉素的测定方法免疫亲和柱净化-高效液相色谱法》的方法进行处理[12]。
1.3.3毒素的检测
按照各种酶联免疫试剂盒提供的方法进行检测。
1.3.4标准曲线的绘制与结果计算
(1)百分吸光度值的计算
百分吸光度值按以下公式计算:

式中:B为标准溶液或样品溶液的平均吸光度值;B0为浓度为零的标准溶液的平均吸光度值。
(2)标准曲线的绘制与各样品浓度的计算
标准曲线横坐标为各个真菌毒素标准品浓度对数值(x),纵坐标为标准品百分吸光率(y),测定出的样品吸光度值代入标准曲线计算各个样品真菌毒素浓度。
1.3.5方法评价
对实验中酶联免疫法用于测定各样品中真菌毒素含量的方法进行评价,以精密度和回收率为指标。
2 结果与分析
2.1标准曲线的绘制
黄曲霉毒素B1、赭曲霉毒素A以及桔霉素的标准曲线见图1。由图1可知,3条标准曲线分别在相应的浓度对数值范围内与百分吸光度值线性关系良好。
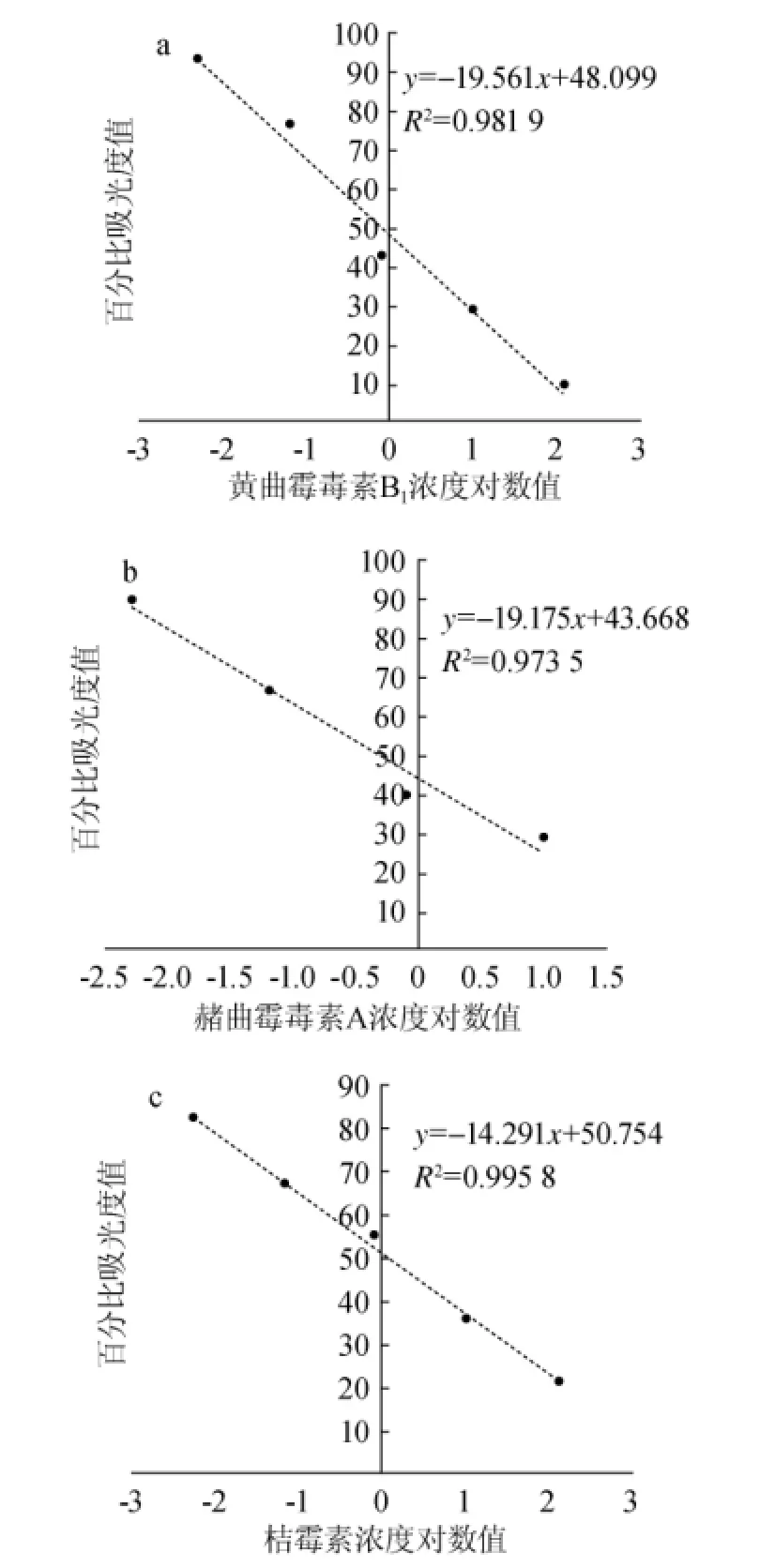
图1 黄曲霉毒素B1(a)、赭曲霉毒素A(b)及桔霉素(c)标准曲线Fig.1 Standard curve of aflatoxin B1(a),ochratoxin A(b)and citrinin(c)
2.2各标准样品的检测
对黄曲霉毒素B1标准样品、赭曲霉毒素A标准样品和桔霉素标准样品进行检测,按照酶联免疫试剂盒提供的检测步骤,结果如表1所示。
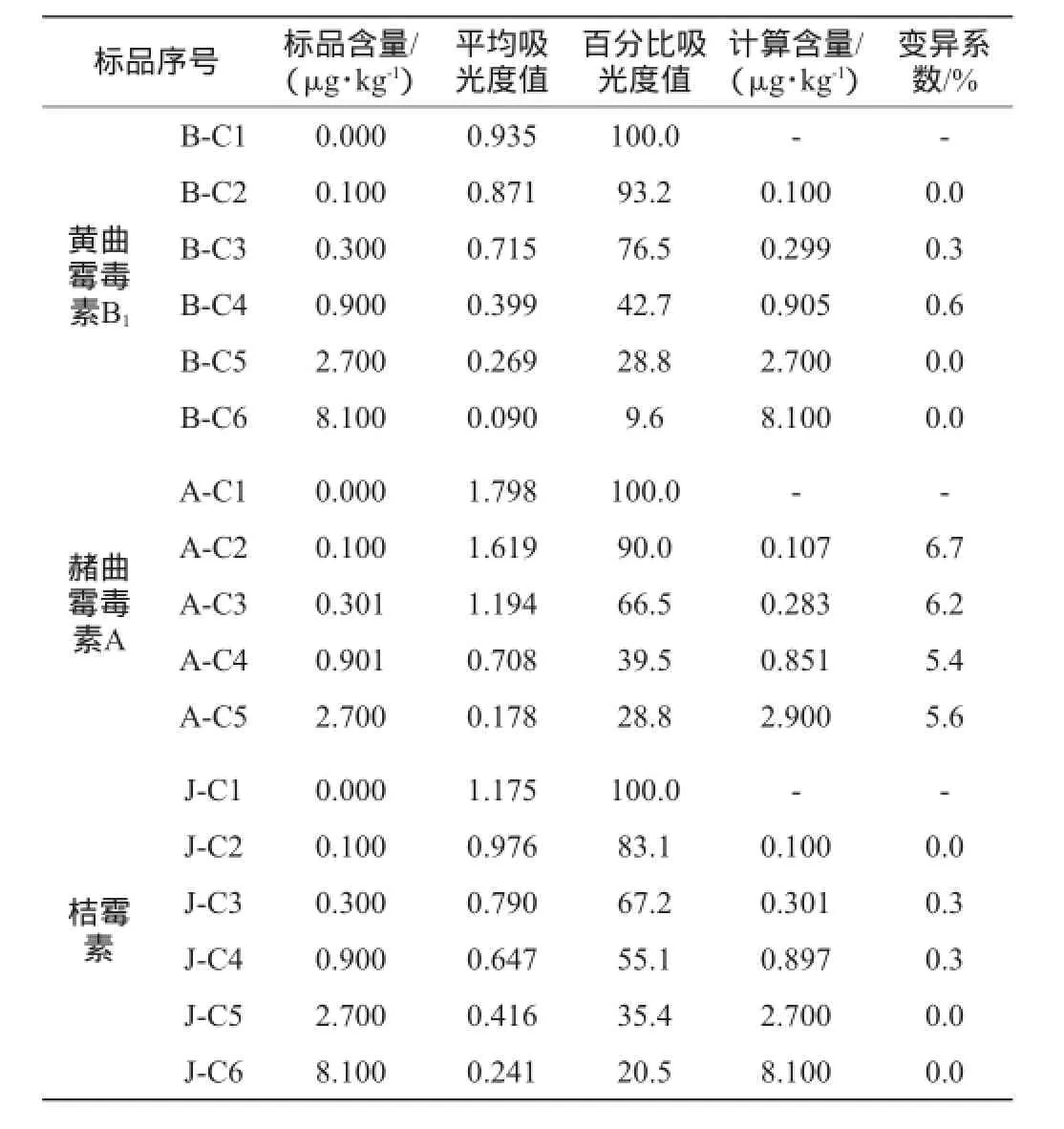
表1 真菌毒素标准品的检测结果Table1 Determination results of mycotoxins standard samples
根据标准品检测要求,各标准品的变异系数<10%符合使用要求,由表1可知,不同质量浓度的标准品变异系数均<10%,完全符合酶联免疫试剂盒的使用要求。
2.3各样品中毒素的含量
2.3.1黄曲霉毒素B1的含量
分别对12个样品进行前处理,用酶标仪测定其OD值,获得的OD值数据用该剂盒提供的RIDAWIN软件分析,结果如图2所示。
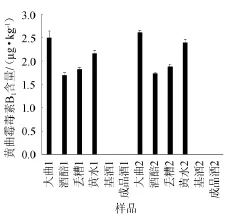
图2 不同样品的黄曲霉毒素B1含量Fig.2 Contents of aflatoxins B1in different samples
由图2可知,本试验所测定的黄曲霉毒素B1在大曲中的含量分别为2.5μg/kg和2.6μg/kg,入窖酒醅中分为1.7μg/kg和1.8 μg/kg,丢糟中分别为1.9 μg/kg和2.0 μg/kg,黄水中分别为2.2 μg/kg和2.3 μg/kg,基酒和成品酒样品中黄曲霉毒素B1的含量均<1.0 μg/kg,低于试剂盒检出限。国家对发酵食品中黄曲霉毒素B1的限量标准是5 μg/kg[13]。结果表明样品中的黄曲霉毒素B1远低于此标准,尤其是基酒和成品酒中几乎不存在黄曲霉毒素B1。
2.3.2赭曲霉毒素A的含量
用酶标仪对处理后各个样品的OD值进行测定,获得的OD值数据用该剂盒提供的RIDAWIN软件分析,结果如图3所示。
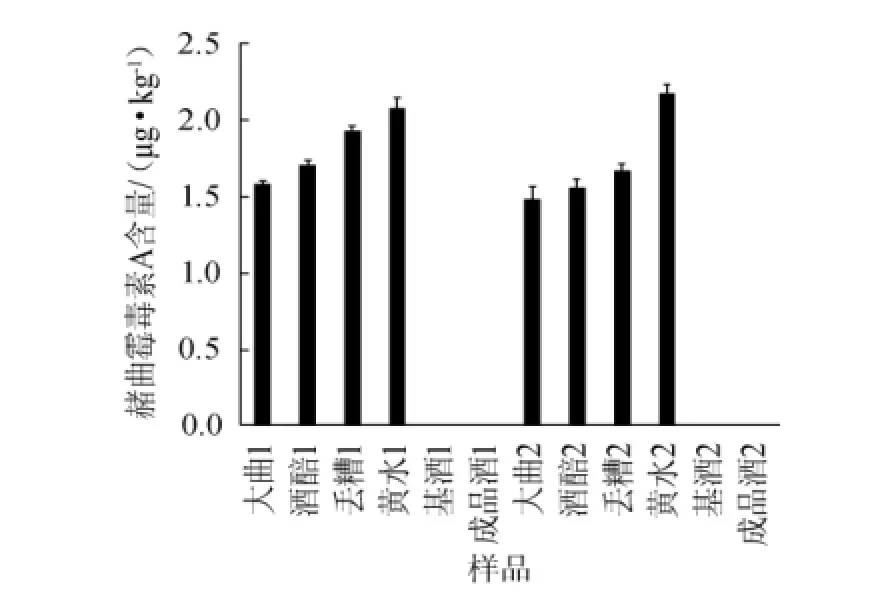
图3 不同样品的赭曲霉毒素A含量Fig.3 Contents of ochratoxin A in different samples
由图3可知,所测定的赭曲霉毒素A在大曲中的含量分别为1.6 μg/kg和1.4 μg/kg,入窖酒醅中分别为1.7 μg/kg和1.6 μg/kg,丢糟中分别为1.9 μg/kg和1.7 μg/kg,黄水中分别为2.1μg/kg和2.0μg/kg,基酒和成品酒样中的赭曲霉毒素A含量<0.3μg/kg,都远低于国内外食品行业的相关标准。
2.3.3桔霉素的含量
对处理后的浓香型白酒生产过程中各个样品进行检测,结果均未检出含有桔霉素,含量都低于该酶联免疫试剂盒的最低检出限,也从一个侧面反映出了桔霉素在浓香型白酒的酿酒工业上是安全的。
2.4精密度检测
分别对工作浓度C3(0.300 μg/kg)、C4(0.900 μg/kg)的标准品与稀释3倍的大曲1、黄水1测定5次,所得结果如表2、表3所示。
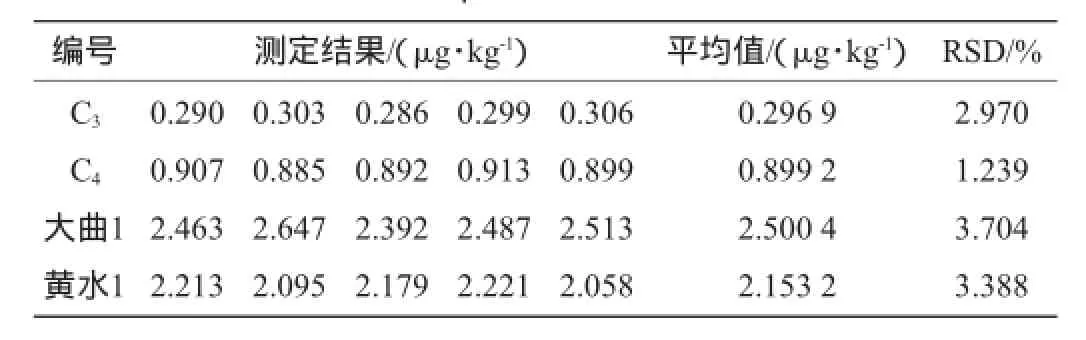
表2 黄曲霉毒素B1测定的精密度试验结果Table 2 Precision experiment results of aflatoxins B1
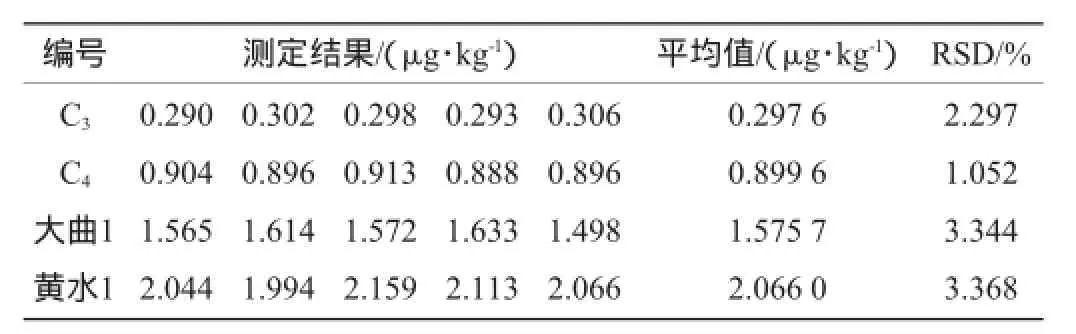
表3 赭曲霉毒素A测定的精密度试验结果Table 3 Precision experiment results of ochratoxin A
由表2和表3可知:黄曲霉毒素B1和赭曲霉毒素A测定结果的相对标准偏差(relative standard deviation,RSD)分别为1.239%~3.388%和1.052%~3.368%,精密度较好,说明该测定方法可应用于白酒酿造环节各样品中黄曲霉毒素B1和赭曲霉毒素A的定量分析。
2.5回收率试验
选取真菌毒素含量较高的黄水1作为试验样品,分别向样品中准确添加质量浓度为0.3 μg/kg、0.9 μg/kg、2.7 μg/kg的标准品,每个质量浓度测定3次,按照测定方法进行检测,所得结果如表4、表5所示。
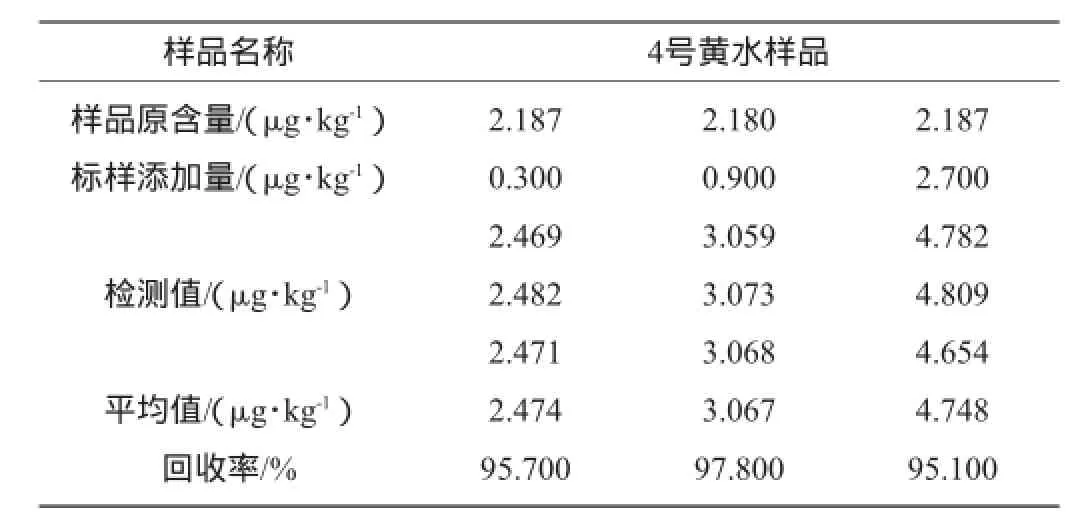
表4 黄曲霉毒素B1测定的回收率试验结果Table 4 Recovery rates experiment results of aflatoxins B1
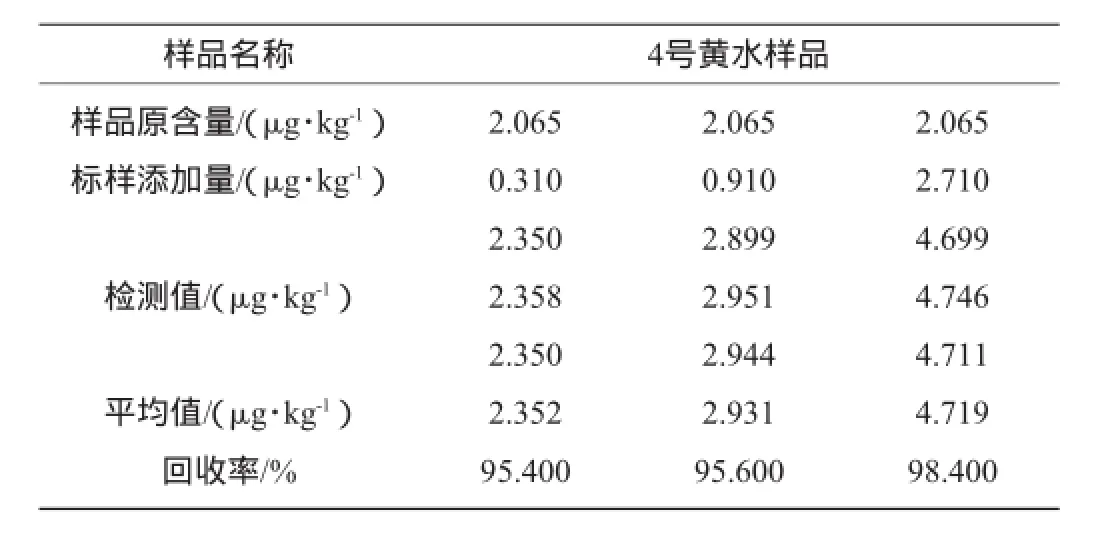
表5 赭曲霉毒素A测定回收率试验结果Table 5 Recovery rates experiment results of ochratoxin A
由表4和表5可知,黄曲霉毒素B1和赭曲霉毒素A样品加标测定的回收率分别为95.1%~97.8%和95.4%~98.4%,平均回收率分别为96.2%和96.4%,说明该测定方法的准确度较好。
3 结论
酶联免疫法是一种利用抗原和抗体的特异性免疫反应和酶的高效催化作用有机结合起来的检测技术,考虑到目前国内大多是白酒厂地处偏僻,检测条件较差,相关技术人员较少,商品化的真菌毒素检测试剂盒,具有特异性高、简便快速、污染小、不需要昂贵仪器等优点[14],特别适合于各大中小型酒厂对白酒原料、产品和副产物的检验,同时有利于运用白酒库存原料和大曲中真菌毒素污染监控中大量样本的筛检工作。
白酒业是我国的传统行业,历史悠久,对国民经济的发展发挥着十分重要的作用。因此,保证占据着我国白酒市场主导位置的浓香型白酒生产过程的安全性就显得很有必要[15-16]。本研究通过酶联免疫法检测了来自泸州老窖白酒酿造过程中各种样品3种真菌毒素的含量,结果表明,3种真菌毒素在浓香型白酒生产过程中的含量都在国内外限量标准以内[17-18],同时利用精密度检测试验和回收率试验说明该方法可以运用于白酒生产过程中的真菌毒素的检测。易于普及推广为白酒行业的安全性验证,为酿酒工业的长盛不衰奠定了坚实的基础。
[1]庄振宏,郑传琦,汪世华,等.黄曲霉培养条件的优化及黄曲霉毒素B1的提取[J].应用与环境生物学报,2010,16(5):724-729.
[2]WILSON C L,DROBY S.Microbial food contamination[M].New York: CRC Press,2001.
[3]GUO X,WEN F,ZHENG N,et al.Development of an ultrasensitive aptsensor for the detection of aflatoxin B1[J].Biosens Bioelectron,2014,56(1):340-344.
[4]时瑾,黄飚,孙蔚榕,等.ELISA法检测赭曲霉毒素A的改进研究[J].食品科学,2007,28(8):425-428.
[5]叶光斌,罗惠波,杨晓东,等.酶联免疫法检测赭曲霉毒素A在浓香型白酒生产中的变化[J].现代食品科技,2013,29(5):1144-1147.
[6]曹纪亮,孔维军,杨美华,等.真菌毒素快速检测方法研究进展[J].药物分析杂志,2013,33(1):159-163.
[7]CHIDUMAYO N N,YOSHII K,SAASA N,et al.Development of a tick-borne encephalitis serodiagnostic ELISA using recombinant Fc-antigen fusion proteins[J].Diagn Micr Infec Dis,2014,78(4):373-378.
[8]郑翠梅,张艳,王松雪,等.液相色谱-飞行时间质谱同时测定粮食中13种真菌毒素[J].分析测试学报,2014,31(4):383-389.
[9]JESTER E L,ABRAHAM A,WANG Y,et al.Performance evaluation of commercial ELISA kits for screening of furazolidone and furaltadone residues in fish[J].Food Chem,2014,145(7):593-598.
[10]卢安根,莫建光,杜寒春,等.酶联免疫法快速检测牛奶及其制品中的黄曲霉毒素B1[J].广西科学院学报,2010,6(3):306-308.
[11]中华人民共和国国家质量监督检验检疫总局.GB/T 23502—2009食品中赭曲霉毒素A的测定免疫亲和层析净化高效液相色谱法[S].北京:中国标准出版社,2009.
[12]中华人民共和国国家质量监督检验检疫总局.SN/T2916-2011出口食品中桔霉素的测定方法免疫亲和柱净化-高效液相色谱法[S].北京:中国标准出版社,2011.
[13]中华人民共和国卫生部.GB2761—2005食品中真菌毒素限量[S].北京:中国标准出版社,2005-01-25.
[14]WANG J J,LIU B H,HSU Y T,et al.Sensitive competitive direct enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip for detecting aflatoxin M1 in milk[J].Food Control,2011,22(6):964-969.
[15]王勇,罗惠波,刘燕梅,等.浓香型大曲中多株芽孢杆菌的分离及鉴定[J].四川理工学院学报:自然科学版,2015,28:5-8.
[16]王赞,李光辉,罗惠波,等.浓香型白酒窖泥厌氧细菌的分离鉴定[J].四川理工学院学报:自然科学版,2014,27:16-18.
[17]刘萤,王珮玥,刘雪平,等.我国现行食品与饲料中真菌毒素限量及检测标准概述[J].中国酿造,2014,33(7):10-19.
[18]冉宇舟,张海良,俞剑燊.由传统白酒、黄酒生产工艺想到的发酵食品安全问题[J].中国酿造,2013,32(7):119-120.
Safety testing of mycotoxins in Luzhou-flavor liquor production
LI Mi1,DENG Jie1,YANG Yuehuan1,WEI Chunhui1*,HUANG Zhiguo1,LUO Huibo1,YE Guangbin1,YANG Xiaodong2,HUANG Zhiyu3
(1.Liquor Making Bio-Technology&Application of Key Laboratory of Sichuan Province,Sichuan University of Science&Engineering,Zigong 643000,China;2.Industrial Park Management Committee of Jiang'an County,Jiang'an 644200,China;3.Wine Institute of Sichuan Province,Guanghan 610000,China)
The content of related mycotoxins in Luzhou-flavor liquor samples(Daqu,fermented grains,distiller's grains,yellow water,base liquor,final product)was detected with ELISA.The results showed that the content of aflatoxins B1in Daqu,fermented grains,distiller's grains and yellow water was 2.55 μg/kg,1.75 μg/kg,1.95 μg/kg and 2.25 μg/kg,respectively;the content of ochratoxin A in Daqu,fermented grains,distiller's grains,yellow water was 1.50 μg/kg,1.65 μg/kg,1.80 μg/kg and 2.05 μg/kg,respectively.Aflatoxins B1and ochratoxin A were not detected in both base liquor and final product,while citrinin was not detected in six kinds of samples.These three kinds of mycotoxins in samples all met the National Standards of fermented food.Moreover,precision and recovery experiments demonstrated that ELISA presented good stability to apply to quantitative analysis of samples from production process of Chinese liquor.
ELISA;mycotoxin;Luzhou-flavor liquor;safety
TS262.31
A
0254-5071(2015)10-0129-05
10.11882/j.issn.0254-5071.2015.10.029
2015-09-18
酿酒生物技术及应用四川省重点实验室开放基金项目(NJ2011-10,NJ2014-16);自贡市科技项目(2013X07,2014ZC03)
李觅(1989-),男,硕士研究生,研究方向为酿酒生物技术。
卫春会(1980-),女,高级实验师,硕士,研究方向为发酵工程。

