重组双链及单链腺相关病毒介导Exendin-4表达效率的比较*
王俊红,问姣,董鹏,张静,焦杨,郭永红
(1.西安交通大学医学院第二医院内分泌科,西安 710004;2.西安交通大学医学院第二医院肿瘤科,西安 710004; 3.西安交通大学医学院第二医院感染科,西安 710004)
1 引 言
糖尿病是威胁人类健康的慢性代谢性疾病,糖尿病在中国的发病率呈逐年上升趋势,患病率接近10%。治疗2型糖尿病口服降糖药多存在诱发低血糖、增加体重、胃肠道反应及继发性失效等缺点[1],而新型降糖药胰高血糖素样肽-l (Glucagon-like peptide-1,GLP-1)及其类似物可以克服以上缺陷,越来越受到重视[2]。Exendin-4是具有良好前景的GLP-1类药物,适用于二甲双胍和酰脲类药物治疗不理想的2型糖尿病患者[3-4]。目前的制剂为艾塞那肽注射液,每日皮下注射1-2次,Exendin-4的长效缓释皮下注射剂正在临床研究之中[5-7]。虽然Exednin-4 及其长效缓释制剂是理想的治疗糖尿病药物[8-10],但是Exendin-4 是仅有39个氨基酸的短肽,大量制备较困难,价格昂贵,因此,有必要以基因工程的方法制备Exednin-4,从而降低生产成本。
腺相关病毒(Adeno-associated virus,AAV)是一种非病原性的复制缺陷型人类病毒,能够特异的将其基因定点整合到人基因组19号染色体长臂(19ql3.4)的特定位点(AAVS1),具有不引起转导细胞免疫反应和插入性突变的特点,并能介导转基因的长期表达,成为目前安全性最好的理想基因治疗载体[11]。AAV基因组结构简单(全长仅有4.7 kb),仅编码Cap和Rep两个基因,但是由于AAV为单链DNA病毒,由单链基因组向有转录活性的双链形式转变限制了AAV载体介导的基因转导。双链DNA的腺相关病毒(Double-stranded adeno-associated virus, dsAAV)可越过病毒DNA第二条链合成限速步骤,从而显著提高AAV的转导效率。本研
究在已构建的可使Exendin-4分泌表达单链腺相关病毒(Single strand adeno-associated virus, ssAAV) 基础上[12],构建了重组双链AAV(Double-stranded adeno-associated virus, dsAAV),与单链重组病毒在表达效率及分泌Exendin-4浓度比较,为优化AAV基因治疗研究奠定基础。
2 材料
2.1 质粒与菌株
克隆载体pGEM-T-Easy质粒(50 ng/μL)购自Promega公司;pBV220-NT4质粒,辅助质粒pAAV-Ad,腺病毒全基因组质粒pFG140,腺相关病毒穿梭质粒pSSHG-CMV、改造的双链AAV载体及人胚肾293细胞系,大肠杆菌E. coliDH5α菌株等由西安华广生物工程公司提供。
2.2 工具酶和主要试剂
限制性内切酶NaeI、BamH I、EcoR I及TaqDNA聚合酶, T4 DNA连接酶等试剂购自华美生物工程公司。质粒小提试剂盒,PCR纯化试剂盒,DNA回收试剂,Marker等均购自北京天根公司。Exendin-4酶联试剂盒购自Phoenix pharmaceuticals INC公司,小鼠抗Exendin-4 抗体购自美国phoenix pharmaceuticals 公司,引物合成及测序由上海生物工程有限公司完成。
3 方法
3.1 双链腺相关病毒重组质粒pSSHG/NT4-Exendin-4 表达盒
ssAAV穿梭质粒pSSHG/NT4-Exendin-4构建已完成[12],重组AAV质粒表达盒见图1。

图1 双链腺相关病毒重组质粒pSSHG/NT4-Exendin-4 表达盒
3.2 构建dsAAV穿梭质粒dspSSHG/Exendin-4
T4连接酶分别将NT4信号肽-Exendin-4 cDNA 和△ITR-polyA片段3个片段连接入线性化的dsAAV载体,获得重组质粒dsAAV/pSSHG/Exendin 4,提取质粒,用限制性内切酶EcoR I和BamH I双酶切筛选并测序鉴定阳性克隆,筛选到的重组子命名为dsAAV/pSSHG/Exendin-4,同时构建表达绿色荧光的报告基因质粒dsAAV/pSSHG/GFP。
3.3 重组病毒滴度测定
重组质粒dsAAV/pSSHG/Exendin-4、辅助质粒pAAV-Ad、腺病毒全基因组质粒pFG140三种质粒磷酸钙共沉淀法转染HEK-293细胞,G418筛阳性转化细胞,收获并纯化重组病毒,收获的毒种感染293细胞加PBS液冰融细胞,离心取上清,-20℃保存进行病毒滴度测定。取重组病毒回收液100μl,加入蛋白酶K缓冲液100 μl及10 μl蛋白酶K,37℃孵育2 h;酚:氯仿抽提,无水乙醇沉淀,70%乙醇洗沉淀,溶于10 μl TE溶液中;将系列稀释度的dsAAV/pSSHG/Exendin 4质粒及病毒分别点样于NC膜上;加变性液于滤纸上,将NC膜浸于其上5 min,分别在中和液浸湿的滤纸及6×SSC浸湿的滤纸上5 min,干燥后置80℃ 2 h;NC膜68℃预杂交30 min;加入变性探针68℃杂交4 h;马来酸溶液室温洗NC膜5 min,加入地高辛抗体碱性磷酸酶复合物混匀, 37℃ 30min,10 ml探测液中漂洗3 min,加入5 ml新配制的显色液, 37℃温箱避光反应16 h,漂洗、干燥后根据结果计算病毒滴度。按Boehringer Mannheim公司试剂盒说明书进行。通过计算重组质粒的拷贝数、再乘以与其杂交信号强度一致的病毒液样品的稀释倍数而得出滴度,使用相同的方法包装表达GFP报告基因的dsAAV病毒并测定AAV滴度。
3.4 表达GFP的AAV转染NIH3T3细胞
常规复苏NIH3T3细胞;用含10%小牛血清培养基, 37℃ 5%CO2孵箱培养;细胞长满后进行传代;NIH3T3细胞80%成片后100感染复数(Multiplicity of infection,MOI)剂量感染重组病毒pSSHG/GFP,2 h后更换完全培养基,48 h后置荧光倒置显微镜下观察和拍照。
3.5 检测重组病毒转导NIH3T3细胞培养基上清Exendin-4浓度
NIH3T3细胞80%成片后100 MOI剂量感染重组病毒dsAAV/pSSHG/Exendin-4,2 h后更换完全培养基,收集感染后72 h的培养基上清;上清离心后按Phoenix pharmaceuticals INC酶联试剂盒说明书测定Exendin-4浓度,每份标准品和标本重复测3次,取平均值。
3.6 免疫组化检测重组病毒转染NIH3T3细胞
L-多聚赖氨酸包被的无菌盖玻片置于培养皿内,将细胞直接种入,置于37℃5% CO2孵箱培养,待80%细胞成片后,分别加入100 MOI重组AAV和等体积PBS, 60 h后取出玻片,丙酮室温固定15 min;PBS(0.lmol/L,pH7.4)洗3次,每次5 min(以下同), 0.75%H2O2水(40:l)50μl,37℃ 30 min阻断细胞内源性过氧化物酶活性, PBS洗3次;0.5%TritonX-100 50 μl,透膜30 min,PBS洗3次;加入50 μl 20%胎牛血清,37℃湿盒内封闭30 min;l:500抗Exendin-4抗体,37℃孵育4 h, PBS洗涤5次;加辣根过氧化物酶(HRP)标记羊抗鼠二抗, 37℃孵育2h,PBS洗3次;0.5 mg/ml二氨基联苯胺(DAB)和0.03%H2O2显色10 min。
3.7 所有数据采用SPSS17.0软件分析,不同组间比较采用单因素方差分析(ANOVA)进行统计学处理, P<0.05有显著统计学差异。
4 结果
4.1 重组质粒pSSHG/Exendin-4鉴定
EcolRI和BamHⅠ双酶切重组质粒,经电泳检测显示酶切成pSSHG(7.2kb)片段和NT4-Exendin-4 (376bp)片段(见图2)。Exendin-4的分泌表达盒测序结果和数据库序列经Blast比对完全一致。
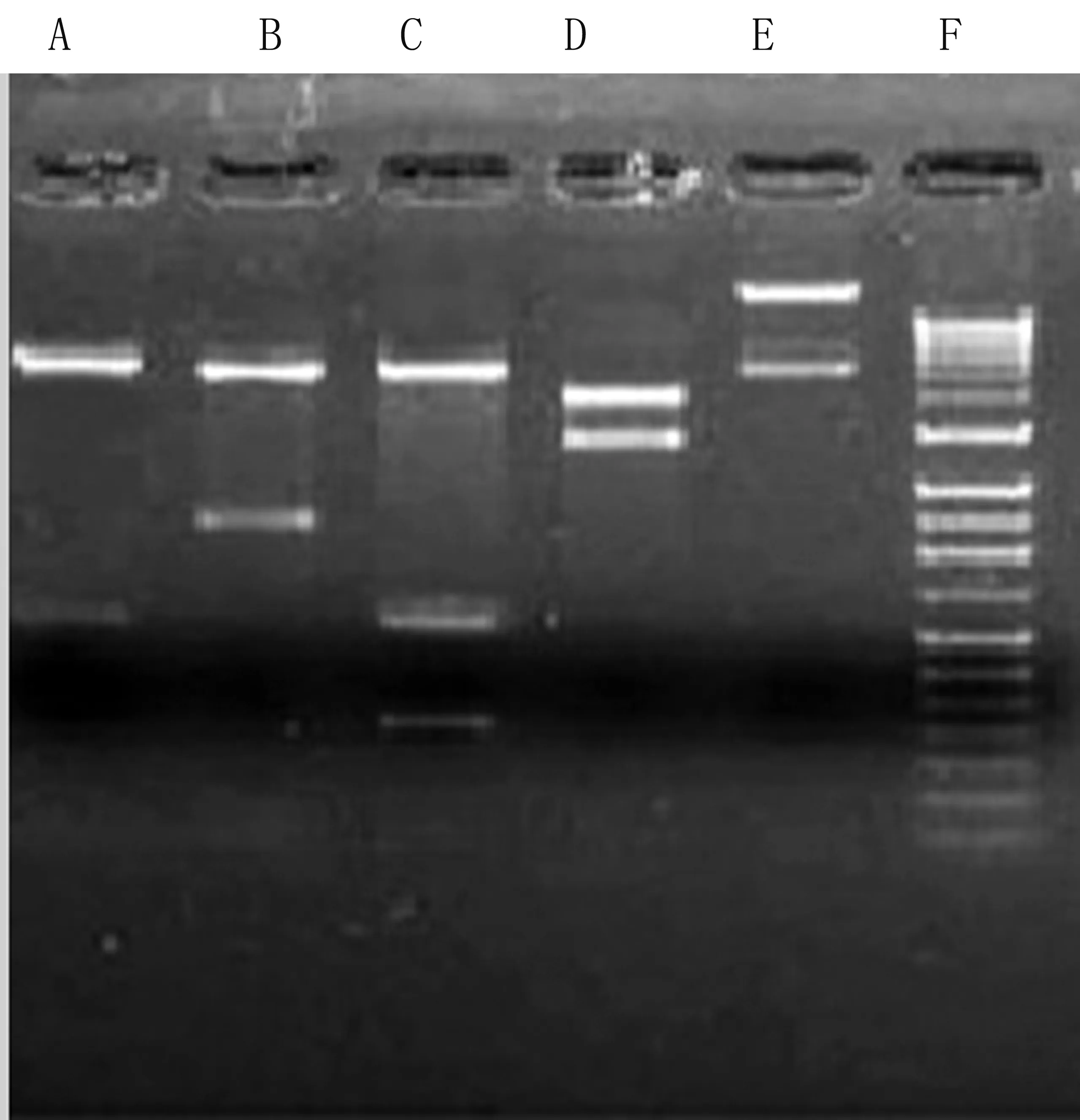
图2 重组质粒pSSHG/NT4-Exendin-4酶切鉴定
Fig2IdentifiedrecombinantplasmidpSSHG/NT4-Exendin-4byrestrictionenzymedigestion
A: pSSHG/Exendin-4/BamHI
B: pSSHG/Exendin-4/EcoRI
C: pSSHG/Exendin-4/EcoRI+BamHI
D: pSSHG/Exendin-4/XbaI E: pSSHG质粒
F: DNA Marker 分子量 100bp,200bp,300bp,400bp,500bp,600bp,750bp,1000bp,1314bp,1614bp,2011bp,4.0kb,5.0kb,6.0kb,7.0kb,8.0kb,9.0kb,10.0kb,11kb,12kb,13kb
4.2 重组双链及单链腺相关病毒滴度测定
293T细胞感染重组病毒24 h后局部细胞变圆、脱落,成网状,出现了明显的气球样变,呈典型感染表现。参照杂交结果测定出重组病毒的滴度,测定dsAAV/pSSHG/Exendin-4滴度为2.5×1011pfu,较ssAAV/pSSHG/Exendin-4滴度高(2.5×109pfu)。
4.3 表达GFP的重组AAV转染NIH3T3细胞
使用表达GFP的对照dsAAV转染NIH3T3细胞,与表达GFP的重组ssAAV比较,荧光表达明显增强(见图3)。
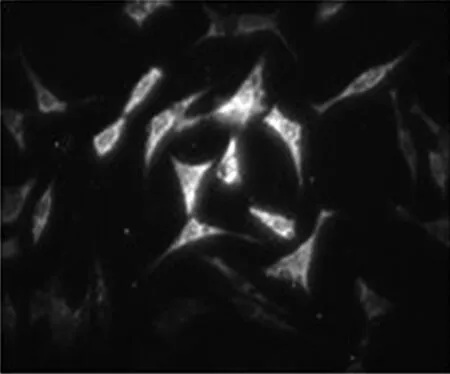
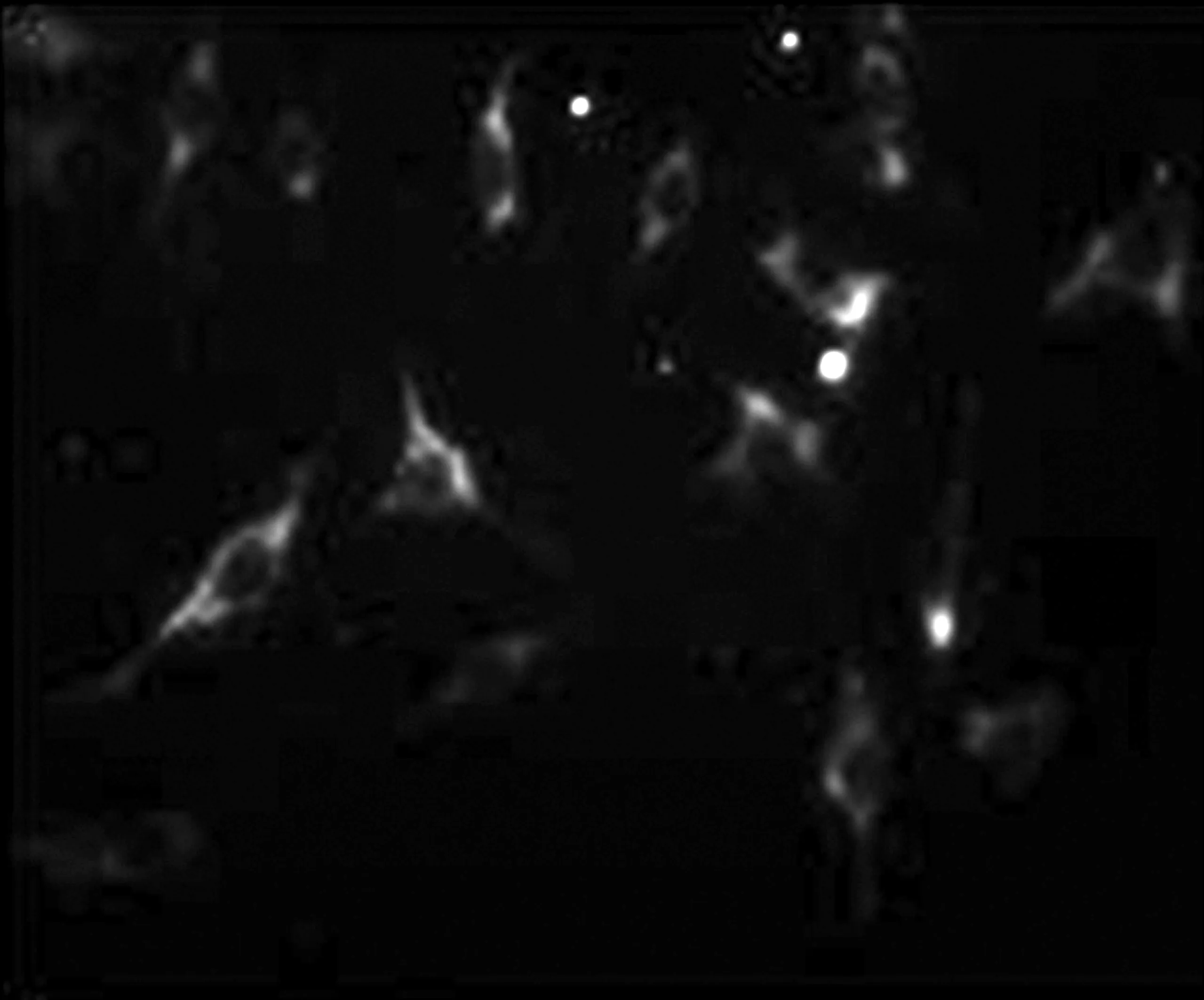
图3 表达GFP的重组dsAAV及ssAAV转染NIH3T3细胞
Fig3ImmunofluorescenceanalysesofGFPindsAAVandssAAV-treatedNIH3T3
4.4 重组病毒转染NIH3T3细胞培养基上清Exendin-4浓度
酶联免疫试剂盒检测dsAAV/pSSHG/Exendin-4感染细胞后上清中Exendin-4的浓度为181.1±8.75 pmol/mg,较ssAAV/pSSHG/Exendin-4组浓度(133.81 ± 8.09 pmol/ml)升高(见图4),两者相比,有显著统计学差异(P<0.05)。
4.5 免疫组织化学法检测转染重组病毒转染NIH3T3细胞Exendin-4的表达
重组dsAAV/pSSHG/Exendin-4及ssAAV/pSSHG/Exendin-4转染NIH3T3细胞72 h,Exendin-4的表达均呈阳性(见图5)。

图4EILSA检测重组病毒转染NIH3T3细胞后上清中Exendin-4浓度(单位:pmol/ml),*P<0.05,**P<0.01,***P<0.001.
control组:未转导病毒的NIH3T3细胞培养基上清
ssAAV组:转染ssAAV/pSSHG/Exendin-4培养基上清检测
dsAAV组:转染dsAAV//pSSHG/Exendin-4培养基上清检测
Fig4Exendin-4levels(pmol/ml)assessedbyELISAinthesupernatantofrecombinantplasmid-transfectedNIH3T3cell
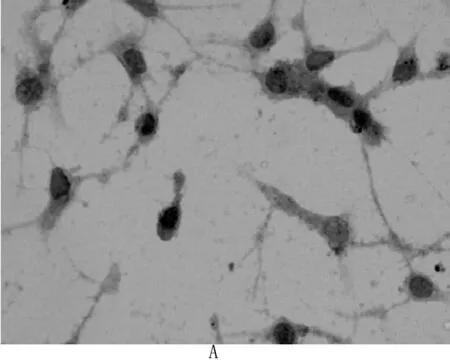

图5免疫组化检测转染重组dsAAV及ssAAV的NIH3T3细胞Exendin-4表达
A:dsAAV/pSSHG/Exendin-4转染NIH3T3细胞 (20×10)
B:ssAAV/pSSHG/Exendin-4转染NIH3T3细胞(20×10)
Fig5HistologicalandimmunohistochemicalanalysesofExendin-4indsAAVandssAAV-treatedNIH3T3
5 讨论
AAV是直径约26 nm的无包膜二十面体病毒颗粒,微小病毒科依赖病毒属成员之一[13]。AAV不但安全性好,而且宿主范围广泛;能够实现外源基因长期稳定表达,因此,是目前在基因治疗中最受欢迎的病毒载体之一,其中AAV2应用最为广泛[14]。AAV2 基因组是4.7kb的单链线性 DNA,由反向末端重复序列(Inverted terminal repeats, ITRs)和两个开放式阅读框架(open reading frames, ORFs)构成。为保证重组腺相关病毒载体的安全性,研究者仅保留了DNA复制和病毒包装所必需的ITRS。ITRs 是AAV的顺式作用元件,提供AAV DNA的复制起始位点和互补链合成的引物。因此,AAV不具有定点整合的能力,而是以染色体外附加体(Extrachromosomal elements)的形式存在于宿主细胞核中[15]。但是AAV自身携带能力有限,不适用于大分子蛋白的基因传递,进入机体细胞后,需要将自身的单链复制成双链才能发挥生物学效应,因此,很难在应用后迅速发挥作用。dsAAV的工作原理是将AAV包装系统中载体质粒的一侧的D序列去掉后,在复制过程中,复制中间产物就不能被切割,所以,最终复制产物为比载体基因组长一倍且经自身互补而成为双链的AAV基因组,并最终被包装入AAV衣壳中,得到携带双链基因组的AAV载体[16]。dsAAV进入细胞后可以直接表达,而且表达水平相对较高,对于糖尿病等慢性疾病而言,非常适合应用在目的基因的治疗方案中[17]。我们设想以dsAAV为载体,实现Exendin-4体内长期、稳定表达,达到理想的治疗糖尿病的目的。
本研究中构建的dsAAV利用△ITR的发夹结构使两个反向互补的表达盒自互补成双链,进入细胞后立即启动表达,因此提高了表达效率。为了便于观察融合基因的表达,用GFP代替Exendin-4的基因序列构建对照载体,可通过观察GFP表达来证实单链及双链AAV表达。dsAAV感染NIH3T3细胞荧光表达强度明显提高,证实dsAAV的表达效率较ssAAV提高。EILSA检测同样证实dsAAV系统可使Exendin-4在NIH3T3细胞上清分泌表达量提高,与ssAAV相比具有统计学差异。免疫组化检测也证实dsAAV及ssAAV均可使Exendin-4在NIH3T3细胞表达,说明本实验构建的重组AAV可以在真核细胞内分泌表达Exendin-4。
本实验中选用AAV载体作为基因治疗载体,在已构建的ssAAV分泌表达Exendin-4的基础上,构建、包装的重组dsAAV浓缩后滴度可达2.5×1011pfu,具有感染能力,转染细胞后可持续稳定的分泌表达目的基因Exendin-4,提高治疗基因的表达效率,为进一步通过动物实验研究Exendin-4基因在糖尿病治疗过程中的效果打下基础。
(王俊红,问姣对本研究具有相同贡献。)

