重组精氨酸脱亚胺酶制备L-瓜氨酸的工艺条件优化
马越宿玲恰吴丹吴敬
(1.江南大学 食品科学与技术国家重点实验室,无锡 214122;2.江南大学生物工程学院 工业生物技术教育部重点实验室,无锡 214122)
重组精氨酸脱亚胺酶制备L-瓜氨酸的工艺条件优化
马越1,2宿玲恰1,2吴丹1,2吴敬1,2
(1.江南大学食品科学与技术国家重点实验室,无锡214122;2.江南大学生物工程学院工业生物技术教育部重点实验室,无锡214122)
将来源于Pseudomonas putida ACCC 10185的ADI编码基因克隆到表达载体pET-24a(+)中,转化Escherichia coli BL21(DE3),通过超声波破碎得到粗酶液,酶活检测ADI酶活为26 U/mL发酵液。对酶转化L-精氨酸盐酸盐生成L-瓜氨酸的反应条件进行了优化,结果表明,当底物L-精氨酸盐酸盐浓度650 g/L,反应初始pH6.0,温度37℃,加酶量24 U/g底物,转速100-200 r/min,转化时间7 h,L-瓜氨酸转化率达到100%,是目前国内外报道的酶法制备L-瓜氨酸的最高水平。
精氨酸脱亚胺酶;L-瓜氨酸;酶转化;重组表达
L-瓜氨酸是一种游离的氨基酸,是人体尿素循环的重要中间代谢物,具有多种生理功能。利尿、护肝,可与L-鸟氨酸、L-精氨酸等共同治疗高氨血症[1,2];参与内源性细胞舒张因子一氧化氮的合成,有助于扩张血管、抑制动脉硬化,可用于治疗高血压、冠心病及男性性功能障碍等疾病[3-5];在肠道中L-瓜氨酸通过谷氨酸-鸟氨酸代谢途径合成,可作为检验小肠移植时异体排斥效应程度的指示剂[6];L-瓜氨酸与精氨酸结构相似,对体内自由基表现出高度的活性,可作为天然高效的新抗氧化剂[7],由此可见L-瓜氨酸在医药用品、保健食品以及化妆品中应用前景广阔。随着人们保健意识的提高,对L-瓜氨酸的需求量日益增多,因此生产L-瓜氨酸具有重大的意义。
L-瓜氨酸主要是由精氨酸脱亚胺酶(arginine deiminase,ADI,EC3.5.3.6)催化L-精氨酸盐酸盐水解生成L-瓜氨酸和氨[8,9]。利用ADI催化生成L-瓜氨酸由于原料易得、工艺简单、产物浓度高等优点逐渐成为L-瓜氨酸制备的潜力途径。
本研究将来源于Pseudomonas putida ACCC 10185[10]的ADI基因(arcA)连接到表达载体pET-24a(+),获得重组质粒pET-24a(+)-arcA,将其转化Escherichia coli BL21(DE3)并进行摇瓶发酵,经超声波破碎,检测破壁上清液中的ADI 酶活。在此基础上,对酶转化工艺进行研究,旨在获得高效制备L-瓜氨酸的方法。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 恶臭假单胞菌(Pseudomonas putida ACCC 10185):由ACCC菌种保藏中心购买;E.coli JM109、E.coli BL21(DE3)、表达载体pET-24a(+):为本实验室保藏;克隆载体pMD18-T Simple vector:购自TaKaRa公司。
1.1.2 培养基 LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,卡那霉素0.03,pH7.0。
TB培养基(g/L):蛋白胨12,酵母粉24,甘油5,K2HPO42.31,KH2PO416.43, 卡 那 霉 素0.03,pH7.0。
1.1.3 试剂 限制性内切酶、T4 DNA连接酶、PrimerStar HS DNA聚合酶、碱性磷酸酶CIAP、核酸分子量标准及琼脂糖:购自TaKaRa公司;PCR产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒:天根生化科技有限公司;卡那霉素、氨苄青霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白质相对分子质量标准、L-精氨酸盐酸盐、瓜氨酸标样:购自生工生物工程(上海)有限公司;其它分析纯试剂均购自国药集团化学试剂有限公司。
1.1.4 主要仪器 凝胶成像仪、蛋白电泳仪购自美国Bio-Rad公司;DYY-6C型核酸电泳仪购自北京六一仪器厂;高效液相色谱仪购自Agilent公司;细胞破碎仪购自北京科实兴业科技有限公司;紫外可见光分光光度计购自日本Shimadzu公司。
1.2 方法
1.2.1 工程菌的构建 提取Pseudomonas putida ACCC 10185的基因组,PCR扩增目的基因arcA,将所得片段割胶回收后,连接克隆载体pMD18-T Simple vector,将连接产物转入E.coli JM109感受态细胞中,在平板培养基上培养过夜,挑取单克隆至液体培养基中培养,抽提质粒得到pMD18-T-arcA,经NdeⅠ和Hin d Ⅲ双酶切后,将目的基因片段割胶回收,T4连接酶将目的基因与经相同酶切处理的表达载体pET-24a(+)连接,连接产物转入E.coli JM109感受态细胞中,在平板培养基培养过夜后,挑取单克隆进行液体培养,抽提得到重组质粒pET-24a(+)-arcA。将pET-24a(+)-arcA进行双酶切验证,验证正确后转入E.coli BL21(DE3)感受态细胞中,涂布LB平板培养基,挑取单克隆进行液体培养,保存甘油管,-80℃保存。
1.2.2 摇瓶发酵生成ADI
1.2.2.1 种子培养 接一定量-80℃ 甘油管中保存的菌液至LB培养基,37℃、200 r/min,培养8 h。
1.2.2.2 摇瓶发酵 将种子液以5%的接种量转接至TB培养基,37℃培养至OD600约为1.0时,加入终浓度为0.4 mmol/L的IPTG[11,12],置于25℃、转速200 r/min进行重组蛋白的诱导表达,诱导18 h后离心收集菌体,用50 mmol/L,pH6.0 Na2HPO4-NaH2PO4缓冲液复溶菌体至5 OD,超声波破碎后离心,破壁上清即为ADI粗酶液,测定粗酶液中的ADI酶活,经与发酵液OD折算后,即为每毫升发酵液中的ADI酶活。
1.2.3 ADI活性测定 利用二乙酰一肟-氨基硫脲比色法测定ADI酶活[13]。用50 mmol/L,pH6.0的磷酸盐缓冲液配制0.2 mol/L L-精氨酸盐酸盐溶液作为底物,取100 μL适当稀释的酶液加入1 mL底物中,于37℃条件下反应30 min,加入1 mL 10%三氯乙酸终止反应,沸水浴5 min,稀释一定倍数后测定瓜氨酸含量,并计算酶活。酶活定义:37℃条件下,每分钟转化1 μmol L-精氨酸盐酸盐生成瓜氨酸的酶量定义为1 U。
1.2.4 L-瓜氨酸的制备及含量测定 以50 mmol/L,pH6.0的磷酸盐缓冲液配制浓度为650 g/L的L-精氨酸盐酸盐溶液,加酶量为24 U/g底物,与一定量的酶液充分混匀后在37℃、100-200 r/min水浴摇床中反应7 h。转化后的反应液加入等体积的三氯乙酸后,静置2 h,12 000 r/min离心10 min,取上清进行分析。利用HPLC进行产物分析的色谱条件是:Agilent 1200 HPLC色谱仪,Agilent自动进样器,色谱柱250×4.6 mm 5 μm Inertsil ODS-3 Column,Agilent紫外检测器;流速0.8 mL/min;柱温40℃。转化率定义为生成的L-瓜氨酸的摩尔数/L-精氨酸盐酸盐的摩尔数×100%。
2 结果
2.1 ADI重组菌的构建
2.1.1 重组质粒pET-24a(+)-arcA的构建 提取Pseudomonas putida ACCC 10185的基因组,PCR扩增目的基因arcA,将携带目的基因的质粒pMD18-T和本实验室质粒pET-24a(+)分别经Nde Ⅰ和Hin dⅢ双酶切后,割胶回收目的基因片段和pET-24a(+),连接后转入E.coli JM109感受态细胞,培养重组菌并抽提质粒。重组质粒经Nde Ⅰ和Hin d Ⅲ双酶切验证,结果(图1)显示,在大约5 300 bp和1 300 bp处有条带,分别与载显体及基因大小一致,表明重组表达载体pET-24a(+)-arcA构建成功。
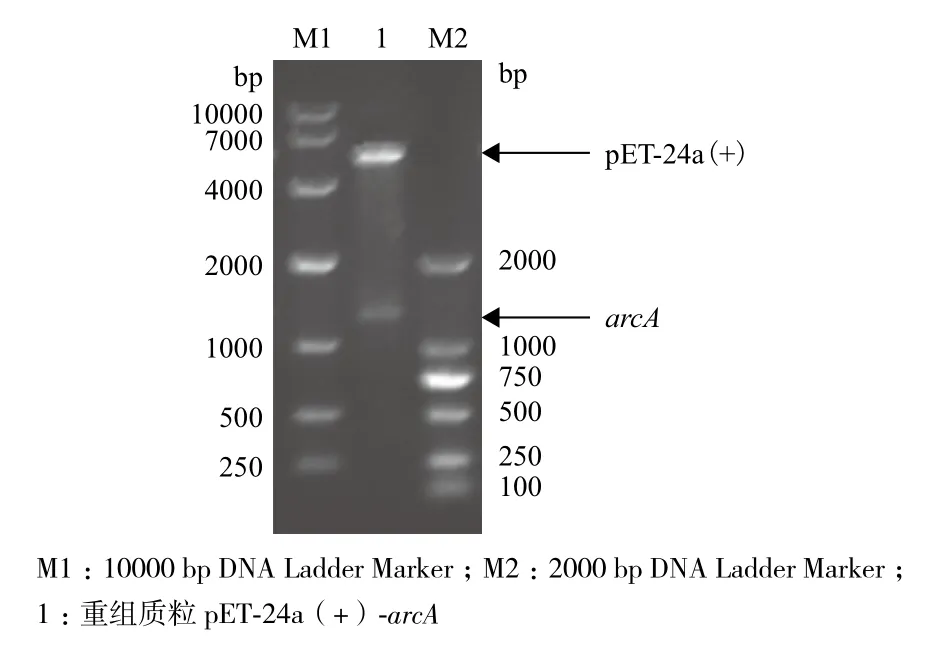
图1 重组质粒pET-24a(+)- arcA酶切验证
2.1.2 重组菌E.coli BL21(DE3)/ pET-24a(+)-arcA的构建及培养 将重组质粒pET-24a(+)-arcA转化E.coli BL21(DE3)感受态细胞,经0.4 mmol/L IPTG诱导培养后收集菌体,处理后得ADI粗酶液。经检测,ADI酶活为26 U/mL发酵液。SDS-PAGE(图2)分析显示,ADI破壁上清液在大约43 kD处出现一条蛋白条带,与理论ADI分子量相符,表明ADI在E.coli BL21(DE3)中成功表达。
2.2 重组ADI制备L-瓜氨酸转化条件优化
2.2.1 反应温度对酶转化的影响 以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,pH6.0,转速100-200 r/min,分别在30℃、37℃、40℃、50℃、60℃和70℃水浴摇床中转化7 h,HPLC检测L-瓜氨酸生成量。图3表明,高温条件下转化率较低,而低温条件下转化率明显提高,最高值为100%。这是因为低温有利于酶的稳定,而高温时酶的热稳定性较差,反应过程中酶易失活,导致转化率较低,因此37℃为最佳转化温度。
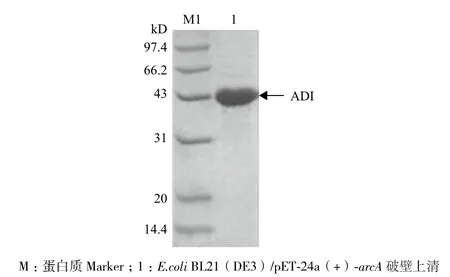
图2 精氨酸脱亚胺酶SDS-PAGE分析
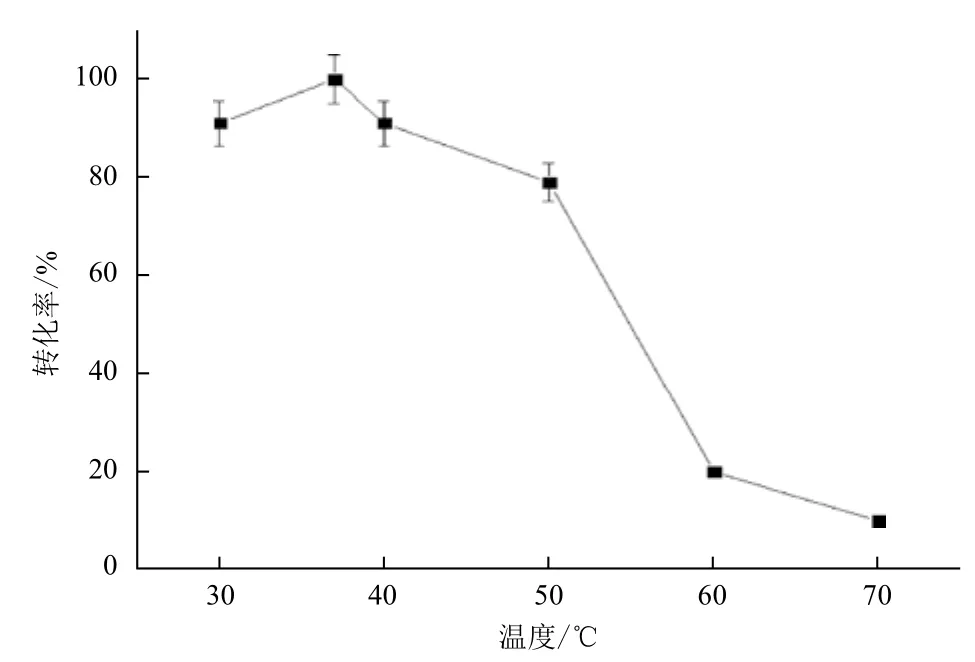
图3 反应温度对酶转化的影响
2.2.2 反应初始pH对酶转化的影响 以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,反应温度37℃,转速100-200 r/min,分别在pH4.0、5.0、5.5、6.0、6.5、7.0和8.0中转化7 h,HPLC检测L-瓜氨酸生成量。图4表明,当初始pH为6.0时,L-瓜氨酸转化率为100%。pH的改变可使酶分子上的侧链基团处于不同的解离状态,影响底物的结合和进一步的反应,或者影响酶的空间结构,从而影响酶的活性,因此过酸或过碱对酶促反应都不利,在pH为6.0时L-瓜氨酸转化率最高。

图4 反应初始pH对酶转化的影响
2.2.3 加酶量对酶转化的影响 以100 g/L L-精氨酸盐酸盐为底物,加入不同量的ADI,加酶量分别为底物12、24和36 U/g,反应温度37℃,pH6.0,转速100-200 r/min,转化3.5 h,HPLC检测L-瓜氨酸生成量。图5表明,随着加酶量的增多,相同时间内L-瓜氨酸转化率逐渐增大,但是不同加酶量条件下,L-瓜氨酸转化率均能达到100%。考虑到经济性因素,选择加酶量为底物24 U/g。

图5 加酶量对酶转化的影响
2.2.4 底物浓度与反应时间对酶转化的影响 分别配制浓度为50、100、150、200、300、400和650 g/L的L-精氨酸盐酸盐溶液,加酶量为24 U/g底物,反应温度37℃,pH6.0,转速100-200 r/min,定时取样,HPLC检测L-瓜氨酸生成量。图6表明,随着L-精氨酸盐酸盐浓度的增大,相同时间内L-瓜氨酸转化率越来越低,但随着转化时间的延长,L-瓜氨酸的浓度不断增加,最终均能达到100%,因此将转化时间定为7 h。

图6 底物浓度对酶转化的影响
2.2.5 转速对酶转化的影响 以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,反应温度37℃,pH6.0,分别在转速100、150和200 r/min中转化7 h,HPLC检测L-瓜氨酸生成量。结果显示,不同转速对L-瓜氨酸转化率无影响。
3 讨论
早在1971年,来自日本的Kakimoto等[14]就利用Pseudomonas putida ATCC 4359 ADI生产瓜氨酸,以L-精氨酸盐酸盐为底物,反应62 h后转化率达到90.5%;1973年,Chibata等[9]报道同一来源的ADI,以L-精氨酸或DL-精氨酸为底物,可生产瓜氨酸浓度达80 g/L以上;1974年,Yamamoto等[15]用聚丙烯酰胺凝胶包埋上述来源的细胞,可将浓度0.5 mol/L的L-精氨酸盐酸盐完全转化为L-瓜氨酸;2014年,王颖等[16]将来源于Pseudomonas putida ATCC 4359的ADI在E.coli中克隆表达,利用重组菌制备的粗酶液可将20 g/L L-精氨酸有效转化为L-瓜氨酸,转化率高于90%,该酶显示出了与来源于Pseudomonas putida ACCC 10185的ADI 99.76%的同源性。
我国对于其他来源的ADI转化L-精氨酸盐酸盐生成L-瓜氨酸的研究也有一些报道。2005年,曹瑜等[17]利用Streptococcus faecalis NJ402游离细胞的ADI,在10 L转化罐中,可将质量浓度200 g/L的L-精氨酸完全转化成L-瓜氨酸。2006年,张鹏等[18]运用海藻酸钠包埋法固定化Streptococcus faecalisCGMCC 1866细胞生产L-瓜氨酸,L-精氨酸转化率高达99%。2008年,郑璞等[19]利用填充床反应器固定化假单胞菌细胞连续制备L-瓜氨酸,固定化细胞对底物的摩尔转化率在95%以上。同年,姚海峰等[20]利用Streptococcus faecalis BT001,作用于浓度为96 g/L的L-精氨酸,转化率达到98%;2010年,赵艳杰等[21]利用海藻酸钠固定化上述细胞,填充床反应器中连续转化浓度为100 g/L的L-精氨酸底物,摩尔转化率为95.1%;2011年,屈冉[22]利用聚氨酯固定化上述细胞,填充床反应器中转化浓度为100 g/L的L-精氨酸底物,L-瓜氨酸的产量在65 g/L左右。同年,郑雄敏等[23]利用高产ADI Streptococcus faecalis BM-2 CGMCC No.4990 菌株,在30 L发酵罐上小试发酵,产L-瓜氨酸量达到98 g/L。2012年,胡延奇[24]利用工程菌中的ADI作用于质量浓度60 g/L的精氨酸,瓜氨酸的产量达55.1 g/L。
本实验在E.coli BL21(DE3)中成功表达了来源于Pseudomonas putida ACCC 10185的ADI,酶活力单位为26 U/mL。重点考察了该重组酶制备L-瓜氨酸的应用,考察了温度、pH、底物浓度、加酶量等对酶转化的影响,在最优条件下能将650 g/L的L-精氨酸盐酸盐完全转化成L-瓜氨酸,均高于上述研究。下一步的研究重点是将该重组菌在3 L发酵罐中进行优化,获得更高表达量的酶液,为工业化奠定基础。同时,该工艺流程简单,操作方便,这为L-瓜氨酸的工业化生产奠定了坚实的基础,具有广阔的实际应用前景。
4 结论
本研究成功获得了能够胞内表达ADI的重组E.coli BL21(DE3)菌株,初步实验表明重组菌发酵液ADI酶活可达26 U/mL。采用该重组ADI优化了酶法制备L-瓜氨酸的工艺条件。结果表明,底物L-精氨酸盐酸盐浓度650 g/L,反应pH6.0,温度37℃,加酶量24 U/g底物,转速100-200 r/min,转化时间7 h,L-瓜氨酸转化率可达100%。
[1]张克旭. 氨基酸发酵工艺学[M]. 北京:中国轻工业出版社,1992.
[2] 胡学智. 日本功能性食品研发信息[J]. 山东食品发酵, 2007(3):14-15.
[3]王晶, 赵晶. 一氧化氮的生物学效应[J]. 中国基层医药,2003, 10(12):1316-1318.
[4]王冰梅. 瓜氨酸——一氧化氮循环[J]. 中国体育科技, 2005,41(5):130-131.
[5]刘娟, 路欣欣, 孟慧. 瓜氨酸的药理作用及生产方法的研究进展[J]. 药学实践杂志, 2011, 29(3):173-175.
[6]Lutgens L, Lambin P. Biomarkers for radiation- induced small bowel epithelial damage:An emerging role for plasma Citrulline[J]. World Journal of Gastroenterology, 2007, 13(22):3033-3042.
[7]Foyer CH, Descourvoeres P, Kunert KJ. Protect ion against oxygenradicals:an important defence mechanism studied in transgenic plants[J]. Plant Cell and Environment, 1994, 17(5):507-523.
[8]Shinji O, Yo kohama S, Masao S. Method of production citrulline by bacterial fermentation:US, 3282794[P]. 1966-07-16.
[9]Chibata I, Shi S, Kakimoto T, et al. Enzymatic preparation of L-citrulline:US, 3730838[P]. 1973-05-13.
[10]Hermes H, Croes L, Peeters W, et al. Metabolism of amino acid amides in Pseudomonas putida ATCC 12633[J]. Appl Microbiol Biotechnol, 1993, 40:519-525.
[11]Ni Y, Li Z, Sun Z. Exp ression of arginine deim inase from Pseudomonas plecoglossicida CGMCC2039 in Escherichia coli and its anti-tumor activity[J]. Curr Microbiol, 2009, 58(6):593-598.
[12]刘咏梅, 倪烨, 李娜, 等. 精氨酸脱亚胺酶基因在大肠杆菌中的克隆、表达及纯化[J]. 食品与生物技术学报, 2011, 30(5):750-756.
[13]钱嘉南, 孙志浩, 刘宇鹏, 等. 二乙酰一肟-氨基硫脲比色法测定酶转化液中的L-瓜氨酸[J]. 中国医药工业杂志, 2007,38(7):519-521.
[14]Kakimoto T, Shibatani T, Nishimura N, et al. Enzymatic production of L-citrulline by Pseudomonas putida[J]. Applied Microbiology,1971, 22(6):992-999.
[15]Yamamoto K, Sato T, Tosa T, et al. Continuous production of L-citrulline by immobilized Pseudomonas putida cells[J]. Biotechnol Bioeng, 1974, 16(12):1589-1599.
[16]王颖. 酶法转化制备L-瓜氨酸暨精氨酸脱亚氨基酶的性质研究[D]. 济南:山东大学:2014.
[17] 曹瑜, 李加友, 焦庆才. 酶法转化制备L瓜氨酸[J]. 精细化工,2005, 22(10):759-761.
[18]张鹏, 张淑荣, 刘春巧, 等. 固定化细胞连续生产L-瓜氨酸的方法:中国, CN1948464A[P]. 2006- 11- 24.
[19]郑璞, 倪晔, 张文. 填充床反应器中固定化假单胞菌细胞连续制备L-瓜氨酸[J]. 食品与生物技术学报, 2008, 27(5):33-38.
[20]姚海峰, 张淑荣, 欧成武, 等. 粪链球菌转化合成L-瓜氨酸的研究[J]. 食品工业科技, 2008, 29(6):256-258.
[21]赵艳杰, 曾倡, 张淑荣, 等. 固定化粪链球菌酶法连续生产L-瓜氨酸[J]. 北京化工大学学报:自然科学版, 2010, 37(4):98-102.
[22]屈冉. 聚氨酯固定化粪链球菌制备L-瓜氨酸的研究[D]. 北京:北京化工大学, 2011.
[23]郑雄敏, 王震, 刘倩高. 产精氨酸脱亚胺酶菌株及用它生产L-瓜氨酸的方法:中国, CN102703339A[P]. 2011-8-29.
[24]胡延奇. L-瓜氨酸的工程菌制备及在卷烟中的应用[J]. 食品工业, 2012, 33(8):55-58.
(责任编辑 马鑫)
Optim ization of Preparing L-citrulline by Recombinant Arginine Deim inase
Ma Yue1,2Su Lingqia1,2Wu Dan1,2Wu Jing1,2
(1. State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi214122;2. School of Biotechnology,Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi214122)
The arcA gene encoding ADI from Pseudomonas putida ACCC 10185 was cloned into the expression vector pET-24a(+). The vector was then transformed into Escherichia coli BL21(DE3)for intracellular production of ADI. The crude enzyme was obtained by ultrasonic treatment, and activity in the fermentation broth of recombinant E. coli BL21(DE3)was 26 U/mL. Furthermore, the condition for enzymatic conversion of L-arginine monohydrochloride to L-citrulline by the recombinant ADI was optimized. At 650 g/L of L-arginine monohydrochloride, pH6.0, 37℃, 100-200 r/min, and 24 U ADI per gram substrate incubated for 7 hours, 100% of the L-arginine monohydrochloride was transformed into L-citrulline, which was the highest level of preparing L-citrulline by enzyme method in home and abroad presently.
arginine deiminase;L-citrulline;enzymatic conversion;recombinant expression
10.13560/j.cnki.biotech.bull.1985.2015.08.026
2014-12-10
马越,女,硕士研究生,研究方向:重组酶的制备和应用;E-mail:fionamy0912@sina.com
吴丹,男,硕士生导师,研究方向:食品与发酵研究;E-mail:bioenwu@aliyun.com

