羽衣甘蓝下胚轴农杆菌介导遗传转化体系的优化
高航高玉亮李葵花
(1.延边大学农学院,延吉 133002;2.延边朝鲜族自治州农业科学院,龙井 133400)
羽衣甘蓝下胚轴农杆菌介导遗传转化体系的优化
高航1高玉亮2李葵花1
(1.延边大学农学院,延吉 133002;2.延边朝鲜族自治州农业科学院,龙井 133400)
以红鸥羽衣甘蓝下胚轴为试材,首先优化了不定芽分化体系,其次探讨了农杆菌介导遗传转化过程中农杆菌侵染浓度、侵染时间对不定芽分化率的影响及不定芽分化和生根过程中潮霉素B筛选压力,最后对抗性植株进行了潮霉素B筛选基因的PCR检测。结果表明,在MS + 6-BA 5.0 mg/L+AgNO39.0 mg/L培养基中不定芽分化率最高,为84.17%;农杆菌侵染浓度OD600值为0.5、侵染5 min时利于遗传转化,分化率为69.17%;不定芽分化和生根过程中潮霉素B筛选压力分别为4.0 mg/L和30.0 mg/L;潮霉素B筛选基因的PCR鉴定结果,在预期的602 bp处出现了条带,初步证明潮霉素B筛选基因已整合到羽衣甘蓝基因组中。
羽衣甘蓝;农杆菌侵染效率;潮霉素筛选压力浓度
羽衣甘蓝(Brassica oleracea var. acephala),属十字花科芸薹属甘蓝种的变种,转色后心叶色彩丰富艳丽。相对于其他观赏植物,羽衣甘蓝耐寒性强,在我国北方地区作为秋冬观赏花卉进行栽培,但因其品种耐寒性应用区域较窄,若在东北寒冷地区广泛应用,必须提高抗寒性。根癌农杆菌介导的遗传转化方法能有效转入目的基因于植物基因组中,缩短育种年限,提高育种效率,且转化的外源目的基因拷贝数低、稳定,因而广泛应用于植物遗传转化研究中,但其前提条件是必须建立高效的再生体系。
关于羽衣甘蓝的再分化研究较多[1-4],但有关农杆菌介导遗传转化过程中受体材料再分化对农杆菌及筛选剂敏感度影响的研究较少。徐勤青等[5]认为农杆菌浓度和筛选剂剂量等影响着植物材料的遗传转化效率,具有较高再分化率并不代表其遗传转化效率高;苑丽霞等[6]的研究表明,农杆菌浓度和侵染时间影响抗性芽分化率。本试验在前人研究基础上,以红鸥羽衣甘蓝下胚轴为试材,优化不定芽再分化条件,筛选适合侵染的农杆菌浓度、侵染时间及不定芽分化和生根过程中筛选剂潮霉素B的筛选压力,利用PCR方法验证筛选基因的存在与否,旨在为建立农杆菌介导羽衣甘蓝遗传转化体系奠定技术基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 将红鸥羽衣甘蓝种子(购自花卉市场)用10%次氯酸钠溶液消毒10 min,灭菌水冲洗3次,用无菌滤纸吸干水分,按10粒/瓶播种于B5培养基。25℃、黑暗条件下萌发后,转移至25℃,2 000 lx,16 h/d光照条件下,培养7 d,切取1.0 cm左右的下胚轴用于遗传转化。
1.1.2 农杆菌菌液浓度的配置 含PH7WG2D(携带潮霉素B筛选基因)载体的LBA4404农杆菌菌株用于侵染试验。挑取农杆菌LBA4404单菌落于28℃,YEB液体培养基中过夜培养至对数生长期之后,在6 000 r/min下离心5 min,收集菌体。用灭菌MS液体培养基重悬,配置OD600值为0.1、0.3、0.5、0.7和0.9的不同菌液浓度。
1.1.3 培养基的组成 不定芽分化培养基:MS+6-BA 5.0 mg/L + AgNO 9.0 mg/L;共培养培养基:MS+36-BA 1.0 mg/L+ NAA 0.1 mg/L;抑菌分化培养基:MS + 6-BA 5.0 mg/L + AgNO 9.0 mg/L+羧苄霉素5003mg/L;筛选分化培养基:MS+6-BA 5.0 mg/L+AgNO39.0 mg/L+羧苄霉素500 mg/L+潮霉素B 4 mg/L;生根培养基:1/2 MS;生根筛选培养基:1/2 MS+潮霉素B 30 mg/L。
1.2 方法
1.2.1 羽衣甘蓝下胚轴不定芽分化体系的优化 将下胚轴置于添加不同浓度6-BA和AgNO3的MS培养基中(表1),每组合处理40个下胚轴,观察并计算不定芽分化率。
不定芽分化率(%)=分化不定芽的外植体数量/总外植体数量×100 %
1.2.2 农杆菌侵染浓度(OD600值)和侵染时间对不定芽分化的影响 利用不同浓度的农杆菌菌液(OD600值为0.1、0.3、0.5、0.7和0.9)侵染外植体5 min;利用OD600值为0.5的菌液侵染外植体1、3、5、7和9 min后,在共培养培养基中培养2 d,转接于抑菌分化培养基中,观察并调查受体材料的农杆菌感染致死率和不定芽分化率。
致死率(%)=过度污染农杆菌的外植体数量/总外植体数量×100%
1.2.3 潮霉素B筛选压力的确定 下胚轴外植体置于含有不同浓度潮霉素B(0、2.0、4.0、6.0和8.0 mg/L)的筛选分化培养基上,筛选不定芽分化率接近于对照不定芽分化率的半致死浓度。
将不定芽分化培养基中分化的2.0 cm左右的不定芽继代于1/2 MS +潮霉素B(0、10.0、20.0、30.0、40.0和50.0 mg/L)的生根筛选培养基中,筛选生根率接近于对照生根率的半致死浓度。
1.2.4 农杆菌介导遗传转化 采用OD600=0.5的农杆菌菌液侵染下胚轴5 min后,在共培养基中共培养2 d,转移至筛选分化培养基中,当抗性芽生长至2.0 cm左右时,继代于生根筛选培养基20 d,之后转接于生根培养基,其植株用于潮霉素B筛选基因的PCR分子检测。
上述试验均在25℃,2 000 lx,16 h/d光照条件下进行培养,每个处理采用40个外植体,重复3次。
1.2.5 潮霉素B基因分子检测 CTAB法提取抗性植株叶片总DNA,以潮霉素B特异引物(上游引物:5'-GATGTTGGCGACCTCGTATT-3';下游引物:5'-GCGAAGAATCTCGTGCTTTC-3',上海生工合成)进行PCR检测。PCR反应条件:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环;最后72℃延伸10 min,进行电泳检测。
2 结果
2.1 下胚轴不定芽分化体系的优化及分化过程中潮霉素B筛选压力的确定
羽衣甘蓝下胚轴的再分化体系优化实验结果表明,在一定范围内,随着6-BA和AgNO3浓度增加,分化率越来越高(表1),其最高临界浓度分别为5.0 mg/L和9.0 mg/L。在该条件下,下胚轴外植体经培养3-4周,就可分化出不定芽,分化率最高,达84.17%,且每个外植体能够产生4个左右的不定芽(图1),为诱导下胚轴不定芽的最适条件。另外,AgNO3的浓度高于9.0 mg/L时,不定芽的分化率虽高,但出现玻璃化现象。

图1 不定芽分化培养基的下胚轴不定芽分化
潮霉素B浓度对诱导外植体不定芽分化的影响较大(结果未列出)。当潮霉素B浓度为4.0 mg/L时,不定芽的分化率为41.24%,接近于半致死浓度,确定4.0 mg/L为筛选分化浓度。在筛选分化培养基上分化的外植体可产生大量淡黄色愈伤组织,部分愈伤组织可分化出不定芽;部分愈伤组织只分化出无生长点的叶片。另外,接近于50%的下胚轴外植体未形成愈伤组织,发黑、褐化,最终枯死(图2)。

图2 筛选分化培养基(含羧苄霉素500 mg/L)的下胚轴不定芽分化
2.2 农杆菌浓度(OD值)和侵染时间对不定芽分化率的影响
不同农杆菌浓度和侵染时间对受体材料的致死率和不定芽分化率的影响(表2和表3)表明,保持较高不定芽分化率的前提下,OD600值0.5的侵染浓度和5 min的侵染时间是以较高侵染浓度来尽量延长侵染时间的最佳农杆菌侵染条件,其分化率为69.17%。浓度过大或侵染时间过长,会造成农杆菌感染过度而增加受体材料死亡率,从而大幅度降低不定芽分化率,浓度过小或侵染时间过短,会降低农杆菌的侵染机率而影响遗传效果。
2.3 生根过程中潮霉素B筛选压力的确定及抗性植株的获得
潮霉素B浓度对羽衣甘蓝小芽生根率和生长势的影响较大。实验结果显示(数据未列出),随着潮霉素B浓度的增加,随着小芽的生根率减少其生长势也越来越弱。当潮霉素B浓度为20.0 mg/L时,小芽均能产生白色正常的根,存活率达90%以上;当潮霉素B浓度为50.0 mg/L时,所有小芽不能生根且干枯而死;当潮霉素B浓度为30.0 mg/L时,45%小芽可产生白色健壮的根,植株叶片扩展,呈淡绿色,植株生长良好;55%小芽不产生根或产生短小的根,叶片窄小,呈暗紫色或浓绿色,且茎不伸长,整个植株停止生长,最终枯死(图3)。因此,选用30.0 mg/L的潮霉素B浓度作为生根筛选浓度。
将农杆菌侵染之后分化的抗性小芽置于生根筛选培养基培养两周的生长情况。图4显示,一些抗性芽产生黄褐色的根,其植株叶片发黄,最终枯死;部分抗性芽,长出较短的白色根,植株叶片深绿,长势缓慢。此时,将长势缓慢的小植株,继代到生根培养基(不含潮霉素B)中,可获得生长良好的抗性植株。通过该方法获得了3株抗性株系。
2.4 转基因植株的鉴定
PH7WG2D植物表达载体携带潮霉素B筛选基因,因此通过潮霉素B基因存在与否,可间接的判断目的基因是否整合于抗性植株中。经3个抗性株系潮霉素B的PCR鉴定结果(图5)表明,均在602 bp处出现条带,与预期大小相符,初步判断潮霉素B基因已经整合到植物基因组中。
3 讨论
在羽衣甘蓝的离体再生中,6-BA和AgNO3具有至关重要的作用。赵秀枢[7]研究表明,当6-BA浓度大于1.5 mg/L时,不定芽质量呈下降趋势,玻璃化现象明显,而本研究中6-BA浓度5.0 mg/L时,不定芽生成率最高,且无玻璃化现象;但当AgNO3的浓度高于9.0 mg/L时出现玻璃化现象,不定芽分化率也开始出现下降的趋势,表明不同品种之间不定芽再分化条件具有较大的差异。另外,羽衣甘蓝的再分化研究中,激素种类和浓度可引起外植体的褐化现象,所以用AgNO3等乙烯抑制剂,防止外植体褐化是必要的[8,9]。
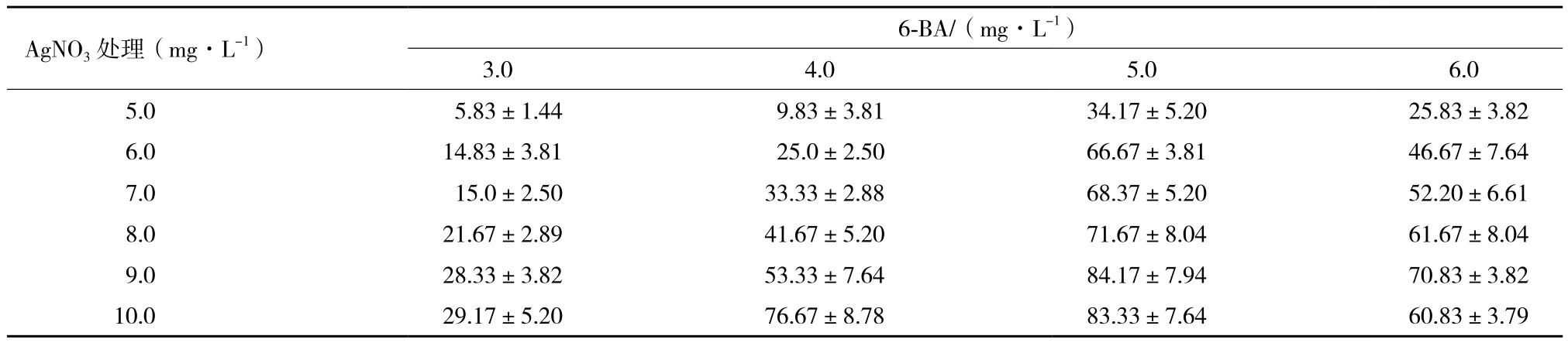
表1 6-BA与AgNO3不同组合对下胚轴不定芽分化率的影响

表2 农杆菌浓度(OD600值)对下胚轴的致死率和不定芽分化率的影响

表3 侵染时间对下胚轴致死率和不定芽分化率的影响*

图3 生根筛选培养基上的芽生长状态

图4 生根筛选培养基上的拟转基因抗性芽生长状态
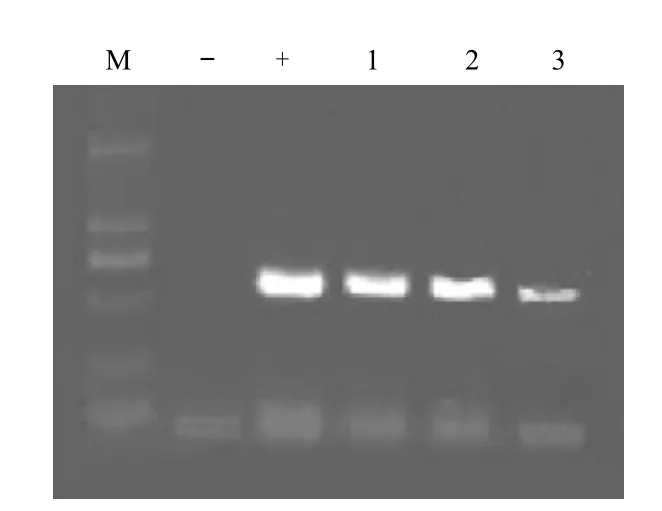
图5 潮霉素B基因PCR检测
农杆菌介导的遗传转化研究中,选用合理的农杆菌的侵染浓度和侵染时间非常重要。菌液浓度过大或感染时间过长,会导致外植体被农杆菌侵染过度而致死;反之,会导致受体细胞未被感染而不能成功进行遗传转化。同属于芸薹属的甘蓝的遗传转化研究中,采用OD600为0.4-0.5时,侵染5-8 min[10];OD600为0.35时,侵染5-10 min[11];OD600为0.6时,侵染3-5 min[12],其再分化效果最佳,表明根据外植体的状态可以适当调节农杆菌的侵染浓度及侵染时间。本试验在保证较高的不定芽分化率前提下,筛选较高农杆菌侵染浓度(OD600值为0.5左右)及较长侵染时间(5 min),从而获得更有效的遗传转化效率。
潮霉素B对谷子、烟草、甘蔗的不定芽分化均有着强烈的抑制作用[13-15]。本研究的敏感性试验结果表明,4.0 mg/L和30.0 mg/L分别为不定芽再分化和生根过程中最适合的筛选压力。进行羽衣甘蓝下胚轴遗传转化时,在含有4.0 mg/L的潮霉素B的筛选分化培养基上诱导抗性芽,再转移至含有30.0 mg/L潮霉素B的生根筛选培养基中,进一步筛选。该方法可尽量保证获得的株系是潮霉素B抗性芽,大幅度减少筛选假阳性株系的可能性。
4 结论
为提高羽衣甘蓝遗传转化效率,以红鸥品种的下胚轴为试材,遴选了根癌农杆菌介导过程中能够保持较高分化率的载体筛选剂剂量及农杆菌的侵染浓度和侵染时间。筛选了MS+6-BA 5.0 mg/L + AgNO39.0 mg/L为最佳不定芽分化培养基;确定了OD600为0.5、侵染时间5 min为最适合的农杆菌的侵染条件;确定了不定芽分化和生根过程中潮霉素B浓度的半致死剂量分别为4.0 mg/L和30.0 mg/L;通过优化条件获得的抗性株系,经PCR鉴定初步证明潮霉素B抗性基因已整合到羽衣甘蓝基因组中。
[1] 卫志明, 黄健秋, 徐淑平, 等. 甘蓝下胚轴的高效再生和农杆菌介导Bt基因转化甘蓝[J]. 上海农业学报, 1998, 14(2):11-18.
[2] 严慧玲, 巩振辉, 贾庆利. 花椰菜下胚轴培养和高频率芽再生技术的研究[J]. 西北农林科技大学报:自然科学版, 2003,31(4):87-90.
[3] 韩晓光, 王玎. 羽衣甘蓝丛生芽诱导和植株再生研究[J]. 安徽农业科学, 2006, 34(3):454-455.
[4] 张文玲, 李凌, 刘凡. 农杆菌介导羽衣甘蓝转化体系的建立[J].西南大学学报:自然科学版, 2010, 32(4):61-65.
[5] 徐勤青, 刘风珍, 万勇善. 影响农杆菌介导花生遗传转化率主要因素的研究[J]. 山东农业大学学报, 2008, 39(2):161-165.
[6] 苑丽霞, 王景雪, 孙毅, 等. 处理时间对农杆菌介导甘蓝转化中抗性芽分化率的影响[J]. 山东农业科学, 2006(2):27-29.
[7] 赵秀枢, 李名扬, 张文玲, 等. 观赏羽衣甘蓝高频再生体系的建立[J]. 基因组学与应用生物学, 2009, 28(1):141-148.
[8] De Block M, Botterman J, Vandewiele M, et al. Engineering herbicide resistance in plants by expression of a detoxifying enzyme[J]. The EMBO Journal, 1987, 6(9):2513-2518.
[9] 高武军, 王景雪, 卢龙斗, 等. 根癌农杆菌介导的油菜基因转化研究进展[J]. 生物学通报, 2002, 37(6):10-12.
[10] 沈革志, 王新其, 朱玉英, 等. TA29-barnase 基因转化甘蓝产生雄性不育植株[J]. 植物生理学报, 2001, 27(1):43-48.
[11] 徐淑平, 卫志明, 黄健秋. 青菜的高效再生和农杆菌介导Bt及CpTI 基因的转化[J]. 植物生理与分子生物学学报, 2002,28(4):253-260.
[12] 王晓峰, 鲁瑞芳, 彭学贤, 等. 结球甘蓝外源基因转化再生时的激素条件研究[J]. 西北农业大学学报, 2000, 28(1):43-47.
[13] 王节之, 郝晓芬, 郑向阳, 等. 谷子潮霉素抗性浓度的筛选与研究[J]. 华北农学报, 1999, 14(4):60-62 .
[14] 王哲, 孙敬克, 王世翔, 等. 烟草潮霉素抗性浓度的筛选与研究[J]. 河南城建学院学报, 2009, 18(4):65-67.
[15] 姚丽, 吴才文, 曾千春. 甘蔗遗传转化中不同阶段潮霉素抗性筛选[J]. 中国糖料, 2010(2):17-19.
(责任编辑 马鑫)
Optimization of Agrobacterium-mediated Transformation System for Brassica oleracea var. acephala with Hypocotyls as Explants
Gao Hang1Gao Yuliang2Li Kuihua1
(1. Agricultural College of Yanbian University,Yanji 133002;2. Yanbian Agricultural Sciences Academy,Longjing 133400)
An efficient transformation method for kale(Brassica oleracea var. acephala)cultivar Hongou was developed using hypocotyls as explant tissues with the following 3 steps:firstly optimizing the differentiation system of adventitious buds;secondly investigating the effects of Agrobacterium infection concentration and time on differentiation rate and the selective concentration of Hygromicin B(Hyg)gene during differentiation and rooting of adventitious buds;finally verifying the selective gene Hyg in the resistant plants by PCR. The highest differentiation rate(84.17%)of adventitious buds was found on MS + 6-BA 5.0 mg/L + AgNO39.0 mg/L medium. An infection concentration OD600of Agrobacterium as 0.5 and infection time for 5 min were favorable for genetic transformation, and the differentiation rate was 69.17%. The selective concentration of Hyg during the differentiation and rooting of adventitious buds were 4.0 mg/L and 30.0 mg/L, respectively. Moreover,the amplified specific gene Hyg bands were observed at the expected 602 bp by PCR analysis, which preliminarily demonstrated that the screened gene Hyg was integrated into the B. oleracea var. acephala genome.
Brassica oleracea var. acephala;Agrobacterium infection efficiency;selective concentration of hygromycin B
10.13560/j.cnki.biotech.bull.1985.2015.06.017
2014-10-13
国家自然科学基金项目(31260470),延边大学启动金项目(2011800-601010018)
高航,女,硕士研究生,研究方向:园艺学;E-mail:1547493298@qq.com
李葵花,副教授,研究方向:园艺学;E-mail:khli@ybu.edu.cn

